名校
解题方法
1 . Ⅰ.我国提出争取在2060年实现碳中和,这对于改善环境、实现绿色发展至关重要。“碳中和”是指CO2的排放总量和减少总量相当。工业上有一种方法是利用CO2生产甲醇(CH3OH); ,该反应过程中的能量变化如图所示:
,该反应过程中的能量变化如图所示:___________ (填“放热”或“吸热”)反应,若有1 mol CO2(g)参加反应,则变化的能量是___________ kJ。
(2)一定条件下,将2 mol CO2和6 mol H2在2 L恒容密闭容器中发生上述反应,经过2 min反应达到了平衡,此时Ch3OH浓度为0.8 mol/L。
①2 min内用CO2表示该反应的速率为:v(CO2)=___________ 。
②平衡时体系内气体压强与开始时的压强之比为___________ 。
③一定能说明该反应达到平衡的标志是___________ 。
A.CO2和CH3OH的物质的量浓度相等
B.CO2和CH3OH物质的量浓度的比值不变
C.混合气体的平均摩尔质量不再改变
D.混合气体的密度保持不变
E.
F.单位时间内3 molH-H键断裂,同时水中有2 mol O-H键断裂
Ⅱ.有人设想寻求合适的催化剂和电极材料,以N2、H2为电极反应物,以HCl-NH4Cl为电解质溶液制造出一种既能提供电能,又能实现氮固定的新型燃料电池,如图所示。___________ 。
(4)假设放电过程中电解质溶液的体积不变,当溶液中H+的物质的量改变0.8 mol时,理论上电池能为外电路提供___________ mol电子。
 ,该反应过程中的能量变化如图所示:
,该反应过程中的能量变化如图所示: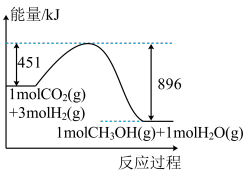
(2)一定条件下,将2 mol CO2和6 mol H2在2 L恒容密闭容器中发生上述反应,经过2 min反应达到了平衡,此时Ch3OH浓度为0.8 mol/L。
①2 min内用CO2表示该反应的速率为:v(CO2)=
②平衡时体系内气体压强与开始时的压强之比为
③一定能说明该反应达到平衡的标志是
A.CO2和CH3OH的物质的量浓度相等
B.CO2和CH3OH物质的量浓度的比值不变
C.混合气体的平均摩尔质量不再改变
D.混合气体的密度保持不变
E.

F.单位时间内3 molH-H键断裂,同时水中有2 mol O-H键断裂
Ⅱ.有人设想寻求合适的催化剂和电极材料,以N2、H2为电极反应物,以HCl-NH4Cl为电解质溶液制造出一种既能提供电能,又能实现氮固定的新型燃料电池,如图所示。
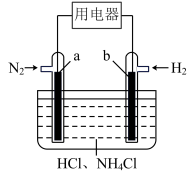
(4)假设放电过程中电解质溶液的体积不变,当溶液中H+的物质的量改变0.8 mol时,理论上电池能为外电路提供
您最近一年使用:0次
名校
解题方法
2 . 下列关于原电池的说法中,正确的是
| A.原电池是一种能把电能转化为化学能的装置 |
| B.原电池的总反应可以不是氧化还原反应 |
| C.原电池的两个电极可以不是金属 |
| D.原电池工作时,电子流入的一极是负极 |
您最近一年使用:0次
名校
解题方法
3 . 甲醇 不仅是一种重要的有机化工原料,也可作为燃料。合成甲醇的方法之一是:
不仅是一种重要的有机化工原料,也可作为燃料。合成甲醇的方法之一是: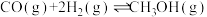 。
。
Ⅰ.在2L的恒容密闭容器中充入1molCO和2mol ,一定条件下发生上述反应,测得反应过程中的能量变化如左图所示,CO和
,一定条件下发生上述反应,测得反应过程中的能量变化如左图所示,CO和 的物质的量变化如右图所示。
的物质的量变化如右图所示。 中的化学键需要吸收的能量为1924kJ,则断开1mol
中的化学键需要吸收的能量为1924kJ,则断开1mol 中所有的化学键所需要吸收
中所有的化学键所需要吸收______ kJ能量。
(2)从反应开始至达到平衡,以 表示的平均反应速率
表示的平均反应速率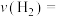
______ 。
(3)下列标志能说明该反应已达到化学平衡状态的是______ (填字母序号)。
(4)达到平衡时,CO的转化率为______ 。
(5)达到平衡后,下列措施能增大逆反应速率的是______ (填字母)。
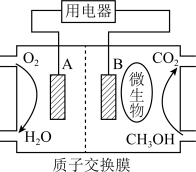
Ⅱ.下图是将获得的甲醇作为燃料,利用其与氧气反应设计而成的一种微生物燃料电池。
已知:该电解质为稀硫酸,质子交换膜只允许通过 。
。______ (填“正极”或“负极”),其电极反应式为______ 。
 不仅是一种重要的有机化工原料,也可作为燃料。合成甲醇的方法之一是:
不仅是一种重要的有机化工原料,也可作为燃料。合成甲醇的方法之一是: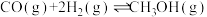 。
。Ⅰ.在2L的恒容密闭容器中充入1molCO和2mol
 ,一定条件下发生上述反应,测得反应过程中的能量变化如左图所示,CO和
,一定条件下发生上述反应,测得反应过程中的能量变化如左图所示,CO和 的物质的量变化如右图所示。
的物质的量变化如右图所示。
 中的化学键需要吸收的能量为1924kJ,则断开1mol
中的化学键需要吸收的能量为1924kJ,则断开1mol 中所有的化学键所需要吸收
中所有的化学键所需要吸收(2)从反应开始至达到平衡,以
 表示的平均反应速率
表示的平均反应速率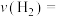
(3)下列标志能说明该反应已达到化学平衡状态的是______ (填字母序号)。
A.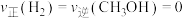 | B.混合气体的总压强不再变化 |
| C.混合气体的密度不再变化 | D.混合气体的平均相对分子质量不再变化 |
(4)达到平衡时,CO的转化率为
(5)达到平衡后,下列措施能增大逆反应速率的是______ (填字母)。
| A.升高温度 | B.降低压强 | C.减小 的浓度 的浓度 | D.加入合适的催化剂 |
Ⅱ.下图是将获得的甲醇作为燃料,利用其与氧气反应设计而成的一种微生物燃料电池。
已知:该电解质为稀硫酸,质子交换膜只允许通过
 。
。
您最近一年使用:0次
名校
4 . 某兴趣小组设计的原电池如图所示,下列说法正确的是

A.放电过程中, 向Cu电极移动 向Cu电极移动 |
B.Cu电极为负极,电极反应式为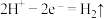 |
| C.电池工作时,电子从Zn电极经电解质溶液流向Cu电极 |
D.当转移2mol电子时,Cu电极生成22.4L |
您最近一年使用:0次
名校
5 . 用 合成燃料甲醇(
合成燃料甲醇( )是碳减排的新方向。某温度下,在体积为0.5L的密闭容器中,充入
)是碳减排的新方向。某温度下,在体积为0.5L的密闭容器中,充入 和
和 ,发生反应
,发生反应 。
。
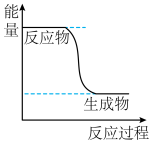
(1)该反应的能量变化如图所示。_____ (填“放热”或“吸热”)反应。
②能判断该反应已达化学平衡状态的标志是_____ (填字母)。
a. 体积分数保持不变
体积分数保持不变
b.容器中混合气体的质量保持不变
c.混合气体的平均相对分子质量保持不变
d. 的生成速率与
的生成速率与 的生成速率相等
的生成速率相等
e.容器中 浓度与
浓度与 浓度之比为1∶3
浓度之比为1∶3
(2) 合成燃料甲醇(
合成燃料甲醇( )的过程中伴随着下列副反应:
)的过程中伴随着下列副反应:
在不同温度下达到平衡,体系中 、
、 的选择性和
的选择性和 的平衡转化率[
的平衡转化率[ ]与温度的关系如图所示:
]与温度的关系如图所示: 的选择性
的选择性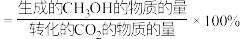 ,在250℃下反应达到平衡时容器中生成
,在250℃下反应达到平衡时容器中生成 的浓度为
的浓度为_____ ,此时 的平衡转化率
的平衡转化率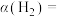
_____ 。
(3)用 和
和 组合形成的质子交换膜燃料电池的结构示意图如图:
组合形成的质子交换膜燃料电池的结构示意图如图: 的一极是
的一极是_____ (填“a”或“b”),若电路中转移 电子,消耗的
电子,消耗的 在标准状况下的体积为
在标准状况下的体积为_____ L。
 合成燃料甲醇(
合成燃料甲醇( )是碳减排的新方向。某温度下,在体积为0.5L的密闭容器中,充入
)是碳减排的新方向。某温度下,在体积为0.5L的密闭容器中,充入 和
和 ,发生反应
,发生反应 。
。(1)该反应的能量变化如图所示。
②能判断该反应已达化学平衡状态的标志是
a.
 体积分数保持不变
体积分数保持不变b.容器中混合气体的质量保持不变
c.混合气体的平均相对分子质量保持不变
d.
 的生成速率与
的生成速率与 的生成速率相等
的生成速率相等e.容器中
 浓度与
浓度与 浓度之比为1∶3
浓度之比为1∶3(2)
 合成燃料甲醇(
合成燃料甲醇( )的过程中伴随着下列副反应:
)的过程中伴随着下列副反应:
在不同温度下达到平衡,体系中
 、
、 的选择性和
的选择性和 的平衡转化率[
的平衡转化率[ ]与温度的关系如图所示:
]与温度的关系如图所示:
 的选择性
的选择性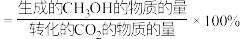 ,在250℃下反应达到平衡时容器中生成
,在250℃下反应达到平衡时容器中生成 的浓度为
的浓度为 的平衡转化率
的平衡转化率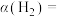
(3)用
 和
和 组合形成的质子交换膜燃料电池的结构示意图如图:
组合形成的质子交换膜燃料电池的结构示意图如图: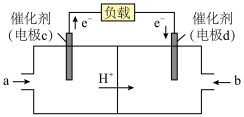
 的一极是
的一极是 电子,消耗的
电子,消耗的 在标准状况下的体积为
在标准状况下的体积为
您最近一年使用:0次
名校
6 . 学习化学反应速率和限度能够指导促进工业生产。
Ⅰ.汽车发动机工作时会引发 和
和 反应,生成
反应,生成 等污染大气,其中生成NO的能量变化如图所示,
等污染大气,其中生成NO的能量变化如图所示,___________ ;若反应生成2mol NO气体应___________ (填“释放”或“吸收”)___________ kJ能量。
Ⅱ.某研究小组用CO和 模拟工业合成甲醇,发生反应:
模拟工业合成甲醇,发生反应: 在1L的恒容密闭容器内充入1mol CO和2mol
在1L的恒容密闭容器内充入1mol CO和2mol  ,加入合适催化剂后保持某温度不变发生上述反应,并用压力计监测容器内压强的变化如下:
,加入合适催化剂后保持某温度不变发生上述反应,并用压力计监测容器内压强的变化如下:
(2)①下列说法正确的是___________ (填标号)。
a.容器内气体的密度不变,则反应达到平衡
b.容器内气体的平均相对分子质量不变,则反应达到平衡
c.若向平衡体系中充入Ar后,甲醇的生成速率降低
d.容器内CO和 物质的量之比不变,则反应达到平衡
物质的量之比不变,则反应达到平衡
e.CO的转化率不再变化,则反应达到平衡
②从反应开始到20min时, 的平均反应速率为
的平均反应速率为___________ 。
③该条件下,反应 达到平衡时CO的转化率为
达到平衡时CO的转化率为___________ 。
(3)利用反应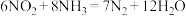 构成原电池的装置如图所示。此方法既能实现有效清除氮化物的排放,减轻环境污染,又能充分利用化学能,回答下列问题:
构成原电池的装置如图所示。此方法既能实现有效清除氮化物的排放,减轻环境污染,又能充分利用化学能,回答下列问题:___________ (填“正极”或“负极”),电极B上发生的电极反应为___________ 。
(4)用NaClO溶液吸收硝酸尾气,可提高尾气中NO的去除率。其他条件相同,NO转化为 的转化率随NaClO溶液初始pH(用稀盐酸调节)的变化如图所示。
的转化率随NaClO溶液初始pH(用稀盐酸调节)的变化如图所示。 和
和 ,其离子方程式为
,其离子方程式为___________ 。
②NaClO溶液的初始pH越小,NO转化率越高,其原因是___________ 。
Ⅰ.汽车发动机工作时会引发
 和
和 反应,生成
反应,生成 等污染大气,其中生成NO的能量变化如图所示,
等污染大气,其中生成NO的能量变化如图所示,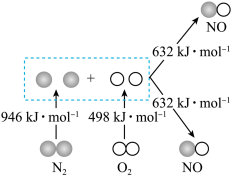
Ⅱ.某研究小组用CO和
 模拟工业合成甲醇,发生反应:
模拟工业合成甲醇,发生反应: 在1L的恒容密闭容器内充入1mol CO和2mol
在1L的恒容密闭容器内充入1mol CO和2mol  ,加入合适催化剂后保持某温度不变发生上述反应,并用压力计监测容器内压强的变化如下:
,加入合适催化剂后保持某温度不变发生上述反应,并用压力计监测容器内压强的变化如下:| 反应时间/min | 0 | 5 | 10 | 15 | 20 | 30 |
| 压强/MPa | 25.2 | 21.6 | 18.9 | 17.4 | 16.8 | 16.8 |
(2)①下列说法正确的是
a.容器内气体的密度不变,则反应达到平衡
b.容器内气体的平均相对分子质量不变,则反应达到平衡
c.若向平衡体系中充入Ar后,甲醇的生成速率降低
d.容器内CO和
 物质的量之比不变,则反应达到平衡
物质的量之比不变,则反应达到平衡e.CO的转化率不再变化,则反应达到平衡
②从反应开始到20min时,
 的平均反应速率为
的平均反应速率为③该条件下,反应
 达到平衡时CO的转化率为
达到平衡时CO的转化率为(3)利用反应
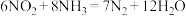 构成原电池的装置如图所示。此方法既能实现有效清除氮化物的排放,减轻环境污染,又能充分利用化学能,回答下列问题:
构成原电池的装置如图所示。此方法既能实现有效清除氮化物的排放,减轻环境污染,又能充分利用化学能,回答下列问题: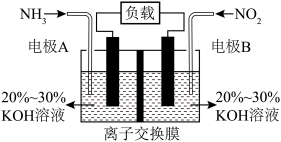
(4)用NaClO溶液吸收硝酸尾气,可提高尾气中NO的去除率。其他条件相同,NO转化为
 的转化率随NaClO溶液初始pH(用稀盐酸调节)的变化如图所示。
的转化率随NaClO溶液初始pH(用稀盐酸调节)的变化如图所示。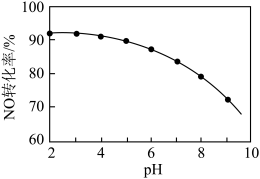
 和
和 ,其离子方程式为
,其离子方程式为②NaClO溶液的初始pH越小,NO转化率越高,其原因是
您最近一年使用:0次
名校
解题方法
7 . 化学电源广泛地应用于现代社会的生产和生活。请回答下列问题:
(1)原电池的设计原理与某类化学反应有关。你认为下列化学反应,可以设计成原电池的是_______(填字母)。
(2)化学反应均涉及相应的能量变化,为探究这些能量变化,某同学设计了如图实验。_______ 。
②Zn棒是_______ 极,电流方向是从_______ 棒流向_______ 棒。
(3)若将两个金属棒用导线相连在一起,总质量为80.00g的锌片和银片同时浸入稀硫酸中,工作一段时间后,取出金属片,进行洗涤、干燥、称量,得金属片的总质量为47.5g,则装置工作时锌片上的电极反应式为_______ ,工作时间内装置所产生氢气的体积为_______ L(标准状况)。
(1)原电池的设计原理与某类化学反应有关。你认为下列化学反应,可以设计成原电池的是_______(填字母)。
A.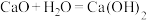 |
B. |
C.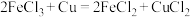 |
D. |
(2)化学反应均涉及相应的能量变化,为探究这些能量变化,某同学设计了如图实验。

②Zn棒是
(3)若将两个金属棒用导线相连在一起,总质量为80.00g的锌片和银片同时浸入稀硫酸中,工作一段时间后,取出金属片,进行洗涤、干燥、称量,得金属片的总质量为47.5g,则装置工作时锌片上的电极反应式为
您最近一年使用:0次
名校
解题方法
8 . 利用热再生氨电池可实现 电镀废液的浓缩再生。电池装置如图所示,甲、乙两室均预加入相同的
电镀废液的浓缩再生。电池装置如图所示,甲、乙两室均预加入相同的 电镀废液,向甲室加入足量氨水后电池开始工作。下列说法正确的是
电镀废液,向甲室加入足量氨水后电池开始工作。下列说法正确的是
 电镀废液的浓缩再生。电池装置如图所示,甲、乙两室均预加入相同的
电镀废液的浓缩再生。电池装置如图所示,甲、乙两室均预加入相同的 电镀废液,向甲室加入足量氨水后电池开始工作。下列说法正确的是
电镀废液,向甲室加入足量氨水后电池开始工作。下列说法正确的是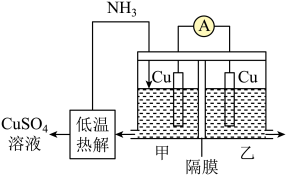
A.甲室 电极为正极 电极为正极 |
| B.隔膜为阳离子交换膜 |
C.电池总反应为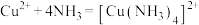 |
D. 扩散到乙室对电池电动势不产生影响 扩散到乙室对电池电动势不产生影响 |
您最近一年使用:0次
解题方法
9 . 工业合成氨反应 是人工固氮研究的重要领域,请回答下列问题:
是人工固氮研究的重要领域,请回答下列问题:
(1)已知相关化学键的键能(常温常压下,断裂或形成 化学键需要吸收或放出的能量)数据如表所示:
化学键需要吸收或放出的能量)数据如表所示:
在工业合成氨反应中,每形成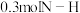 键,反应放出
键,反应放出 能量,则每生成
能量,则每生成
 ,反应放出
,反应放出_______  能量,a=
能量,a=_______ 。
(2)将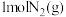 和
和 充入
充入 恒容密闭容器中,发生合成氨反应,在不同温度下,
恒容密闭容器中,发生合成氨反应,在不同温度下, 的体积分数随时间的变化曲线如图1所示。
的体积分数随时间的变化曲线如图1所示。_______ (填标号)。
A.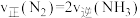
B.容器内压强不再发生变化
C.氮气的体积分数不再发生变化
D.容器内, 与
与 的原子个数之比为1:3
的原子个数之比为1:3
②
_______ (填“>”或“<”) ;
; 点时,
点时, 的转化率
的转化率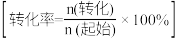 为
为_______ (保留三位有效数字); 点时,
点时,
_______  。
。
(3)将工业合成氨反应设计为原电池,装置如图2所示。 为
为_______ (填化学式),正极发生的电极反应为_______ 。
 是人工固氮研究的重要领域,请回答下列问题:
是人工固氮研究的重要领域,请回答下列问题:(1)已知相关化学键的键能(常温常压下,断裂或形成
 化学键需要吸收或放出的能量)数据如表所示:
化学键需要吸收或放出的能量)数据如表所示:| 化学键 |  | N-H | H-H |
键能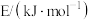 | a | 391 | 436 |
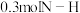 键,反应放出
键,反应放出 能量,则每生成
能量,则每生成
 ,反应放出
,反应放出 能量,a=
能量,a=(2)将
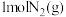 和
和 充入
充入 恒容密闭容器中,发生合成氨反应,在不同温度下,
恒容密闭容器中,发生合成氨反应,在不同温度下, 的体积分数随时间的变化曲线如图1所示。
的体积分数随时间的变化曲线如图1所示。
A.
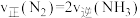
B.容器内压强不再发生变化
C.氮气的体积分数不再发生变化
D.容器内,
 与
与 的原子个数之比为1:3
的原子个数之比为1:3②

 ;
; 点时,
点时, 的转化率
的转化率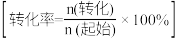 为
为 点时,
点时,
 。
。(3)将工业合成氨反应设计为原电池,装置如图2所示。
 为
为
您最近一年使用:0次
名校
10 . 回答下列问题。
Ⅰ:为有效降低含氮化物的排放量,又能充分利用化学能,合作小组利用反应 设计如图所示电池(离子交换膜对溶液里的离子具有选择透过能力)。
设计如图所示电池(离子交换膜对溶液里的离子具有选择透过能力)。_______ (填正极或负极),电子的移动方向:_______ 经负载至_______ (填电极A或电极B)
(2)负极的电极反应为:_______ 。
(3)同温同压时,左右两侧电极室中产生的气体体积比为_______ 。
Ⅱ:原电池装置如图所示,回答下列问题。_______ 。
(5)浸有饱和KCl溶液的滤纸条的作用是什么:_______ 。
(6)滤纸条中K+移向_______ ,Cl-移向_______ (填甲池或者乙池)。
Ⅰ:为有效降低含氮化物的排放量,又能充分利用化学能,合作小组利用反应
 设计如图所示电池(离子交换膜对溶液里的离子具有选择透过能力)。
设计如图所示电池(离子交换膜对溶液里的离子具有选择透过能力)。
(2)负极的电极反应为:
(3)同温同压时,左右两侧电极室中产生的气体体积比为
Ⅱ:原电池装置如图所示,回答下列问题。
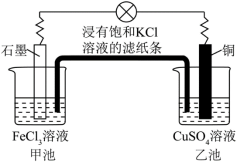
(5)浸有饱和KCl溶液的滤纸条的作用是什么:
(6)滤纸条中K+移向
您最近一年使用:0次



