解题方法
1 . 人类利用二氧化碳合成淀粉对社会的发展起着重要作用,合成过程首先是利用二氧化碳制备甲醇,合成甲醇的反应为:CO2+3H2 CH3OH+H2O ∆H1。回答下列问题:
CH3OH+H2O ∆H1。回答下列问题:
(1)已知:①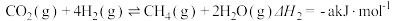
②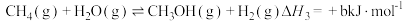
③ 均为大于零的数,且
均为大于零的数,且

___________  (用含
(用含 、
、 的式子表示)。甲醇熔融碳酸盐燃料电池的正极(含
的式子表示)。甲醇熔融碳酸盐燃料电池的正极(含 )电极反应式为
)电极反应式为___________ 。
(2)研究合成甲醇的催化剂时,在其他条件不变仅改变催化剂种类的情况下,对反应器出口产品进行成分分析,结果如图所示。在以上催化剂中,该反应的最佳催化剂为___________ (填化学式)。 的产率。为了研究水分子对该反应机制的内在影响,我国学者利用计算机模拟,研究添加适量水蒸气前后对能垒较大的反应历程能量变化的影响(如图所示,吸附在催化剂表面的物种用*标注)。
的产率。为了研究水分子对该反应机制的内在影响,我国学者利用计算机模拟,研究添加适量水蒸气前后对能垒较大的反应历程能量变化的影响(如图所示,吸附在催化剂表面的物种用*标注)。___________ 。
②结合上图及学过的知识推测,有水参与的历程,反应速率加快的原因是___________ 。
(4)在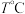 时,将
时,将 和
和 充入容积为
充入容积为 的恒容容器中,只发生
的恒容容器中,只发生 ,测得体系中剩余
,测得体系中剩余 的物质的量随时间变化如图中状态Ⅰ所示。
的物质的量随时间变化如图中状态Ⅰ所示。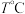 时,
时, 内甲醇的反应速率
内甲醇的反应速率
___________  。
。
②该反应的平衡常数表达式为___________ 。
③保持投料量不变,仅改变某一个条件后,测得 随时间变化如图中状态Ⅲ所示,与状态Ⅰ相比,状态Ⅲ改变的条件可能是
随时间变化如图中状态Ⅲ所示,与状态Ⅰ相比,状态Ⅲ改变的条件可能是___________ 。
 CH3OH+H2O ∆H1。回答下列问题:
CH3OH+H2O ∆H1。回答下列问题:(1)已知:①
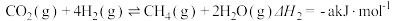
②
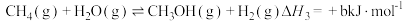
③
 均为大于零的数,且
均为大于零的数,且

 (用含
(用含 、
、 的式子表示)。甲醇熔融碳酸盐燃料电池的正极(含
的式子表示)。甲醇熔融碳酸盐燃料电池的正极(含 )电极反应式为
)电极反应式为(2)研究合成甲醇的催化剂时,在其他条件不变仅改变催化剂种类的情况下,对反应器出口产品进行成分分析,结果如图所示。在以上催化剂中,该反应的最佳催化剂为
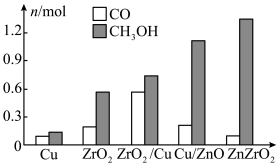
 的产率。为了研究水分子对该反应机制的内在影响,我国学者利用计算机模拟,研究添加适量水蒸气前后对能垒较大的反应历程能量变化的影响(如图所示,吸附在催化剂表面的物种用*标注)。
的产率。为了研究水分子对该反应机制的内在影响,我国学者利用计算机模拟,研究添加适量水蒸气前后对能垒较大的反应历程能量变化的影响(如图所示,吸附在催化剂表面的物种用*标注)。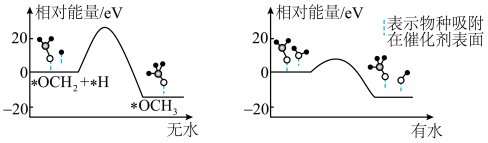
②结合上图及学过的知识推测,有水参与的历程,反应速率加快的原因是
(4)在
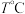 时,将
时,将 和
和 充入容积为
充入容积为 的恒容容器中,只发生
的恒容容器中,只发生 ,测得体系中剩余
,测得体系中剩余 的物质的量随时间变化如图中状态Ⅰ所示。
的物质的量随时间变化如图中状态Ⅰ所示。
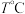 时,
时, 内甲醇的反应速率
内甲醇的反应速率
 。
。②该反应的平衡常数表达式为
③保持投料量不变,仅改变某一个条件后,测得
 随时间变化如图中状态Ⅲ所示,与状态Ⅰ相比,状态Ⅲ改变的条件可能是
随时间变化如图中状态Ⅲ所示,与状态Ⅰ相比,状态Ⅲ改变的条件可能是
您最近一年使用:0次
2 .  是一种具有强温室效应的分子,将其先转化为合成气
是一种具有强温室效应的分子,将其先转化为合成气 再合成液态链烃或芳香烃是实现碳中和的重要途径,请回答下列问题。
再合成液态链烃或芳香烃是实现碳中和的重要途径,请回答下列问题。
(1)已知H2、CO和C10H22(正癸烷, )的燃烧热依次是
)的燃烧热依次是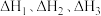 ,则反应
,则反应 的反应热
的反应热
_______ (用含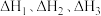 的代数式表示)。
的代数式表示)。
(2)氢气作为理想能源的原因_______ (写出一个原因即可)。
(3)甲烷转化为合成气主要是在催化剂的作用下发生如下反应:
 反应I
反应I
 反应Ⅱ
反应Ⅱ
①向一定温度下的 刚性容器中充入
刚性容器中充入 甲烷和
甲烷和 水蒸气,
水蒸气, 后体系达平衡状态,此时容器中含有
后体系达平衡状态,此时容器中含有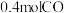 和
和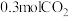 ,则
,则 内反应I的平均速率
内反应I的平均速率 =
=_______  ,写出该温度下反应Ⅱ的平衡常数为
,写出该温度下反应Ⅱ的平衡常数为_______ 。
②在起始投料比一定的密闭容器中,温度对 平衡转化率、
平衡转化率、 选择性、
选择性、 选择性的影响如图所示,其中表示
选择性的影响如图所示,其中表示 选择性的曲线是
选择性的曲线是_______ (填“ ”、“
”、“ ”或“
”或“ ”)。
”)。_______ 。
②若放电一段时间后,消耗氧气2.24L(标准状况),理论上外电路转移电子的物质的量为_______ 。
 是一种具有强温室效应的分子,将其先转化为合成气
是一种具有强温室效应的分子,将其先转化为合成气 再合成液态链烃或芳香烃是实现碳中和的重要途径,请回答下列问题。
再合成液态链烃或芳香烃是实现碳中和的重要途径,请回答下列问题。(1)已知H2、CO和C10H22(正癸烷,
 )的燃烧热依次是
)的燃烧热依次是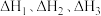 ,则反应
,则反应 的反应热
的反应热
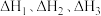 的代数式表示)。
的代数式表示)。(2)氢气作为理想能源的原因
(3)甲烷转化为合成气主要是在催化剂的作用下发生如下反应:
 反应I
反应I 反应Ⅱ
反应Ⅱ①向一定温度下的
 刚性容器中充入
刚性容器中充入 甲烷和
甲烷和 水蒸气,
水蒸气, 后体系达平衡状态,此时容器中含有
后体系达平衡状态,此时容器中含有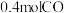 和
和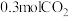 ,则
,则 内反应I的平均速率
内反应I的平均速率 =
= ,写出该温度下反应Ⅱ的平衡常数为
,写出该温度下反应Ⅱ的平衡常数为②在起始投料比一定的密闭容器中,温度对
 平衡转化率、
平衡转化率、 选择性、
选择性、 选择性的影响如图所示,其中表示
选择性的影响如图所示,其中表示 选择性的曲线是
选择性的曲线是 ”、“
”、“ ”或“
”或“ ”)。
”)。

②若放电一段时间后,消耗氧气2.24L(标准状况),理论上外电路转移电子的物质的量为
您最近一年使用:0次
2024-05-12更新
|
67次组卷
|
2卷引用:天津市河北区2023-2024学年高三下学期二模化学试卷
2024·广东佛山·二模
3 . 某实验小组利用如图装置探究电化学法保护铁制品的原理。反应一段时间后,下列说法错误的是
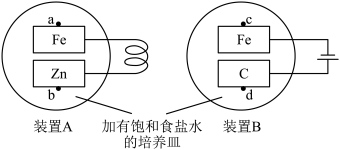

| A.装置A利用的是牺牲阳极法 |
B.取a处溶液,滴加 溶液,有蓝色沉淀 溶液,有蓝色沉淀 |
| C.向c处滴加几滴酚酞溶液,变红 |
| D.在d处上方放置湿润的淀粉-KI试纸,试纸变蓝 |
您最近一年使用:0次
2024-05-11更新
|
591次组卷
|
3卷引用:化学(天津卷02)-2024年高考化学押题预测卷
名校
解题方法
4 . 按要求写出下列反应的方程式:
(1)实验室制氨气的化学方程式:___________ 。
(2)浓硝酸久置呈黄色的原因用化学方程式解释:___________ 。
(3)工业制粗硅的化学方程式:___________ 。
(4)往硅酸钠溶液中通入过量二氧化碳的离子方程式:___________ 。
(5) 与稀硫酸反应的离子方程式:
与稀硫酸反应的离子方程式:___________ 。
(6)澄清石灰水中通入少量 的离子方程式:
的离子方程式:___________ 。
(7)银锌电池是一种常见的化学电源,其反应原理: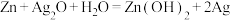 ,其工作原理如图所示。
,其工作原理如图所示。 电极反应式为
电极反应式为___________ 。
(8)将用导线相连的两个铂电极插入 溶液中,然后向两极分别通入
溶液中,然后向两极分别通入 和
和 ,则发生了原电池反应,该原电池中的负极反应式为
,则发生了原电池反应,该原电池中的负极反应式为___________ 。
(1)实验室制氨气的化学方程式:
(2)浓硝酸久置呈黄色的原因用化学方程式解释:
(3)工业制粗硅的化学方程式:
(4)往硅酸钠溶液中通入过量二氧化碳的离子方程式:
(5)
 与稀硫酸反应的离子方程式:
与稀硫酸反应的离子方程式:(6)澄清石灰水中通入少量
 的离子方程式:
的离子方程式:(7)银锌电池是一种常见的化学电源,其反应原理:
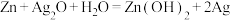 ,其工作原理如图所示。
,其工作原理如图所示。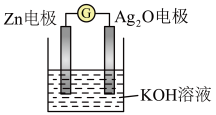
 电极反应式为
电极反应式为(8)将用导线相连的两个铂电极插入
 溶液中,然后向两极分别通入
溶液中,然后向两极分别通入 和
和 ,则发生了原电池反应,该原电池中的负极反应式为
,则发生了原电池反应,该原电池中的负极反应式为
您最近一年使用:0次
名校
解题方法
5 . 流动电池是一种新型电池。其主要特点是可以通过电解质溶液的循环流动,在电池外部调节电解质溶液,以保持电池内部电极周围溶液浓度的稳定。北京化工大学新开发的一种流动电池如图所示,电池总反应为 。
。
 。
。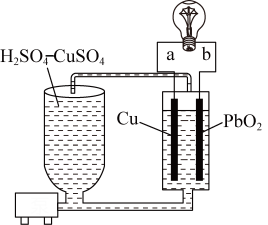
A. 为负极,a为正极 为负极,a为正极 |
B.该电池工作时,电流由电极a流向电极 |
C. 极的电极反应式为 极的电极反应式为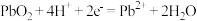 |
D.调节电解质溶液的方法是补充 |
您最近一年使用:0次
6 . 钠基海水电池,如图所示,电极材料为钠基材料和选择性催化材料(能抑制海水中 的吸附和氧化),固体电解质只允许
的吸附和氧化),固体电解质只允许 透过。下列说法正确的是
透过。下列说法正确的是
 的吸附和氧化),固体电解质只允许
的吸附和氧化),固体电解质只允许 透过。下列说法正确的是
透过。下列说法正确的是
| A.放电时,a电极为负极 |
| B.放电时,b电极的电势低于a电极 |
C.充电时,b电极的电极反应式为: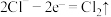 |
| D.充电时,阳极区碱性增强 |
您最近一年使用:0次
名校
解题方法
7 . Ⅰ.判断吸热反应与放热反应
(1)下列变化:①铝片与稀盐酸的反应;② 晶体与
晶体与 晶体混合反应;
晶体混合反应;
③浓硫酸溶于水;④氯酸钾分解制氧气;⑤生石灰与水反应生成熟石灰。属于吸热反应的是______ (填序号),属于放热反应的是______ (填序号)。
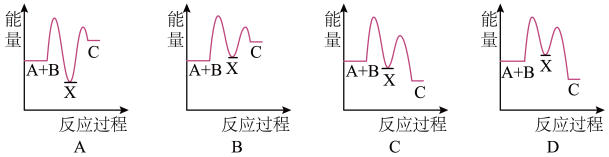
(2)反应A+B→C(放热)分两步进行:①A+B→X(吸热);②X→C(放热)。下列示意图中,能正确表示总反应过程中能量变化的是____________ 。______ 极(填“正”或“负”),发生______ (填“氧化”或“还原”)反应,此电极反应方程式为____________ 。
(4)若反应中溶解了6.5 g锌,则生成的氢气标况下的体积为______ L。
Ⅲ.A、B、C、D均为中学化学常见的纯净物。它们之间有如下的反应关系:______ ,A→C的反应方程式为:____________ 。
(6)若B是气态氢化物,C、D是氧化物且会造成光化学烟雾污染。B与C在一定条件下反应生成的A单质是大气的主要成分,写出反应③的化学方程式:____________ 。
(7)若单质A是太阳能电池用的光伏材料,C、D为钠盐,两种盐中除钠、氧外的元素为同一主族,且溶液均显碱性。
D的化学式是______ ,写出④反应的化学方程式:____________ 。
Ⅳ.某同学将搜集到的一定量的酸雨保存在密闭容器中,每隔一定时间测酸雨的pH,发现在起始一段时间内,酸雨的酸性呈逐渐增强的趋势:
(8)用离子方程式解释原因:____________ 。
(9)实验室模拟二氧化硫在葡萄酒中的抗氧化过程,向溴水中通入 ,请用离子方程式表示该反应原理
,请用离子方程式表示该反应原理____________ 。
(10)向 溶液中通入
溶液中通入 至饱和,此过程无明显现象,再向溶液中加入一种物质,溶液变浑浊。加入的这种物质
至饱和,此过程无明显现象,再向溶液中加入一种物质,溶液变浑浊。加入的这种物质不可能 是______。
(1)下列变化:①铝片与稀盐酸的反应;②
 晶体与
晶体与 晶体混合反应;
晶体混合反应;③浓硫酸溶于水;④氯酸钾分解制氧气;⑤生石灰与水反应生成熟石灰。属于吸热反应的是
(2)反应A+B→C(放热)分两步进行:①A+B→X(吸热);②X→C(放热)。下列示意图中,能正确表示总反应过程中能量变化的是

(4)若反应中溶解了6.5 g锌,则生成的氢气标况下的体积为
Ⅲ.A、B、C、D均为中学化学常见的纯净物。它们之间有如下的反应关系:

(6)若B是气态氢化物,C、D是氧化物且会造成光化学烟雾污染。B与C在一定条件下反应生成的A单质是大气的主要成分,写出反应③的化学方程式:
(7)若单质A是太阳能电池用的光伏材料,C、D为钠盐,两种盐中除钠、氧外的元素为同一主族,且溶液均显碱性。
D的化学式是
Ⅳ.某同学将搜集到的一定量的酸雨保存在密闭容器中,每隔一定时间测酸雨的pH,发现在起始一段时间内,酸雨的酸性呈逐渐增强的趋势:
(8)用离子方程式解释原因:
(9)实验室模拟二氧化硫在葡萄酒中的抗氧化过程,向溴水中通入
 ,请用离子方程式表示该反应原理
,请用离子方程式表示该反应原理(10)向
 溶液中通入
溶液中通入 至饱和,此过程无明显现象,再向溶液中加入一种物质,溶液变浑浊。加入的这种物质
至饱和,此过程无明显现象,再向溶液中加入一种物质,溶液变浑浊。加入的这种物质A. | B. | C. | D. |
您最近一年使用:0次
2024·天津·模拟预测
8 . 黄铁矿[主要成分为二硫化亚铁(FeS2)]、焦炭和适量空气混合加热发生如下反应:
i.3FeS2+2C+3O2=3S2+Fe3O4+2CO
(1)反应i生成1molS2时,转移电子的物质的量为___________ mol。
(2)反应i所得气体经冷凝回收S2后,尾气中还含有CO和SO2.将尾气通过催化剂进行处理,发生反应ii,同时发生副反应iii。
ii.2SO2(g)+4CO(g) S2(g)+4CO2(g) ΔH<0
S2(g)+4CO2(g) ΔH<0
iii.SO2(g)+3CO(g) COS(g)+2CO2(g) ΔH<0
COS(g)+2CO2(g) ΔH<0
理论分析及实验结果表明,600~1000K范围内,SO2平衡转化率接近100%。其他条件相同,不同温度下,S2、COS平衡产率和10min时S2实际产率如图。___________ 。
②随温度升高,S2平衡产率上升,推测其原因是___________ 。
③900K,在10min后继续反应足够长时间,推测S2实际产率的变化趋势可能为___________ 。
(3)处理后的尾气仍含少量SO2,经Na2CO3溶液洗脱处理后,所得洗脱液主要成分为Na2CO3、NaHCO3和Na2SO3.利用生物电池技术,可将洗脱液中的Na2SO3转化为单质硫(以S表示)回收。___________ 。
②一段时间后,若洗脱液中 的物质的量减小了1mol,则理论上
的物质的量减小了1mol,则理论上 减小了
减小了___________ mol。
(4)常温向 溶液中加入适量的NaOH,溶液中
溶液中加入适量的NaOH,溶液中 、
、 、
、 的分布系数
的分布系数 随pOH的变化如图。
随pOH的变化如图。___________ 。
A.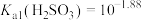
B.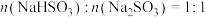 时,溶液显酸性
时,溶液显酸性
C.N点对应的溶液,对水的电离起到抑制作用
i.3FeS2+2C+3O2=3S2+Fe3O4+2CO
(1)反应i生成1molS2时,转移电子的物质的量为
(2)反应i所得气体经冷凝回收S2后,尾气中还含有CO和SO2.将尾气通过催化剂进行处理,发生反应ii,同时发生副反应iii。
ii.2SO2(g)+4CO(g)
 S2(g)+4CO2(g) ΔH<0
S2(g)+4CO2(g) ΔH<0iii.SO2(g)+3CO(g)
 COS(g)+2CO2(g) ΔH<0
COS(g)+2CO2(g) ΔH<0理论分析及实验结果表明,600~1000K范围内,SO2平衡转化率接近100%。其他条件相同,不同温度下,S2、COS平衡产率和10min时S2实际产率如图。

②随温度升高,S2平衡产率上升,推测其原因是
③900K,在10min后继续反应足够长时间,推测S2实际产率的变化趋势可能为
(3)处理后的尾气仍含少量SO2,经Na2CO3溶液洗脱处理后,所得洗脱液主要成分为Na2CO3、NaHCO3和Na2SO3.利用生物电池技术,可将洗脱液中的Na2SO3转化为单质硫(以S表示)回收。

②一段时间后,若洗脱液中
 的物质的量减小了1mol,则理论上
的物质的量减小了1mol,则理论上 减小了
减小了(4)常温向
 溶液中加入适量的NaOH,溶液中
溶液中加入适量的NaOH,溶液中 、
、 、
、 的分布系数
的分布系数 随pOH的变化如图。
随pOH的变化如图。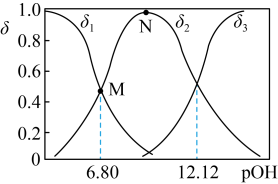
A.
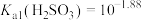
B.
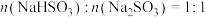 时,溶液显酸性
时,溶液显酸性C.N点对应的溶液,对水的电离起到抑制作用
您最近一年使用:0次
2024·广西·二模
9 . 乙烯是世界上产量最大的化学产品之一,是合成纤维、合成橡胶基本化工原料。二氧化碳氧化乙烷脱氢制乙烯为生产乙烯提供了新途径。一定温度下, 与
与 在催化剂表面发生如下反应:
在催化剂表面发生如下反应:
Ⅰ.
Ⅱ.
Ⅲ.
Ⅳ.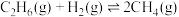
已知部分共价键的键能如下表所示:
回答下列问题:
(1)反应Ⅱ:

________  ,该反应的反应物和生成物中,属于
,该反应的反应物和生成物中,属于 杂化的原子种类有
杂化的原子种类有________ 种。
(2)用惰性气体与 混合作为反应气体时只发生反应Ⅰ:
混合作为反应气体时只发生反应Ⅰ: ,在923K、100kpa恒温恒压条件下,将
,在923K、100kpa恒温恒压条件下,将 的混合气体进行
的混合气体进行 脱氢反应,平衡时
脱氢反应,平衡时 的转化率为b,则该反应平衡常数
的转化率为b,则该反应平衡常数
________ kpa(用含a、b的代数式表示)。
(3)在一定条件下
 反应达到平衡状态,当改变反应的某一条件后,下列变化能说明平衡一定向正反应方向移动的是________。
反应达到平衡状态,当改变反应的某一条件后,下列变化能说明平衡一定向正反应方向移动的是________。
(4)反应Ⅱ:
 是提高乙烯产率的关键,但同时发生副反应Ⅲ。
是提高乙烯产率的关键,但同时发生副反应Ⅲ。
①为提高反应Ⅱ的平衡转化率,应选择的反应条件为________ 。
A.低温、高压 B.高温、低压 C.低温、低压 D.高温、高压
②基于上述反应,在催化剂表面 与
与 发生脱氢制乙烯的总反应为:
发生脱氢制乙烯的总反应为: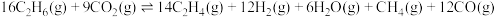 ,该反应温度常控制在600℃左右,其原因是
,该反应温度常控制在600℃左右,其原因是________ 。
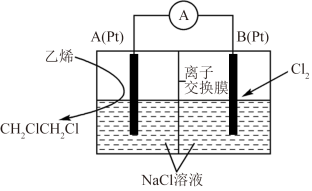
(5)乙烯氯化反应合成1,2-二氯乙烷电化学装置如图所示,A、B为多孔铂电极分别通入乙烯和氯气。A电极的电极反应式为________ ,离子交换膜为________ (填“阴离子”或“阳离子”)交换膜。
 与
与 在催化剂表面发生如下反应:
在催化剂表面发生如下反应:Ⅰ.

Ⅱ.

Ⅲ.

Ⅳ.
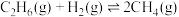
已知部分共价键的键能如下表所示:
共价键 | C-H | H-H | H-O | C=O |
键能 | 413 | 436 | 464 | 799 |
(1)反应Ⅱ:


 ,该反应的反应物和生成物中,属于
,该反应的反应物和生成物中,属于 杂化的原子种类有
杂化的原子种类有(2)用惰性气体与
 混合作为反应气体时只发生反应Ⅰ:
混合作为反应气体时只发生反应Ⅰ: ,在923K、100kpa恒温恒压条件下,将
,在923K、100kpa恒温恒压条件下,将 的混合气体进行
的混合气体进行 脱氢反应,平衡时
脱氢反应,平衡时 的转化率为b,则该反应平衡常数
的转化率为b,则该反应平衡常数
(3)在一定条件下

 反应达到平衡状态,当改变反应的某一条件后,下列变化能说明平衡一定向正反应方向移动的是________。
反应达到平衡状态,当改变反应的某一条件后,下列变化能说明平衡一定向正反应方向移动的是________。| A.正反应速率先增大后减小 | B.混合气体密度增大 |
| C.反应物的体积百分数增大 | D.化学平衡常数K值增大 |
(4)反应Ⅱ:

 是提高乙烯产率的关键,但同时发生副反应Ⅲ。
是提高乙烯产率的关键,但同时发生副反应Ⅲ。①为提高反应Ⅱ的平衡转化率,应选择的反应条件为
A.低温、高压 B.高温、低压 C.低温、低压 D.高温、高压
②基于上述反应,在催化剂表面
 与
与 发生脱氢制乙烯的总反应为:
发生脱氢制乙烯的总反应为: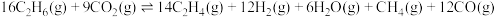 ,该反应温度常控制在600℃左右,其原因是
,该反应温度常控制在600℃左右,其原因是(5)乙烯氯化反应合成1,2-二氯乙烷电化学装置如图所示,A、B为多孔铂电极分别通入乙烯和氯气。A电极的电极反应式为
您最近一年使用:0次
2024·河北·二模
名校
10 . 下列对实验的叙述正确的是

| A.图甲,盐桥(装有含KCI饱和溶液的琼脂)中的Cl-移向CuSO4溶液 |
| B.图乙,可用来探究催化剂对化学反应速率的影响 |
| C.图丙,可用来制取少量CO2气体 |
| D.图丁,可用来验证浓硫酸具有脱水性、强氧化性,SO2具有漂白性、还原性 |
您最近一年使用:0次




