名校
1 . 下列说法正确的是
A.明矾水解形成的 胶体能杀菌消毒,可用于水的净化 胶体能杀菌消毒,可用于水的净化 |
| B.镀锡的铁制品比镀锌的铁制品耐腐蚀 |
| C.二次电池充电时,电池上标有“+”的电极应与外接电源的负极相连 |
D.25℃时, 的某溶液一定呈酸性 的某溶液一定呈酸性 |
您最近一年使用:0次
2 . 通过下列实验可以从废铜屑中制取 。
。
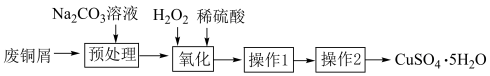
(1) 溶液显碱性的原因(用离子方程式表示):
溶液显碱性的原因(用离子方程式表示):_______ ,加入 溶液的作用
溶液的作用________ 。
(2)“氧化”时反应的离子方程式_________ 。
(3)操作1为过滤,使用玻璃棒的作用是_________ ,操作2为___________ 。
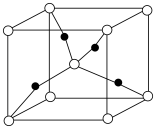
(4)将 加热到
加热到 以上会分解得到
以上会分解得到 ,1个
,1个 晶胞(如图)中含
晶胞(如图)中含_______ 个氧原子。
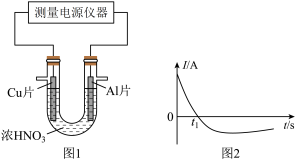
(5)常温下,将除去表面氧化膜的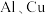 片插入浓
片插入浓 中组成原电池(图1),测得原电池的电流强度(I)随时间
中组成原电池(图1),测得原电池的电流强度(I)随时间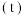 的变化如(图2)所示,反应过程中有红棕色气体产生。
的变化如(图2)所示,反应过程中有红棕色气体产生。 时,原电池的负极是
时,原电池的负极是 片,此时,正极的电极反应式是
片,此时,正极的电极反应式是___________ , 时,原电池中电子流动方向发生改变,其原因是:
时,原电池中电子流动方向发生改变,其原因是:___________ 。
 。
。
(1)
 溶液显碱性的原因(用离子方程式表示):
溶液显碱性的原因(用离子方程式表示): 溶液的作用
溶液的作用(2)“氧化”时反应的离子方程式
(3)操作1为过滤,使用玻璃棒的作用是
(4)将
 加热到
加热到 以上会分解得到
以上会分解得到 ,1个
,1个 晶胞(如图)中含
晶胞(如图)中含
(5)常温下,将除去表面氧化膜的
 片插入浓
片插入浓 中组成原电池(图1),测得原电池的电流强度(I)随时间
中组成原电池(图1),测得原电池的电流强度(I)随时间 的变化如(图2)所示,反应过程中有红棕色气体产生。
的变化如(图2)所示,反应过程中有红棕色气体产生。 时,原电池的负极是
时,原电池的负极是 片,此时,正极的电极反应式是
片,此时,正极的电极反应式是 时,原电池中电子流动方向发生改变,其原因是:
时,原电池中电子流动方向发生改变,其原因是:
您最近一年使用:0次
2024-02-29更新
|
204次组卷
|
2卷引用:天津市宁河区2023-2024学年高三上学期期末考试化学试题
解题方法
3 . 一种新型微生物燃料电池可用于污水净化、海水淡化,其工作原理如图所示。下列说法错误的是
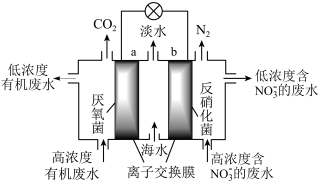
| A.a极为电池的负极 |
B.处理 的电极反应为 的电极反应为 |
C.海水淡化的原理是电池工作时, 移向右室, 移向右室, 移向左室 移向左室 |
D.若用 表示有机废水中的有机物,则每消耗 表示有机废水中的有机物,则每消耗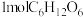 转移 转移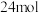 电子 电子 |
您最近一年使用:0次
名校
解题方法
4 . 为了探究化学反应中的能量变化,某同学设计了如图两个实验(图I、图II中除连接的铜棒不同外,其他均相同),下列说法中不正确的是
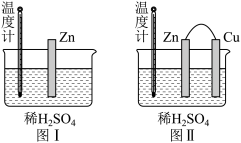
| A.两个实验均能表明锌和稀硫酸反应的ΔH<0 |
| B.图I中锌棒溶解的速率比图II的慢 |
| C.图I和图II中温度计的示数相等,且均高于室温 |
| D.图I中气泡产生于锌棒表面,图II中的气泡产生于铜棒表面 |
您最近一年使用:0次
2022-08-25更新
|
216次组卷
|
3卷引用:天津市宁河区芦台第一中学2022-2023学年高二上学期期末考试化学试题
天津市宁河区芦台第一中学2022-2023学年高二上学期期末考试化学试题辽宁省朝阳市凌源市实验中学2022-2023学年高二上学期8月月考化学试题(已下线)4.1.1 原电池的工作原理-2022-2023学年高二化学上学期课后培优分级练(人教版2019选择性必修1)
名校
5 . 国家重点研发计划“科技冬奥”专项——“氢能出行关键技术研究与应用示范”项目负责人杨福源教授介绍,服务北京2022年冬奥会冬残奥会的6款氢燃料电池客车已完成整车测试,“零碳排放”氢能汽车将正式开启绿色出行。某种酸性氢燃料电池的内部结构如图,下列说法正确的是
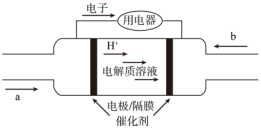

| A.左侧电极是负极,发生还原反应 |
| B.当有0.1mole-通过导线时,左侧消耗标况下0.56L气体 |
| C.左侧电极反应式为H2-2e-=2H+ |
| D.右侧电极反应式为O2+2H2O+4e-=4OH- |
您最近一年使用:0次
2022-04-10更新
|
547次组卷
|
2卷引用:天津市宁河区芦台第一中学2021-2022学年高一下学期线上阶段适应练习化学试题
6 . 下列有关电池的说法正确的是
| A.铅蓄电池放电过程中,负极质量增重,正极不变 |
| B.铅蓄电池是可充电电池,电池的负极材料为PbO2 |
| C.燃料电池是一种高效且对环境友好的新型电池 |
| D.铜锌原电池工作时,电子沿外电路从铜电极流向锌电极 |
您最近一年使用:0次
2022-04-10更新
|
280次组卷
|
2卷引用:天津市宁河区芦台第一中学2021-2022学年高一下学期线上阶段适应练习化学试题
名校
解题方法
7 . 有机物液流电池因其电化学性能可调控等优点而备受关注。南京大学研究团队设计了一种水系分散的聚合物微粒“泥浆”电池(图1)。该电池在充电过程中,聚对苯二酚被氧化,下列说法错误的是
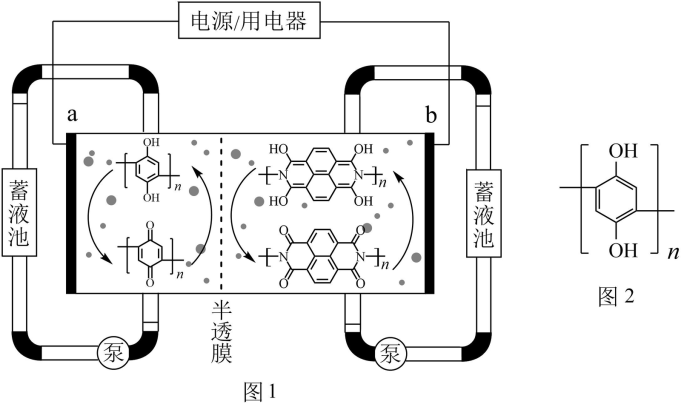
| A.放电时,电子由b电极流向a电极 |
| B.充电时,a电极附近的pH增大 |
| C.电池中间的隔膜为特殊尺寸半透膜,目的是阻止正负极物质的交叉污染 |
D.放电时,b电极的电极反应方程式为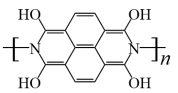 -4ne-= -4ne-=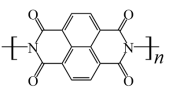 +4nH+ +4nH+ |
您最近一年使用:0次
2021-01-03更新
|
1309次组卷
|
5卷引用:2024届天津市宁河区芦台第一中学高三下学期第三次模拟化学试题
名校
解题方法
8 . 微型纽扣电池在现代生活中有广泛应用,有一种银锌电池,其电极分别是Ag2O和Zn,电解质溶液为KOH溶液,总反应为Ag2O+Zn=ZnO+2Ag,其中一个电极反应为Ag2O+H2O+2e-=2Ag+2OH-。

(1)判断正负极的材料。
负极材料_____________ ,正极材料___________ 。
(2)写出另一电极的电极反应式,并判断反应类型。
电极反应式__________
反应类型___________
(3)判断电池工作时,电子的流动方向和电解质溶液中离子的流动方向。电子由______ 到______ ,溶液中的阳离子流向电池的________ ,阴离子流向________
(4)在电池使用的过程中,电解质溶液中KOH的物质的量怎样变化?________ (增大、减小、不变)
(5)当电池工作时通过电路对外提供了1 mol电子,计算消耗的负极的质量_______ 。
(6)氢氧燃料电池为绿色化学电源,在碱性NaOH溶液为电解质溶液时的负极电极反应式为______ 。

(1)判断正负极的材料。
负极材料
(2)写出另一电极的电极反应式,并判断反应类型。
电极反应式
反应类型
(3)判断电池工作时,电子的流动方向和电解质溶液中离子的流动方向。电子由
(4)在电池使用的过程中,电解质溶液中KOH的物质的量怎样变化?
(5)当电池工作时通过电路对外提供了1 mol电子,计算消耗的负极的质量
(6)氢氧燃料电池为绿色化学电源,在碱性NaOH溶液为电解质溶液时的负极电极反应式为
您最近一年使用:0次
2020-03-21更新
|
463次组卷
|
4卷引用:天津市宁河区芦台二中2019-2020学年高一下学期第一次阶段测试化学试题
天津市宁河区芦台二中2019-2020学年高一下学期第一次阶段测试化学试题(已下线)考点09 电化学原理-2020年【衔接教材·暑假作业】新高三一轮复习化学广西桂林市临桂区五通中学2021-2022学年高一下学期期中考试化学试题新疆和田地区皮山县2022-2023学年高二上学期11月期中考试化学试题
名校
解题方法
9 . 某小组为研究原电池原理,设计如图装置。下列叙述不正确的是( )
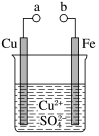

| A.无论a和b是否连接,铁片和铜片之间均可形成原电池 |
| B.a和b不连接时,铁片上会有金属铜析出 |
| C.a和b用导线连接时,铜片上发生的反应为Cu2++2e-= Cu |
| D.无论a和b是否连接,铁片均会溶解,溶液从蓝色逐渐变成浅绿色 |
您最近一年使用:0次
2020-03-21更新
|
346次组卷
|
3卷引用:天津市宁河区芦台二中2019-2020学年高一下学期第一次阶段测试化学试题
10 . CO2是一种廉价的碳资源,其综合利用具有重要意义。回答下列问题:
(1)CO2可以被NaOH溶液捕获。若所得溶液pH=13,CO2主要转化为______ (写离子符号);若所得溶液c(HCO3−)∶c(CO32−)=2∶1,溶液pH=___________ 。(室温下,H2CO3的K1=4×10−7;K2=5×10−11)
(2)CO2与CH4经催化重整,制得合成气:
CH4(g)+ CO2(g)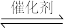 2CO (g)+ 2H2(g)
2CO (g)+ 2H2(g)
①已知上述反应中相关的化学键键能数据如下:
则该反应的ΔH=_________ 。分别在VL恒温密闭容器A(恒容)、B(恒压,容积可变)中,加入CH4和CO2各1 mol的混合气体。两容器中反应达平衡后放出或吸收的热量较多的是_______ (填“A” 或“B ”)。
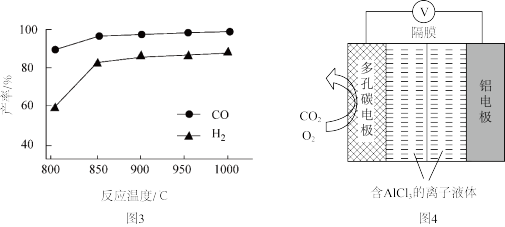
②按一定体积比加入CH4和CO2,在恒压下发生反应,温度对CO和H2产率的影响如图3所示。此反应优选温度为900℃的原因是________ 。
(3)O2辅助的Al~CO2电池工作原理如图4所示。该电池电容量大,能有效利用CO2,电池反应产物Al2(C2O4)3是重要的化工原料。
电池的负极反应式:________ 。
电池的正极反应式:6O2+6e− 6O2−
6O2−
6CO2+6O2− 3C2O42−+6O2
3C2O42−+6O2
反应过程中O2的作用是________ 。
该电池的总反应式:________ 。
(1)CO2可以被NaOH溶液捕获。若所得溶液pH=13,CO2主要转化为
(2)CO2与CH4经催化重整,制得合成气:
CH4(g)+ CO2(g)
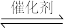 2CO (g)+ 2H2(g)
2CO (g)+ 2H2(g)①已知上述反应中相关的化学键键能数据如下:
| 化学键 | C—H | C=O | H—H | C O(CO) O(CO) |
| 键能/kJ·mol−1 | 413 | 745 | 436 | 1075 |
则该反应的ΔH=
②按一定体积比加入CH4和CO2,在恒压下发生反应,温度对CO和H2产率的影响如图3所示。此反应优选温度为900℃的原因是

(3)O2辅助的Al~CO2电池工作原理如图4所示。该电池电容量大,能有效利用CO2,电池反应产物Al2(C2O4)3是重要的化工原料。
电池的负极反应式:
电池的正极反应式:6O2+6e−
 6O2−
6O2−6CO2+6O2−
 3C2O42−+6O2
3C2O42−+6O2反应过程中O2的作用是
该电池的总反应式:
您最近一年使用:0次
2018-06-09更新
|
5068次组卷
|
11卷引用:天津市宁河区芦台第一中学2022-2023学年高三上学期1月期末考试化学试题
天津市宁河区芦台第一中学2022-2023学年高三上学期1月期末考试化学试题2018年全国普通高等学校招生统一考试化学(天津卷)(已下线)2018年高考题及模拟题汇编 专题14 化学反应原理综合【全国百强校】黑龙江省哈尔滨市第六中学2019届高三上学期12月月考化学试题云南省玉溪元江民中2020届高三开学考试化学试题贵州省惠水县第一高级中学2019-2020学年高三上学期期末考试化学试题(已下线)专题14 化学反应原理综合-备战2021届高考化学二轮复习题型专练四川省蓬安中学校2020届高三上学期入学考试化学试题(已下线)化学(上海A卷)-学易金卷:2023年高考第一次模拟考试卷浙江省杭州第十四中学2023-2024学年高二上学期 期中考试化学试卷10-2023新东方高二上期中考化学



