2024·天津·模拟预测
1 . 黄铁矿[主要成分为二硫化亚铁(FeS2)]、焦炭和适量空气混合加热发生如下反应:
i.3FeS2+2C+3O2=3S2+Fe3O4+2CO
(1)反应i生成1molS2时,转移电子的物质的量为___________ mol。
(2)反应i所得气体经冷凝回收S2后,尾气中还含有CO和SO2。将尾气通过催化剂进行处理,发生反应ii,同时发生副反应iii。
ii.2SO2(g)+4CO(g) S2(g)+4CO2(g) ΔH<0
S2(g)+4CO2(g) ΔH<0
iii.SO2(g)+3CO(g) COS(g)+2CO2(g) ΔH<0
COS(g)+2CO2(g) ΔH<0
理论分析及实验结果表明,600~1000K范围内,SO2平衡转化率接近100%。其他条件相同,不同温度下,S2、COS平衡产率和10min时S2实际产率如图。___________ 。
②随温度升高,S2平衡产率上升,推测其原因是___________ 。
③900K,在10min后继续反应足够长时间,推测S2实际产率的变化趋势可能为___________ 。
(3)处理后的尾气仍含少量SO2,经Na2CO3溶液洗脱处理后,所得洗脱液主要成分为Na2CO3、NaHCO3和Na2SO3.利用生物电池技术,可将洗脱液中的Na2SO3转化为单质硫(以S表示)回收。___________ 。
②一段时间后,若洗脱液中 的物质的量减小了1mol,则理论上
的物质的量减小了1mol,则理论上 减小了
减小了___________ mol。
(4)常温向 溶液中加入适量的NaOH,溶液中
溶液中加入适量的NaOH,溶液中 、
、 、
、 的分布系数
的分布系数 随pOH的变化如图。
随pOH的变化如图。___________ 。
A.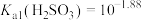
B.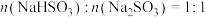 时,溶液显酸性
时,溶液显酸性
C.N点对应的溶液,对水的电离起到抑制作用
i.3FeS2+2C+3O2=3S2+Fe3O4+2CO
(1)反应i生成1molS2时,转移电子的物质的量为
(2)反应i所得气体经冷凝回收S2后,尾气中还含有CO和SO2。将尾气通过催化剂进行处理,发生反应ii,同时发生副反应iii。
ii.2SO2(g)+4CO(g)
 S2(g)+4CO2(g) ΔH<0
S2(g)+4CO2(g) ΔH<0iii.SO2(g)+3CO(g)
 COS(g)+2CO2(g) ΔH<0
COS(g)+2CO2(g) ΔH<0理论分析及实验结果表明,600~1000K范围内,SO2平衡转化率接近100%。其他条件相同,不同温度下,S2、COS平衡产率和10min时S2实际产率如图。

②随温度升高,S2平衡产率上升,推测其原因是
③900K,在10min后继续反应足够长时间,推测S2实际产率的变化趋势可能为
(3)处理后的尾气仍含少量SO2,经Na2CO3溶液洗脱处理后,所得洗脱液主要成分为Na2CO3、NaHCO3和Na2SO3.利用生物电池技术,可将洗脱液中的Na2SO3转化为单质硫(以S表示)回收。

②一段时间后,若洗脱液中
 的物质的量减小了1mol,则理论上
的物质的量减小了1mol,则理论上 减小了
减小了(4)常温向
 溶液中加入适量的NaOH,溶液中
溶液中加入适量的NaOH,溶液中 、
、 、
、 的分布系数
的分布系数 随pOH的变化如图。
随pOH的变化如图。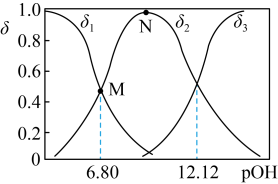
A.
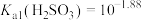
B.
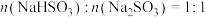 时,溶液显酸性
时,溶液显酸性C.N点对应的溶液,对水的电离起到抑制作用
您最近一年使用:0次
名校
2 . 高电压水系锌——有机混合液流电池的装置及其充放电原理示意图如下。
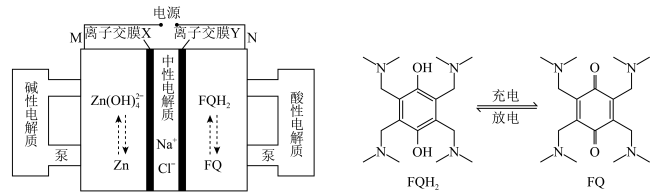
A.放电时,负极反应式: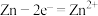 | B.放电时,1 mol FQ反应需转移4 mol  |
C.充电时, 可通过离子交换膜Y 可通过离子交换膜Y | D.充电时,M电极接电源负极 |
您最近一年使用:0次
2024-03-28更新
|
343次组卷
|
3卷引用:天津市河西区2023-2024学年高三下学期一模化学试题
名校
解题方法
3 . 完成下列问题:
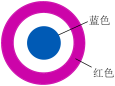
(1)取一块打磨过的生铁片,在其表面滴一滴含酚酞和K3[Fe(CN)6]的食盐水,放置一段时间后,生铁片上出现如图所示“斑痕”,其边缘为红色,中心区域为蓝色,在两色环交界处出现铁锈,生铁片发生___________ 腐蚀,边缘区的电极反应式为___________ 。
(2)区分晶体和非晶体最可靠的方法是___________ 。
(3)以铝材为阳极,在H2SO4溶液中电解,铝材表面形成氧化膜,阳极反应式为___________ 。
(4)以多孔铂为电极,如图装置中A、B口分别通入CH3CH2OH和O2构成乙醇燃料电池,则b电极是___________ (填“正极”或“负极”),该电池的负极的电极反应式为___________

用该燃料电池作为电源进行电解,将两个铂电极插入500 mL CuSO4溶液中进行电解,通电一定时间后,某一电极增重0.064 g(设电解时该电极无氢气析出,且不考虑水解和溶液体积变化),此时溶液中氢离子浓度约为___________ 。
(5)利用人工光合作用可将CO2转化为甲酸,反应原理为2CO2+2H2O=2HCOOH+O2,装置如图所示:
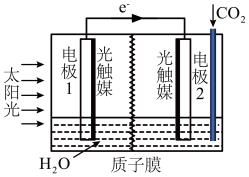
①电极2的电极反应式是___________ 。
②在标准状况下,当产生22.4 L O2时,理论上电极1室液体质量变化___________ g。
(学法题)书写电极反应式时应注意哪些问题___________ 。
(1)取一块打磨过的生铁片,在其表面滴一滴含酚酞和K3[Fe(CN)6]的食盐水,放置一段时间后,生铁片上出现如图所示“斑痕”,其边缘为红色,中心区域为蓝色,在两色环交界处出现铁锈,生铁片发生

(2)区分晶体和非晶体最可靠的方法是
(3)以铝材为阳极,在H2SO4溶液中电解,铝材表面形成氧化膜,阳极反应式为
(4)以多孔铂为电极,如图装置中A、B口分别通入CH3CH2OH和O2构成乙醇燃料电池,则b电极是

用该燃料电池作为电源进行电解,将两个铂电极插入500 mL CuSO4溶液中进行电解,通电一定时间后,某一电极增重0.064 g(设电解时该电极无氢气析出,且不考虑水解和溶液体积变化),此时溶液中氢离子浓度约为
(5)利用人工光合作用可将CO2转化为甲酸,反应原理为2CO2+2H2O=2HCOOH+O2,装置如图所示:

①电极2的电极反应式是
②在标准状况下,当产生22.4 L O2时,理论上电极1室液体质量变化
(学法题)书写电极反应式时应注意哪些问题
您最近一年使用:0次
名校
4 . 我国将在2023年前实现碳达峰、2060年前实现碳中和。“碳中和”是指 CO2的排放总量和减少总量相当。CO2的资源化利用能有效减少CO2排放。
Ⅰ.研究表明CO2与CH4在催化剂存在下可发生反应制得合成气:CO2(g)+ CH4(g) 2CO(g)+2H2 (g)
2CO(g)+2H2 (g)  >0
>0
(1)此反应的活化能Ea(正)___________ Ea(逆)(填“>”、“=”或“<”)。
(2)某温度下,向一恒容密闭容器中充入CO2和CH4发生上述反应,初始时CO2和CH4的分压分别为15kPa、20kPa,一段时间达到平衡后,测得体系压强增加了10kPa,则该反应的平衡常数Kp=___________ (kPa)2(结果保留两位有效数字,用平衡分压代替平衡浓度计算,分压=总压 物质的量分数)。
物质的量分数)。
Ⅱ.CO2催化加氢合成二甲醚是一种CO2转化方法,其过程中主要发生下列反应:
反应①:CO2(g)+H2(g)CO(g)+H2O(g) = +41.2kJ·mol-1
= +41.2kJ·mol-1
反应②:2CO2(g)+6H2(g)CH3OCH3(g)+3H2O(g)
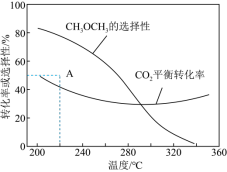
在恒压,CO2和H2的起始量一定的条件下,CO2平衡转化率和平衡时CH3OCH3的选择性随温度的变化如图。其中:CH3OCH3的选择性= 。
。 CH3OCH3(g)+H2O(g)
CH3OCH3(g)+H2O(g)  =-204.9kJ·mol-1则反应②的
=-204.9kJ·mol-1则反应②的 =
= ___________  。
。
(4)温度高于300℃,CO2平衡转化率随温度升高而上升的原因是___________ 。
(5)220℃时,在催化剂作用下CO2与H2反应一段时间 后,测得CH3OCH3的选择性对应图中A点数据。下列说法正确的是___________。
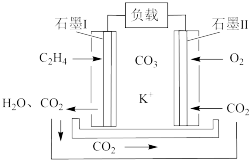
(6)某乙烯熔融碳酸盐燃料电池工作原理如图所示,则负极上电极反应式为___________ 。若要维持电池持续稳定工作,则从理论上讲,进入石墨Ⅱ电极上的CO2与石墨Ⅰ电极上生成的CO2的物质的量之比是___________ 。
Ⅰ.研究表明CO2与CH4在催化剂存在下可发生反应制得合成气:CO2(g)+ CH4(g)
 2CO(g)+2H2 (g)
2CO(g)+2H2 (g)  >0
>0(1)此反应的活化能Ea(正)
(2)某温度下,向一恒容密闭容器中充入CO2和CH4发生上述反应,初始时CO2和CH4的分压分别为15kPa、20kPa,一段时间达到平衡后,测得体系压强增加了10kPa,则该反应的平衡常数Kp=
 物质的量分数)。
物质的量分数)。Ⅱ.CO2催化加氢合成二甲醚是一种CO2转化方法,其过程中主要发生下列反应:
反应①:CO2(g)+H2(g)CO(g)+H2O(g)
 = +41.2kJ·mol-1
= +41.2kJ·mol-1反应②:2CO2(g)+6H2(g)CH3OCH3(g)+3H2O(g)
在恒压,CO2和H2的起始量一定的条件下,CO2平衡转化率和平衡时CH3OCH3的选择性随温度的变化如图。其中:CH3OCH3的选择性=
 。
。
 CH3OCH3(g)+H2O(g)
CH3OCH3(g)+H2O(g)  =-204.9kJ·mol-1则反应②的
=-204.9kJ·mol-1则反应②的 =
=  。
。(4)温度高于300℃,CO2平衡转化率随温度升高而上升的原因是
(5)220℃时,在催化剂作用下CO2与H2反应
| A.其他反应条件不变,增大压强一定可提高平衡时CH3OCH3的选择性 |
| B.其他反应条件不变,改变催化剂,CH3OCH3的选择性不会改变 |
| C.其他反应条件不变,升高温度,CO2的转化率一定随着温度的升高而降低 |
| D.其他反应条件不变,提高投料时的氢碳比[n(H2):nCO2)],能提高CO2平衡转化率 |
(6)某乙烯熔融碳酸盐燃料电池工作原理如图所示,则负极上电极反应式为
您最近一年使用:0次
2024-01-16更新
|
133次组卷
|
2卷引用:天津市耀华中学2024届高三下学期第一次模拟考试化学试卷
名校
5 . 1841年美国学者Fremy首次合成了 ,它是一种“环境友好型氧化剂”。某小组拟制备
,它是一种“环境友好型氧化剂”。某小组拟制备 ,并探究其性质。已知20℃时KCl的溶解度为37.4g,
,并探究其性质。已知20℃时KCl的溶解度为37.4g, 的溶解度为11.1g。
的溶解度为11.1g。
实验(一)制备 ,装置如图所示:
,装置如图所示:___________ 。
(2)甲装置中副产物为氯化钾,写出生成 的离子方程式:
的离子方程式:___________ ,实验完毕后,对甲装置中混合液进行___________ 过滤、洗涤、低温干燥。
实验(二)探究 性质及应用。
性质及应用。
取10g草酸溶于40mL水中,加入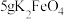 粉末,充分混合,观察到有大量气泡产生,并产生黑色固体。将所得气体通入足量澄清石灰水中,溶液变浑浊。根据上述实验现象,可以判断产生的气体中含有
粉末,充分混合,观察到有大量气泡产生,并产生黑色固体。将所得气体通入足量澄清石灰水中,溶液变浑浊。根据上述实验现象,可以判断产生的气体中含有 ,经测定所得气体中还含有
,经测定所得气体中还含有 。
。
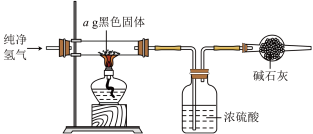
(3)实验完毕后,将混合物经过滤、洗涤、干燥得到黑色固体,利用如图实验装置探究黑色固体的成分,当黑色固体完全反应后,测得浓硫酸质量净增bg,当 等于
等于___________ (用最简分数比表示)时,黑色固体为 。
。 稳定性(用
稳定性(用 浓度表示)与pH关系如图,其消毒效率与温度关系如图所示:
浓度表示)与pH关系如图,其消毒效率与温度关系如图所示:___________ 。
②在相同条件下, 作消毒剂最佳温度是
作消毒剂最佳温度是___________ 。
(5)查阅资料可知, 溶液呈紫红色,为探究
溶液呈紫红色,为探究 和
和 的电位相对大小,设计如下方案。(已知:电位一般指“电势”,用“
的电位相对大小,设计如下方案。(已知:电位一般指“电势”,用“ ”表示。氧化剂的电位是衡量其氧化性强度主要参数,电位越高,对应2条件下氧化剂的氧化性越强。)
”表示。氧化剂的电位是衡量其氧化性强度主要参数,电位越高,对应2条件下氧化剂的氧化性越强。)
方案1:在 溶液中加过量的
溶液中加过量的 粉末,溶液呈紫红色。
粉末,溶液呈紫红色。
方案2:如图所示,关闭K时,观察到电流计指针偏转,铂极产生红褐色物质,石墨极附近无色溶液变紫红色。___________ (填“1”或“2”)能证明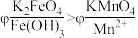 ,石墨极的电极反应式为
,石墨极的电极反应式为___________ 。
 ,它是一种“环境友好型氧化剂”。某小组拟制备
,它是一种“环境友好型氧化剂”。某小组拟制备 ,并探究其性质。已知20℃时KCl的溶解度为37.4g,
,并探究其性质。已知20℃时KCl的溶解度为37.4g, 的溶解度为11.1g。
的溶解度为11.1g。实验(一)制备
 ,装置如图所示:
,装置如图所示: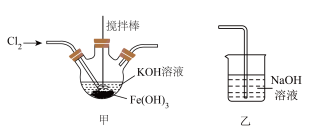
(2)甲装置中副产物为氯化钾,写出生成
 的离子方程式:
的离子方程式:实验(二)探究
 性质及应用。
性质及应用。取10g草酸溶于40mL水中,加入
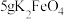 粉末,充分混合,观察到有大量气泡产生,并产生黑色固体。将所得气体通入足量澄清石灰水中,溶液变浑浊。根据上述实验现象,可以判断产生的气体中含有
粉末,充分混合,观察到有大量气泡产生,并产生黑色固体。将所得气体通入足量澄清石灰水中,溶液变浑浊。根据上述实验现象,可以判断产生的气体中含有 ,经测定所得气体中还含有
,经测定所得气体中还含有 。
。(3)实验完毕后,将混合物经过滤、洗涤、干燥得到黑色固体,利用如图实验装置探究黑色固体的成分,当黑色固体完全反应后,测得浓硫酸质量净增bg,当
 等于
等于 。
。
 稳定性(用
稳定性(用 浓度表示)与pH关系如图,其消毒效率与温度关系如图所示:
浓度表示)与pH关系如图,其消毒效率与温度关系如图所示: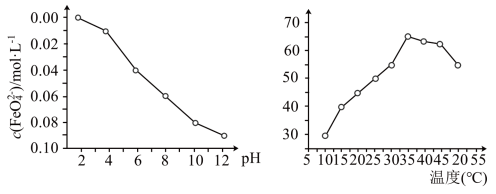
②在相同条件下,
 作消毒剂最佳温度是
作消毒剂最佳温度是(5)查阅资料可知,
 溶液呈紫红色,为探究
溶液呈紫红色,为探究 和
和 的电位相对大小,设计如下方案。(已知:电位一般指“电势”,用“
的电位相对大小,设计如下方案。(已知:电位一般指“电势”,用“ ”表示。氧化剂的电位是衡量其氧化性强度主要参数,电位越高,对应2条件下氧化剂的氧化性越强。)
”表示。氧化剂的电位是衡量其氧化性强度主要参数,电位越高,对应2条件下氧化剂的氧化性越强。)方案1:在
 溶液中加过量的
溶液中加过量的 粉末,溶液呈紫红色。
粉末,溶液呈紫红色。方案2:如图所示,关闭K时,观察到电流计指针偏转,铂极产生红褐色物质,石墨极附近无色溶液变紫红色。
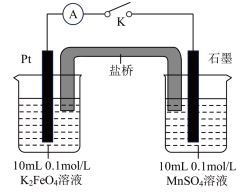
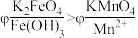 ,石墨极的电极反应式为
,石墨极的电极反应式为
您最近一年使用:0次
6 . Ⅰ.对温室气体二氧化碳的处理是化学工作者实现“碳中和”重点研究的课题。一种新的循环利用方案是用Bosch反应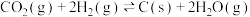

(1)①已知: 和
和 的生成焓为
的生成焓为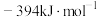 和
和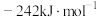 。则
。则
___________  。(生成焓是一定条件下,由其对应最稳定单质生成1mol化合物时的反应热)
。(生成焓是一定条件下,由其对应最稳定单质生成1mol化合物时的反应热)
②若要此反应自发进行,___________ (填“高温”或“低温”)更有利。
③Bosch反应必须在高温下才能启动,原因是___________ 。
(2)350℃时,向体积为2L的恒容密闭容器中通入8mol 和4mol
和4mol 发生Bosch反应,若反应起始和平衡时温度相同(均为350℃),测得反应过程中压强随时间的变化如表所示(其中P为大气压):
发生Bosch反应,若反应起始和平衡时温度相同(均为350℃),测得反应过程中压强随时间的变化如表所示(其中P为大气压):
①350℃时Bosch反应的
___________ 。(用含P的表达式表示)( 为用气体的分压表示的平衡常数,分压=气体的体积分数×体系总压)
为用气体的分压表示的平衡常数,分压=气体的体积分数×体系总压)
②已知Bosch反应的速率方程: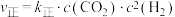 ,
,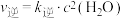 。30min时,
。30min时,
___________ 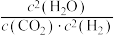 (填“>”、“<”或“=”,下同);升高温度,
(填“>”、“<”或“=”,下同);升高温度, 增大倍数
增大倍数___________  增大倍数。
增大倍数。
Ⅱ. 和
和 是两种重要的温室气体,通过
是两种重要的温室气体,通过 和
和 反应制造更高价值化学品是目前的研究目标。
反应制造更高价值化学品是目前的研究目标。 和
和 在催化剂表面发生反应:。
在催化剂表面发生反应:。
(3)T℃时,向1L密闭容器中投入1mol 和1mol
和1mol ,5小时后测得反应体系达到平衡状态,此时
,5小时后测得反应体系达到平衡状态,此时 ,计算该温度下
,计算该温度下 平衡常数
平衡常数
___________ ,该温度下达到平衡时 的平均生成速率为
的平均生成速率为___________  。平衡时
。平衡时 的转化率为
的转化率为___________ 。
(4)T℃时,若再向容器中同时充入2.0mol 、6.0mol
、6.0mol 、4.0mol CO和8.0mol
、4.0mol CO和8.0mol ,则上述平衡向
,则上述平衡向___________ (填“正反应”或“逆反应”)方向移动。
(5)在不同温度下催化剂的催化效率与CO的生成速率如图所示。___________ (△代表CO的生成速率,■代表催化剂的催化效率)
(6)为了提高该反应中 的平衡转化率,可以采取的措施是(写一点即可)
的平衡转化率,可以采取的措施是(写一点即可)___________ 。
(7)以 为原料可以合成多种物质。以KOH水溶液作电解质进行电解,
为原料可以合成多种物质。以KOH水溶液作电解质进行电解, 在铜电极上可转化为甲烷,该电极的电极反应式为
在铜电极上可转化为甲烷,该电极的电极反应式为___________ 。
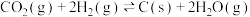

(1)①已知:
 和
和 的生成焓为
的生成焓为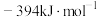 和
和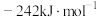 。则
。则
 。(生成焓是一定条件下,由其对应最稳定单质生成1mol化合物时的反应热)
。(生成焓是一定条件下,由其对应最稳定单质生成1mol化合物时的反应热)②若要此反应自发进行,
③Bosch反应必须在高温下才能启动,原因是
(2)350℃时,向体积为2L的恒容密闭容器中通入8mol
 和4mol
和4mol 发生Bosch反应,若反应起始和平衡时温度相同(均为350℃),测得反应过程中压强随时间的变化如表所示(其中P为大气压):
发生Bosch反应,若反应起始和平衡时温度相同(均为350℃),测得反应过程中压强随时间的变化如表所示(其中P为大气压):| 时间/min | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
| 压强 | 6.00P | 5.60P | 5.30P | 5.15P | 5.06P | 5.00P | 5.00P |

 为用气体的分压表示的平衡常数,分压=气体的体积分数×体系总压)
为用气体的分压表示的平衡常数,分压=气体的体积分数×体系总压)②已知Bosch反应的速率方程:
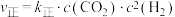 ,
,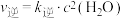 。30min时,
。30min时,
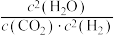 (填“>”、“<”或“=”,下同);升高温度,
(填“>”、“<”或“=”,下同);升高温度, 增大倍数
增大倍数 增大倍数。
增大倍数。Ⅱ.
 和
和 是两种重要的温室气体,通过
是两种重要的温室气体,通过 和
和 反应制造更高价值化学品是目前的研究目标。
反应制造更高价值化学品是目前的研究目标。 和
和 在催化剂表面发生反应:。
在催化剂表面发生反应:。(3)T℃时,向1L密闭容器中投入1mol
 和1mol
和1mol ,5小时后测得反应体系达到平衡状态,此时
,5小时后测得反应体系达到平衡状态,此时 ,计算该温度下
,计算该温度下 平衡常数
平衡常数
 的平均生成速率为
的平均生成速率为 。平衡时
。平衡时 的转化率为
的转化率为(4)T℃时,若再向容器中同时充入2.0mol
 、6.0mol
、6.0mol 、4.0mol CO和8.0mol
、4.0mol CO和8.0mol ,则上述平衡向
,则上述平衡向(5)在不同温度下催化剂的催化效率与CO的生成速率如图所示。
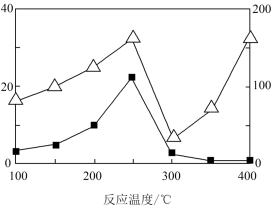
(6)为了提高该反应中
 的平衡转化率,可以采取的措施是(写一点即可)
的平衡转化率,可以采取的措施是(写一点即可)(7)以
 为原料可以合成多种物质。以KOH水溶液作电解质进行电解,
为原料可以合成多种物质。以KOH水溶液作电解质进行电解, 在铜电极上可转化为甲烷,该电极的电极反应式为
在铜电极上可转化为甲烷,该电极的电极反应式为
您最近一年使用:0次
2023-11-15更新
|
215次组卷
|
2卷引用:天津市耀华中学2024届高三下学期第五次统练化学试卷
7 . 某低成本储能电池原理如下图所示。下列说法正确的是


| A.放电时负极质量减小 |
| B.储能过程中电能转变为化学能 |
C.放电时右侧 通过质子交换膜移向左侧 通过质子交换膜移向左侧 |
D.充电总反应: |
您最近一年使用:0次
2023-06-13更新
|
12443次组卷
|
23卷引用:天津市第四中学2023-2024学年高三上学期第二次月考化学试卷
天津市第四中学2023-2024学年高三上学期第二次月考化学试卷2023年高考辽宁卷化学真题(已下线)T11-电化学基础(已下线)2023年高考化学真题完全解读(辽宁卷)(已下线)专题12 电化学的综合应用(已下线)专题12 电化学的综合应用(已下线)专题12 电化学的综合应用(已下线)专题07 电化学及其应用-2023年高考化学真题题源解密(新高考专用)(已下线)专题10 电化学及其应用-2023年高考化学真题题源解密(全国通用)(已下线)考点18 原电池 化学电源(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)第24讲原电池与化学电源河南省南阳市第一中学校2023-2024学年高三上学期第一次月考化学试题河南省南阳市南阳一中2023-2024学年高三上学期9月月考化学试题四川省成都市树德中学2023-2024学年高三上学期10月阶段性测试理科综合化学试题(已下线)电化学原理及应用(已下线)电解池 金属的腐蚀与防护辽宁省大连市第十二中学2023-2024学年高二上学期12月学情反馈化学试题(已下线)题型11 新型电化学装置分析-2024年高考化学二轮热点题型归纳与变式演练(新高考通用)四川省宜宾市第四中学校2023-2024学年高二上学期1月期末考试化学试题山东省菏泽市单县二中2022-2023学年高一下学期6月段考化学试题宁夏石嘴山市光明中学2024届高三第一次模拟考试理综化学试题(已下线)FHgkyldyjhx12(已下线)测试辽宁化学 请勿下载
解题方法
8 . “低碳经济”备受关注, 的产生及有效开发利用成为科学家研究的重要课题。回答下列问题:
的产生及有效开发利用成为科学家研究的重要课题。回答下列问题:
(1)已知某反应的平衡常数表达式为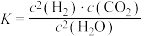 ,所对应的化学反应方程式为
,所对应的化学反应方程式为___________ 。
(2)科学家提出由 制取C的太阳能工艺如图所示。
制取C的太阳能工艺如图所示。

①工艺过程中的能量转化形式为___________ 。
②已知“重整系统”发生的反应中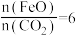 ,则
,则 的化学式为
的化学式为___________ ,“热分解系统”中每转移2mol电子,需消耗
___________ mol。
(3)业上用 和
和 反应合成二甲醚。已知:
反应合成二甲醚。已知:



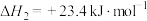
①反应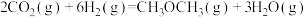

___________
②在某压强下,合成二甲醚的反应在不同温度、不同投料比时, 的转化率如图所示。
的转化率如图所示。 温度下,将4mol
温度下,将4mol  和8mol
和8mol  充入2L的密闭容器中,10min后反应达到平衡状态,则平衡时
充入2L的密闭容器中,10min后反应达到平衡状态,则平衡时
___________ ; 、
、 、
、 三者之间的大小关系为
三者之间的大小关系为___________ 。

③利用二甲醚设计一个燃料电池,用KOH溶液作电解质溶液,多孔石墨作电极,该电池的负极反应式为___________ 。
 的产生及有效开发利用成为科学家研究的重要课题。回答下列问题:
的产生及有效开发利用成为科学家研究的重要课题。回答下列问题:(1)已知某反应的平衡常数表达式为
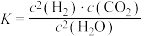 ,所对应的化学反应方程式为
,所对应的化学反应方程式为(2)科学家提出由
 制取C的太阳能工艺如图所示。
制取C的太阳能工艺如图所示。
①工艺过程中的能量转化形式为
②已知“重整系统”发生的反应中
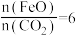 ,则
,则 的化学式为
的化学式为
(3)业上用
 和
和 反应合成二甲醚。已知:
反应合成二甲醚。已知:


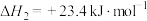
①反应
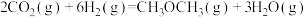

②在某压强下,合成二甲醚的反应在不同温度、不同投料比时,
 的转化率如图所示。
的转化率如图所示。 温度下,将4mol
温度下,将4mol  和8mol
和8mol  充入2L的密闭容器中,10min后反应达到平衡状态,则平衡时
充入2L的密闭容器中,10min后反应达到平衡状态,则平衡时
 、
、 、
、 三者之间的大小关系为
三者之间的大小关系为
③利用二甲醚设计一个燃料电池,用KOH溶液作电解质溶液,多孔石墨作电极,该电池的负极反应式为
您最近一年使用:0次
名校
解题方法
9 .  的回收与利用是科学家研究的热点课题。可利用
的回收与利用是科学家研究的热点课题。可利用 与
与 制备合成气(CO、
制备合成气(CO、 ),还可制备甲醇、二甲醚、低碳烯烃等燃料产品。
),还可制备甲醇、二甲醚、低碳烯烃等燃料产品。
Ⅰ.科学家提出制备“合成气”反应历程分两步:
反应①: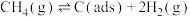 (慢反应)
(慢反应)
反应②: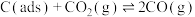 (快反应)
(快反应)
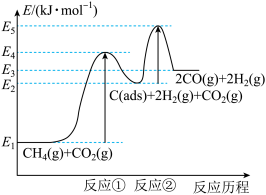
上述反应中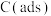 为吸附性活性炭,反应历程的能量变化如图:
为吸附性活性炭,反应历程的能量变化如图:
(1) 与
与 制备合成气的热化学方程式为
制备合成气的热化学方程式为_______ ;该反应在高温下可自发正向进行的原因是_______ ,能量变化图中:
_______  (填“>”“<”或“=”),
(填“>”“<”或“=”),
Ⅱ.利用“合成气”合成甲醇后,脱水制得二甲醚。
反应为:

经查阅资料,在一定范围内,上述反应化学平衡常数与热力学温度存在关系: (自然对数)
(自然对数)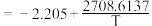 。其速率方程为:
。其速率方程为: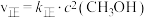 ,
,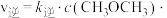
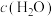 ,、为速率常数,且影响外因只有温度。
,、为速率常数,且影响外因只有温度。
(2)反应达到平衡后,仅升高温度, 增大的倍数
增大的倍数_______  增大的倍数(填“>”“<”或“=”)。
增大的倍数(填“>”“<”或“=”)。
(3)某温度下, ,在密闭容器中加入一定量
,在密闭容器中加入一定量 。反应到某时刻测得各组分的物质的量如下:
。反应到某时刻测得各组分的物质的量如下:
此时正、逆反应速率的大小:
_______  (填“>”“<”或“=”)。
(填“>”“<”或“=”)。
Ⅲ.合成低碳烯烃
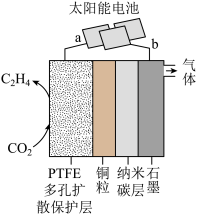
(4)强碱性电催化还原 制备乙烯的研究取得突破性进展,原理如图所示。b极接的是太阳能电池的
制备乙烯的研究取得突破性进展,原理如图所示。b极接的是太阳能电池的_______ 极(已知PTFE浸泡了饱和KCl溶液)。请写出阴极的电极反应式_______ 。
 的回收与利用是科学家研究的热点课题。可利用
的回收与利用是科学家研究的热点课题。可利用 与
与 制备合成气(CO、
制备合成气(CO、 ),还可制备甲醇、二甲醚、低碳烯烃等燃料产品。
),还可制备甲醇、二甲醚、低碳烯烃等燃料产品。Ⅰ.科学家提出制备“合成气”反应历程分两步:
反应①:
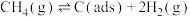 (慢反应)
(慢反应)反应②:
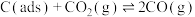 (快反应)
(快反应)上述反应中
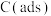 为吸附性活性炭,反应历程的能量变化如图:
为吸附性活性炭,反应历程的能量变化如图:
(1)
 与
与 制备合成气的热化学方程式为
制备合成气的热化学方程式为
 (填“>”“<”或“=”),
(填“>”“<”或“=”),Ⅱ.利用“合成气”合成甲醇后,脱水制得二甲醚。
反应为:


经查阅资料,在一定范围内,上述反应化学平衡常数与热力学温度存在关系:
 (自然对数)
(自然对数)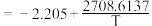 。其速率方程为:
。其速率方程为: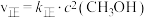 ,
,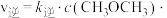
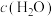 ,、为速率常数,且影响外因只有温度。
,、为速率常数,且影响外因只有温度。(2)反应达到平衡后,仅升高温度,
 增大的倍数
增大的倍数 增大的倍数(填“>”“<”或“=”)。
增大的倍数(填“>”“<”或“=”)。(3)某温度下,
 ,在密闭容器中加入一定量
,在密闭容器中加入一定量 。反应到某时刻测得各组分的物质的量如下:
。反应到某时刻测得各组分的物质的量如下:| 物质 |  |  |  |
| 物质的量/mol | 0.4 | 0.4 | 0.4 |
此时正、逆反应速率的大小:

 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。Ⅲ.合成低碳烯烃
(4)强碱性电催化还原
 制备乙烯的研究取得突破性进展,原理如图所示。b极接的是太阳能电池的
制备乙烯的研究取得突破性进展,原理如图所示。b极接的是太阳能电池的
您最近一年使用:0次
解题方法
10 . 氮氧化物的排放对环境造成很大的污染,研究氮氧化物的转化机理对我们制定保护环境的策略有着重大意义。某科研团队在进行低温下消除氮氧化物的机理研究时,发现NO在转化过程中存在以下核心历程:
① 快反应
快反应
② 慢反应
慢反应
③ 慢反应
慢反应
进一步研究发现,在温度低于300℃,氮氧化物的含量介于某一浓度区间时,对于基元反应②、③而言,反应速率 ,模型如图所示:
,模型如图所示:

(1)当反应温度为2.4K时,反应最终产物中 ,若使最终反应产物中
,若使最终反应产物中 ,则温度T应该
,则温度T应该_______ (填“大于”或“小于”)-270.6℃。
(2)工业上对于电厂烟气中的氨氧化物进行脱硝处理时,通常采用以下反应原理: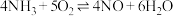 ;
; ,当温度为373℃,压强为情况下,在1L密闭的容器中,通入1mol
,当温度为373℃,压强为情况下,在1L密闭的容器中,通入1mol 、1molNO、0.625mol
、1molNO、0.625mol 达到平衡后测定NO转化率为75%,体系中
达到平衡后测定NO转化率为75%,体系中 ,此时容器中压强
,此时容器中压强
_______  ,此时
,此时 转化率为
转化率为_______ 。
(3)101kPa条件下,不同温度,在密闭容器中发生反应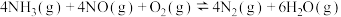
 随着投料比不同,NO转化率变化图象如图所示,NO转化率降低的原因可能是
随着投料比不同,NO转化率变化图象如图所示,NO转化率降低的原因可能是_______ 。

(4)科学家想利用甲烷和氨氧化物设计一款电池,既能提高能源利用率,又能摆脱氮氧化物的污染,反应原理: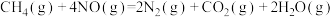
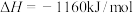 ,酸性介质下,该电池正极的电极反应式为
,酸性介质下,该电池正极的电极反应式为_______ 。
①
 快反应
快反应②
 慢反应
慢反应③
 慢反应
慢反应进一步研究发现,在温度低于300℃,氮氧化物的含量介于某一浓度区间时,对于基元反应②、③而言,反应速率
 ,模型如图所示:
,模型如图所示:
(1)当反应温度为2.4K时,反应最终产物中
 ,若使最终反应产物中
,若使最终反应产物中 ,则温度T应该
,则温度T应该(2)工业上对于电厂烟气中的氨氧化物进行脱硝处理时,通常采用以下反应原理:
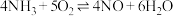 ;
; ,当温度为373℃,压强为情况下,在1L密闭的容器中,通入1mol
,当温度为373℃,压强为情况下,在1L密闭的容器中,通入1mol 、1molNO、0.625mol
、1molNO、0.625mol 达到平衡后测定NO转化率为75%,体系中
达到平衡后测定NO转化率为75%,体系中 ,此时容器中压强
,此时容器中压强
 ,此时
,此时 转化率为
转化率为(3)101kPa条件下,不同温度,在密闭容器中发生反应
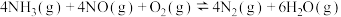
 随着投料比不同,NO转化率变化图象如图所示,NO转化率降低的原因可能是
随着投料比不同,NO转化率变化图象如图所示,NO转化率降低的原因可能是
(4)科学家想利用甲烷和氨氧化物设计一款电池,既能提高能源利用率,又能摆脱氮氧化物的污染,反应原理:
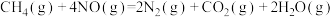
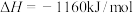 ,酸性介质下,该电池正极的电极反应式为
,酸性介质下,该电池正极的电极反应式为
您最近一年使用:0次



