1 . 高铁酸钾(K2FeO4)是高效消毒剂,也是制作大功率电池的重要材料。某实验小组欲制备K2FeO4并探究其性质。
【查阅资料】K2FeO4为紫色固体,易溶于水,微溶于KOH溶液,不溶于乙醇;具有强氧化性, 在0℃~5℃的强碱性溶液中较稳定,在酸性或中性溶液中快速产生O2。
Ⅰ.制备K2FeO4夹持装置略)
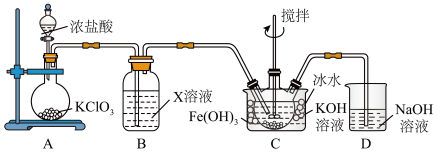
(1)A中发生反应的化学方程式是___________ 。
(2)下列试剂中,装置B的X溶液可以选用的是___________ 。
A.饱和食盐水 B.浓盐酸 C.饱和氯水 D.NaHCO3溶液
(3)C中得到紫色固体和溶液,生成K2FeO4的化学方程式是___________ ;若要从反应后的装置C中尽可能得到更多的K2FeO4固体,可以采取的一种措施是___________ 。
Ⅱ.探究K2FeO4的性质
(4)取C中紫色溶液,加入稀硫酸,产生黄绿色气体,得到溶液a。经检验气体中含有Cl2,为 证明是K2FeO4氧化了Cl-,而不是ClO-氧化了Cl-,设计以下方案:
①由方案Ⅰ中溶液变红可知a中含有离子是___________ ,但该离子的来源不能判断一定是K2FeO4与Cl-反应的产物,还可能是反应___________ (用离子方程式表示)的产物。
②方案Ⅱ可证明K2FeO4氧化了Cl-。用KOH溶液洗涤的目的,一是使减少K2FeO4溶解损失,二是___________ 。
(5)小组同学利用制备的K2FeO4制成如图简易电池,发现放电后两极都产生红褐色悬浮物,则该电池的总反应为___________ ;该电池放电时,正极电极反应式为___________ 。
【查阅资料】K2FeO4为紫色固体,易溶于水,微溶于KOH溶液,不溶于乙醇;具有强氧化性, 在0℃~5℃的强碱性溶液中较稳定,在酸性或中性溶液中快速产生O2。
Ⅰ.制备K2FeO4夹持装置略)

(1)A中发生反应的化学方程式是
(2)下列试剂中,装置B的X溶液可以选用的是
A.饱和食盐水 B.浓盐酸 C.饱和氯水 D.NaHCO3溶液
(3)C中得到紫色固体和溶液,生成K2FeO4的化学方程式是
Ⅱ.探究K2FeO4的性质
(4)取C中紫色溶液,加入稀硫酸,产生黄绿色气体,得到溶液a。经检验气体中含有Cl2,为 证明是K2FeO4氧化了Cl-,而不是ClO-氧化了Cl-,设计以下方案:
| 方案I | 取少量a,滴加KSCN溶液至过量,溶液呈红色 |
| 方案II | 用KOH溶液洗净C中所得固体,再用一定浓度的KOH溶液将K2FeO,溶出,得到紫色溶液b,取少量b,滴加盐酸.有Cl2产生。 |
②方案Ⅱ可证明K2FeO4氧化了Cl-。用KOH溶液洗涤的目的,一是使减少K2FeO4溶解损失,二是
(5)小组同学利用制备的K2FeO4制成如图简易电池,发现放电后两极都产生红褐色悬浮物,则该电池的总反应为

您最近一年使用:0次
2021-04-17更新
|
907次组卷
|
4卷引用:第09讲 铁及其重要化合物(精练)-2022年高考化学一轮复习讲练测
(已下线)第09讲 铁及其重要化合物(精练)-2022年高考化学一轮复习讲练测(已下线)微专题14 氢氧化亚铁、高铁酸盐的制备实验探究-备战2023年高考化学一轮复习考点微专题四川省攀枝花市2021届高三第一次统一考试理科综合化学试题2021年北京高考化学试题变式题11-19
名校
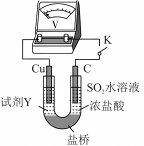
2 . 某小组探究 在盐酸中分别与铜单质和铜离子的反应,从改变氧化产物、还原产物浓度的角度分析物质氧化性和还原性的变化规律。
在盐酸中分别与铜单质和铜离子的反应,从改变氧化产物、还原产物浓度的角度分析物质氧化性和还原性的变化规律。
I.探究 在盐酸中与
在盐酸中与 的反应
的反应
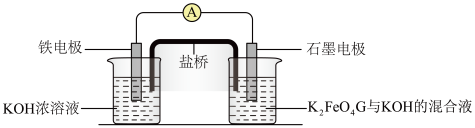
用如下装置(夹持、加热仪器略)制备 ,将
,将 通入
通入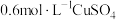 溶液。通
溶液。通 一段时间,C中无明显现象;打开活塞b,加入一定体积浓盐酸后,持续通入
一段时间,C中无明显现象;打开活塞b,加入一定体积浓盐酸后,持续通入 ,C中溶液变棕黄色。
,C中溶液变棕黄色。___________ ,为除去 中含有的少量硫酸酸雾,并观察气流速率,B中盛放试剂X是
中含有的少量硫酸酸雾,并观察气流速率,B中盛放试剂X是___________ 。装置C中盛放浓盐酸的仪器名称为___________ 。
(2)资料:CuCl难溶于水,在浓盐酸溶液中存在平衡:CuCl(白色)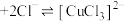 。补充实验证实棕黄色溶液中含
。补充实验证实棕黄色溶液中含 ,实验方案为
,实验方案为___________ 。
(3)一个氧化还原反应包括氧化反应和还原反应两个过程(即两个半反应), 与
与 溶液反应生成
溶液反应生成 和
和 的过程可分为下面两个半反应:
的过程可分为下面两个半反应:
氧化反应:___________ ;还原反应: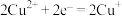 。
。
根据还原反应式,分析加入浓盐酸前后实验现象有差异的可能原因___________ 。
(4)综上分析, 在盐酸中与
在盐酸中与 反应生成
反应生成 的离子方程式为
的离子方程式为___________ 。
实验结论:综合上述实验可知,还原反应中,降低生成物浓度,氧化剂的氧化性增强。
II.探究 在盐酸中与Cu单质的反应
在盐酸中与Cu单质的反应
将装置C中 溶液替换成Cu片和
溶液替换成Cu片和 溶液,重复上述操作。未加浓盐酸之前,无明显现象。加浓盐酸之后,溶液变为棕黄色,并有黑色固体生成。
溶液,重复上述操作。未加浓盐酸之前,无明显现象。加浓盐酸之后,溶液变为棕黄色,并有黑色固体生成。
(5)经检验黑色固体是 ,
, 在盐酸中与Cu单质反应的离子方程式为
在盐酸中与Cu单质反应的离子方程式为___________ 。
(6)为了进一步探究影响铜单质还原性的因素,进行了如下实验:
实验ii中,Cu片附近溶液变棕黄色。a是___________ ,b是___________ 。
综合上述实验可知:氧化反应中,降低生成物浓度,还原剂的还原性增强。
 在盐酸中分别与铜单质和铜离子的反应,从改变氧化产物、还原产物浓度的角度分析物质氧化性和还原性的变化规律。
在盐酸中分别与铜单质和铜离子的反应,从改变氧化产物、还原产物浓度的角度分析物质氧化性和还原性的变化规律。I.探究
 在盐酸中与
在盐酸中与 的反应
的反应用如下装置(夹持、加热仪器略)制备
 ,将
,将 通入
通入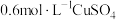 溶液。通
溶液。通 一段时间,C中无明显现象;打开活塞b,加入一定体积浓盐酸后,持续通入
一段时间,C中无明显现象;打开活塞b,加入一定体积浓盐酸后,持续通入 ,C中溶液变棕黄色。
,C中溶液变棕黄色。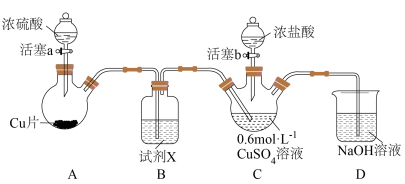
 中含有的少量硫酸酸雾,并观察气流速率,B中盛放试剂X是
中含有的少量硫酸酸雾,并观察气流速率,B中盛放试剂X是(2)资料:CuCl难溶于水,在浓盐酸溶液中存在平衡:CuCl(白色)
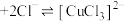 。补充实验证实棕黄色溶液中含
。补充实验证实棕黄色溶液中含 ,实验方案为
,实验方案为(3)一个氧化还原反应包括氧化反应和还原反应两个过程(即两个半反应),
 与
与 溶液反应生成
溶液反应生成 和
和 的过程可分为下面两个半反应:
的过程可分为下面两个半反应:氧化反应:
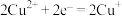 。
。根据还原反应式,分析加入浓盐酸前后实验现象有差异的可能原因
(4)综上分析,
 在盐酸中与
在盐酸中与 反应生成
反应生成 的离子方程式为
的离子方程式为实验结论:综合上述实验可知,还原反应中,降低生成物浓度,氧化剂的氧化性增强。
II.探究
 在盐酸中与Cu单质的反应
在盐酸中与Cu单质的反应将装置C中
 溶液替换成Cu片和
溶液替换成Cu片和 溶液,重复上述操作。未加浓盐酸之前,无明显现象。加浓盐酸之后,溶液变为棕黄色,并有黑色固体生成。
溶液,重复上述操作。未加浓盐酸之前,无明显现象。加浓盐酸之后,溶液变为棕黄色,并有黑色固体生成。(5)经检验黑色固体是
 ,
, 在盐酸中与Cu单质反应的离子方程式为
在盐酸中与Cu单质反应的离子方程式为(6)为了进一步探究影响铜单质还原性的因素,进行了如下实验:
| 序号 | 实验装置图 | 试剂Y | 电压表 |
| i |
|  溶液 溶液 | 指针几乎不偏转 |
| ii | a | 指针明显偏转 | |
| iii | a+b | 指针偏转幅度更大 |
综合上述实验可知:氧化反应中,降低生成物浓度,还原剂的还原性增强。
您最近一年使用:0次
名校
3 . 1841年美国学者Fremy首次合成了 ,它是一种“环境友好型氧化剂”。某小组拟制备
,它是一种“环境友好型氧化剂”。某小组拟制备 ,并探究其性质。已知20℃时KCl的溶解度为37.4g,
,并探究其性质。已知20℃时KCl的溶解度为37.4g, 的溶解度为11.1g。
的溶解度为11.1g。
实验(一)制备 ,装置如图所示:
,装置如图所示:___________ 。
(2)甲装置中副产物为氯化钾,写出生成 的离子方程式:
的离子方程式:___________ ,实验完毕后,对甲装置中混合液进行___________ 过滤、洗涤、低温干燥。
实验(二)探究 性质及应用。
性质及应用。
取10g草酸溶于40mL水中,加入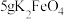 粉末,充分混合,观察到有大量气泡产生,并产生黑色固体。将所得气体通入足量澄清石灰水中,溶液变浑浊。根据上述实验现象,可以判断产生的气体中含有
粉末,充分混合,观察到有大量气泡产生,并产生黑色固体。将所得气体通入足量澄清石灰水中,溶液变浑浊。根据上述实验现象,可以判断产生的气体中含有 ,经测定所得气体中还含有
,经测定所得气体中还含有 。
。
(3)实验完毕后,将混合物经过滤、洗涤、干燥得到黑色固体,利用如图实验装置探究黑色固体的成分,当黑色固体完全反应后,测得浓硫酸质量净增bg,当 等于
等于___________ (用最简分数比表示)时,黑色固体为 。
。 稳定性(用
稳定性(用 浓度表示)与pH关系如图,其消毒效率与温度关系如图所示:
浓度表示)与pH关系如图,其消毒效率与温度关系如图所示:___________ 。
②在相同条件下, 作消毒剂最佳温度是
作消毒剂最佳温度是___________ 。
(5)查阅资料可知, 溶液呈紫红色,为探究
溶液呈紫红色,为探究 和
和 的电位相对大小,设计如下方案。(已知:电位一般指“电势”,用“
的电位相对大小,设计如下方案。(已知:电位一般指“电势”,用“ ”表示。氧化剂的电位是衡量其氧化性强度主要参数,电位越高,对应2条件下氧化剂的氧化性越强。)
”表示。氧化剂的电位是衡量其氧化性强度主要参数,电位越高,对应2条件下氧化剂的氧化性越强。)
方案1:在 溶液中加过量的
溶液中加过量的 粉末,溶液呈紫红色。
粉末,溶液呈紫红色。
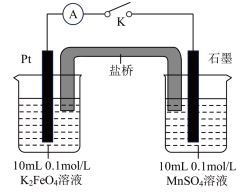
方案2:如图所示,关闭K时,观察到电流计指针偏转,铂极产生红褐色物质,石墨极附近无色溶液变紫红色。___________ (填“1”或“2”)能证明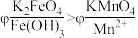 ,石墨极的电极反应式为
,石墨极的电极反应式为___________ 。
 ,它是一种“环境友好型氧化剂”。某小组拟制备
,它是一种“环境友好型氧化剂”。某小组拟制备 ,并探究其性质。已知20℃时KCl的溶解度为37.4g,
,并探究其性质。已知20℃时KCl的溶解度为37.4g, 的溶解度为11.1g。
的溶解度为11.1g。实验(一)制备
 ,装置如图所示:
,装置如图所示: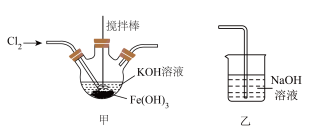
(2)甲装置中副产物为氯化钾,写出生成
 的离子方程式:
的离子方程式:实验(二)探究
 性质及应用。
性质及应用。取10g草酸溶于40mL水中,加入
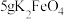 粉末,充分混合,观察到有大量气泡产生,并产生黑色固体。将所得气体通入足量澄清石灰水中,溶液变浑浊。根据上述实验现象,可以判断产生的气体中含有
粉末,充分混合,观察到有大量气泡产生,并产生黑色固体。将所得气体通入足量澄清石灰水中,溶液变浑浊。根据上述实验现象,可以判断产生的气体中含有 ,经测定所得气体中还含有
,经测定所得气体中还含有 。
。(3)实验完毕后,将混合物经过滤、洗涤、干燥得到黑色固体,利用如图实验装置探究黑色固体的成分,当黑色固体完全反应后,测得浓硫酸质量净增bg,当
 等于
等于 。
。
 稳定性(用
稳定性(用 浓度表示)与pH关系如图,其消毒效率与温度关系如图所示:
浓度表示)与pH关系如图,其消毒效率与温度关系如图所示: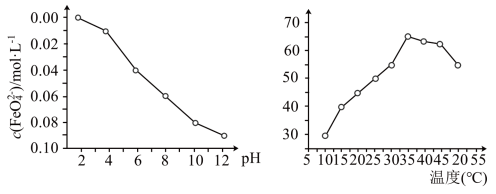
②在相同条件下,
 作消毒剂最佳温度是
作消毒剂最佳温度是(5)查阅资料可知,
 溶液呈紫红色,为探究
溶液呈紫红色,为探究 和
和 的电位相对大小,设计如下方案。(已知:电位一般指“电势”,用“
的电位相对大小,设计如下方案。(已知:电位一般指“电势”,用“ ”表示。氧化剂的电位是衡量其氧化性强度主要参数,电位越高,对应2条件下氧化剂的氧化性越强。)
”表示。氧化剂的电位是衡量其氧化性强度主要参数,电位越高,对应2条件下氧化剂的氧化性越强。)方案1:在
 溶液中加过量的
溶液中加过量的 粉末,溶液呈紫红色。
粉末,溶液呈紫红色。方案2:如图所示,关闭K时,观察到电流计指针偏转,铂极产生红褐色物质,石墨极附近无色溶液变紫红色。
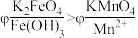 ,石墨极的电极反应式为
,石墨极的电极反应式为
您最近一年使用:0次
2023·全国·模拟预测
4 . 某学习小组探究 溶液与KI溶液的反应。资料:i.氧化性:
溶液与KI溶液的反应。资料:i.氧化性: ,
, 可以氧化
可以氧化 生成
生成 ;ii.KI溶液暴露在空气中或久置会变为黄色。
;ii.KI溶液暴露在空气中或久置会变为黄色。
Ⅰ.探究反应原理
(1)甲同学对两溶液可能发生的反应提出了下列两种猜想:
猜想a: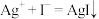
猜想b:
甲同学设计了如下实验进行论证。
甲同学根据实验现象得出猜想a成立,猜想b不成立,依据的实验现象是___________ 。
(2)乙同学认为上述实验结果可以证明猜想a成立,但不足以证明猜想b不成立。猜想b可能成立的理由是___________ 。
Ⅱ. 与
与 是否能发生氧化还原反应
是否能发生氧化还原反应
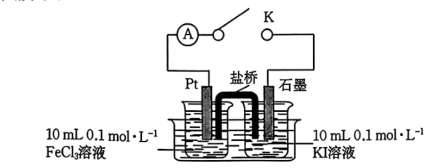
为探究 与
与 是否能发生氧化还原反应,丙同学设计了如下实验装置(盐桥中装有含
是否能发生氧化还原反应,丙同学设计了如下实验装置(盐桥中装有含 饱和溶液的琼胶):
饱和溶液的琼胶):

(3)若左侧电极为负极,右侧电极为正极,则左、右烧杯中的试剂X和Y分别是___________ 、___________ 。
(4)电池反应一段时间后,KI溶液逐渐变为黄色。为进一步证明 与
与 发生了氧化还原反应,丙同学取少量盛装KI溶液烧杯中的液体,向其中加入淀粉溶液,淀粉变蓝。丙同学由此得出
发生了氧化还原反应,丙同学取少量盛装KI溶液烧杯中的液体,向其中加入淀粉溶液,淀粉变蓝。丙同学由此得出 和
和 发生了氧化还原反应,是否合理?
发生了氧化还原反应,是否合理?___________ ;说明理由:___________ 。
(5)电流表指针发生明显偏转,结合(4)可知, 溶液中发生的电极反应式为
溶液中发生的电极反应式为___________ ,KI溶液中发生的电极反应式为___________ ,因此验证了 与
与 能发生氧化还原反应。
能发生氧化还原反应。
 溶液与KI溶液的反应。资料:i.氧化性:
溶液与KI溶液的反应。资料:i.氧化性: ,
, 可以氧化
可以氧化 生成
生成 ;ii.KI溶液暴露在空气中或久置会变为黄色。
;ii.KI溶液暴露在空气中或久置会变为黄色。Ⅰ.探究反应原理
(1)甲同学对两溶液可能发生的反应提出了下列两种猜想:
猜想a:
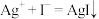
猜想b:

甲同学设计了如下实验进行论证。
| 实验序号 | 实验操作 |
| 1 | 向盛有1mL  溶液的试管中,加入1mL 溶液的试管中,加入1mL KI溶液 KI溶液 |
| 2 | 向实验1的试管中滴加淀粉溶液 |
(2)乙同学认为上述实验结果可以证明猜想a成立,但不足以证明猜想b不成立。猜想b可能成立的理由是
Ⅱ.
 与
与 是否能发生氧化还原反应
是否能发生氧化还原反应为探究
 与
与 是否能发生氧化还原反应,丙同学设计了如下实验装置(盐桥中装有含
是否能发生氧化还原反应,丙同学设计了如下实验装置(盐桥中装有含 饱和溶液的琼胶):
饱和溶液的琼胶):
(3)若左侧电极为负极,右侧电极为正极,则左、右烧杯中的试剂X和Y分别是
(4)电池反应一段时间后,KI溶液逐渐变为黄色。为进一步证明
 与
与 发生了氧化还原反应,丙同学取少量盛装KI溶液烧杯中的液体,向其中加入淀粉溶液,淀粉变蓝。丙同学由此得出
发生了氧化还原反应,丙同学取少量盛装KI溶液烧杯中的液体,向其中加入淀粉溶液,淀粉变蓝。丙同学由此得出 和
和 发生了氧化还原反应,是否合理?
发生了氧化还原反应,是否合理?(5)电流表指针发生明显偏转,结合(4)可知,
 溶液中发生的电极反应式为
溶液中发生的电极反应式为 与
与 能发生氧化还原反应。
能发生氧化还原反应。
您最近一年使用:0次
名校
解题方法
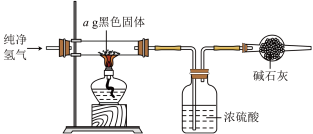
5 . 氯化铁常用于生物和矿物分析,可作为诊断试剂。某小组制备无水 并探究其性质。
并探究其性质。
实验(一)制备无水 。
。
资料显示:亚硫酰氯( )沸点为
)沸点为 ,
, 。
。
操作:将 和适量
和适量 混合共热制备无水
混合共热制备无水 ,装置如图所示。
,装置如图所示。
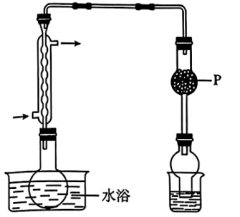
(1)干燥管P中宜盛放_______ (填物质名称)。
(2)写出足量 和
和 反应的化学方程式:
反应的化学方程式:_______ 。
(3)反应完成后,取少量烧瓶中固体溶于蒸馏水中,滴加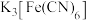 溶液,产生蓝色沉淀,简要分析其原因:
溶液,产生蓝色沉淀,简要分析其原因:_______ 。
实验(二)测定 和
和 反应的热效应。
反应的热效应。
配制 溶液:取一定量
溶液:取一定量 固体溶于浓盐酸中,加蒸馏水稀释至指定体积。
固体溶于浓盐酸中,加蒸馏水稀释至指定体积。
(4)浓盐酸的作用是_______ 。
(5)某小组设计两种方案测定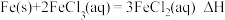 。
。
方案1:直接法
取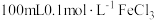 溶液和
溶液和 反应,测量反应前、后溶液的温度计算反应热。
反应,测量反应前、后溶液的温度计算反应热。
方案2:间接法
分别测定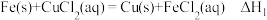 和
和 ,利用盖斯定律计算反应热。
,利用盖斯定律计算反应热。
其中,方案_______ (填“1”或“2”)不可靠,原因是_______ 。
实验(三)探究 和
和 的反应。
的反应。
【查阅资料】 的氧化性大于
的氧化性大于 。
。
【提出假设】 和
和 的反应存在可逆性。
的反应存在可逆性。
【设计实验】如图所示。
实验操作及现象与记录如下:
(6)b_______ (填“>”“<”或“=”)0.上述实验说明,改变_______ 使反应向逆反应方向进行。
(7)简述实验原理:_______ 。由此证明假设成立。
 并探究其性质。
并探究其性质。实验(一)制备无水
 。
。资料显示:亚硫酰氯(
 )沸点为
)沸点为 ,
, 。
。操作:将
 和适量
和适量 混合共热制备无水
混合共热制备无水 ,装置如图所示。
,装置如图所示。
(1)干燥管P中宜盛放
(2)写出足量
 和
和 反应的化学方程式:
反应的化学方程式:(3)反应完成后,取少量烧瓶中固体溶于蒸馏水中,滴加
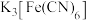 溶液,产生蓝色沉淀,简要分析其原因:
溶液,产生蓝色沉淀,简要分析其原因:实验(二)测定
 和
和 反应的热效应。
反应的热效应。配制
 溶液:取一定量
溶液:取一定量 固体溶于浓盐酸中,加蒸馏水稀释至指定体积。
固体溶于浓盐酸中,加蒸馏水稀释至指定体积。(4)浓盐酸的作用是
(5)某小组设计两种方案测定
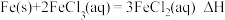 。
。方案1:直接法
取
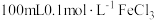 溶液和
溶液和 反应,测量反应前、后溶液的温度计算反应热。
反应,测量反应前、后溶液的温度计算反应热。方案2:间接法
分别测定
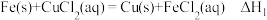 和
和 ,利用盖斯定律计算反应热。
,利用盖斯定律计算反应热。其中,方案
实验(三)探究
 和
和 的反应。
的反应。【查阅资料】
 的氧化性大于
的氧化性大于 。
。【提出假设】
 和
和 的反应存在可逆性。
的反应存在可逆性。【设计实验】如图所示。

实验操作及现象与记录如下:
| 步骤 | 操作及现象 | 记录 |
| I | 按装置图装好试剂,关闭K,发现电流计指针向左偏转 | 电流强度I为a( ) ) |
| II | 一段时间后,电流计指针慢慢回归原位 | 指针回归至原位时,电流强度I为b |
| III | 再向左烧杯里加入 浓溶液,电流计指针向右偏转 浓溶液,电流计指针向右偏转 | 电流强度I为x |
(7)简述实验原理:
您最近一年使用:0次
2024-01-11更新
|
159次组卷
|
3卷引用:T28-实验综合题
6 . 资料显示, 可以将
可以将 氧化为
氧化为 。某小组同学设计实验探究
。某小组同学设计实验探究 被
被 氧化的产物及铜元素的价态。
氧化的产物及铜元素的价态。
已知: 易溶于
易溶于 溶液,发生反应
溶液,发生反应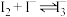 (红棕色);
(红棕色); 和
和 氧化性几乎相同。
氧化性几乎相同。
I.将等体积的 溶液加入到
溶液加入到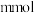 铜粉和
铜粉和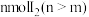 的固体混合物中,振荡。
的固体混合物中,振荡。
实验记录如下:
(1)初始阶段, 被氧化的反应速率:实验Ⅰ
被氧化的反应速率:实验Ⅰ__________ (填“>”“<”或“=”)实验Ⅱ。
(2)实验Ⅲ所得溶液中,被氧化的铜元素的可能存在形式有 (蓝色)或
(蓝色)或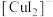 (无色),进行以下实验探究:
(无色),进行以下实验探究:
步骤a.取实验Ⅲ的深红棕色溶液,加入 ,多次萃取、分液。
,多次萃取、分液。
步骤b.取分液后的无色水溶液,滴入浓氨水。溶液颜色变浅蓝色,并逐渐变深。
ⅰ.步骤a的目的是_____________________ 。
ⅱ.查阅资料, ,
, (无色)容易被空气氧化。用离子方程式解释步骤
(无色)容易被空气氧化。用离子方程式解释步骤 的溶液中发生的变化:
的溶液中发生的变化:______________ 。
(3)结合实验Ⅲ,推测实验Ⅰ和Ⅱ中的白色沉淀可能是 ,实验Ⅰ中铜被氧化的化学方程式是
,实验Ⅰ中铜被氧化的化学方程式是____________________ 。分别取实验Ⅰ和Ⅱ充分反应后的固体,洗涤后得到白色沉淀,加入浓 溶液,
溶液,__________ (填实验现象),观察到少量红色的铜。分析铜未完全反应的原因是____________________ 。
(4)上述实验结果, 仅将
仅将 氧化为
氧化为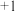 价。在隔绝空气的条件下进行电化学实验,证实了
价。在隔绝空气的条件下进行电化学实验,证实了 能将
能将 氧化为
氧化为 。装置如图所示,
。装置如图所示, 分别是
分别是_____________ 。 被
被 氧化的产物中价态不同的原因:
氧化的产物中价态不同的原因:_________ 。
 可以将
可以将 氧化为
氧化为 。某小组同学设计实验探究
。某小组同学设计实验探究 被
被 氧化的产物及铜元素的价态。
氧化的产物及铜元素的价态。已知:
 易溶于
易溶于 溶液,发生反应
溶液,发生反应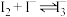 (红棕色);
(红棕色); 和
和 氧化性几乎相同。
氧化性几乎相同。I.将等体积的
 溶液加入到
溶液加入到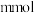 铜粉和
铜粉和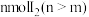 的固体混合物中,振荡。
的固体混合物中,振荡。实验记录如下:
| 实验现象 | |
实验Ⅰ |
| 极少量 溶解,溶液为淡红色;充分反应后,红色的铜粉转化为白色沉淀,溶液仍为淡红色 溶解,溶液为淡红色;充分反应后,红色的铜粉转化为白色沉淀,溶液仍为淡红色 |
实验Ⅱ |
| 部分 溶解,溶液为红棕色;充分反应后,红色的铜粉转化为白色沉淀,溶液仍为红棕色 溶解,溶液为红棕色;充分反应后,红色的铜粉转化为白色沉淀,溶液仍为红棕色 |
实验Ⅲ |
|  完全溶解,溶液为深红棕色;充分反应后,红色的铜粉完全溶解,溶液为深红棕色 完全溶解,溶液为深红棕色;充分反应后,红色的铜粉完全溶解,溶液为深红棕色 |
 被氧化的反应速率:实验Ⅰ
被氧化的反应速率:实验Ⅰ(2)实验Ⅲ所得溶液中,被氧化的铜元素的可能存在形式有
 (蓝色)或
(蓝色)或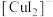 (无色),进行以下实验探究:
(无色),进行以下实验探究:步骤a.取实验Ⅲ的深红棕色溶液,加入
 ,多次萃取、分液。
,多次萃取、分液。步骤b.取分液后的无色水溶液,滴入浓氨水。溶液颜色变浅蓝色,并逐渐变深。
ⅰ.步骤a的目的是
ⅱ.查阅资料,
 ,
, (无色)容易被空气氧化。用离子方程式解释步骤
(无色)容易被空气氧化。用离子方程式解释步骤 的溶液中发生的变化:
的溶液中发生的变化:(3)结合实验Ⅲ,推测实验Ⅰ和Ⅱ中的白色沉淀可能是
 ,实验Ⅰ中铜被氧化的化学方程式是
,实验Ⅰ中铜被氧化的化学方程式是 溶液,
溶液,(4)上述实验结果,
 仅将
仅将 氧化为
氧化为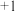 价。在隔绝空气的条件下进行电化学实验,证实了
价。在隔绝空气的条件下进行电化学实验,证实了 能将
能将 氧化为
氧化为 。装置如图所示,
。装置如图所示, 分别是
分别是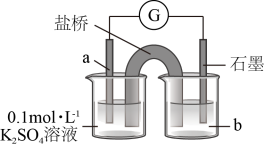
 被
被 氧化的产物中价态不同的原因:
氧化的产物中价态不同的原因:
您最近一年使用:0次
2023-06-28更新
|
9206次组卷
|
15卷引用:专题19 实验综合题
(已下线)专题19 实验综合题(已下线)专题19 实验综合题(已下线)2023年北京卷高考真题变式题(实验探究题)(已下线)T28-实验探究题(已下线)专题15 化学实验综合题-2023年高考化学真题题源解密(新高考专用)(已下线)专题14 化学实验综合题-2023年高考化学真题题源解密(全国通用)(已下线)第17讲实验方案的设计与评价(已下线)考点12 金属材料(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)(已下线)考点48 实验方案设计与评价(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)考点4 化学实验方案设计与探究 (核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)2023年高考北京卷化学真题湖北省黄冈市重点校2022-2023学年高一下学期期末综合选拔性联考化学试题北京市第一七一中学2023-2024学年高三上学期12月月考化学试题 北京师范大学附属中学2023-2024学年高三上学期12月月考化学(2)试题宁夏回族自治区银川一中2024届高三下学期考前热身训练化学试卷2
解题方法
7 . 某实验小组学生为探究氧化性: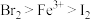 ,设计下列实验方案。
,设计下列实验方案。
【查阅资料】电极电势如下表:(已知:电极电势越高,氧化性越强)
回答下列问题:
(1)利用 和氯水,设计实验证明氧化性:
和氯水,设计实验证明氧化性: ,实验如图所示,实验过程中,能证明氧化性:
,实验如图所示,实验过程中,能证明氧化性: 的现象是
的现象是_____ ,有关反应的离子方程式为_____ 。

(2)利用 的
的 溶液和
溶液和 的
的 溶液,不用任何试剂证明氧化性:
溶液,不用任何试剂证明氧化性: ,
, 溶液和碘水颜色相近,设计的实验装置如图,实验过程中,电流计指针偏转,说明反应发生。
溶液和碘水颜色相近,设计的实验装置如图,实验过程中,电流计指针偏转,说明反应发生。
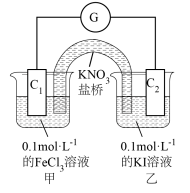
①通过外电路中电流方向:_____ (用 和
和 表示),可证明氧化性:
表示),可证明氧化性: 。
。
②也可通过甲池中颜色变化证明,甲池中颜色变化为_____ 。
(3)有同学认为还可以通过电解反应来证明氧化性: ,为此设计了如下实验:利用惰性电极电解
,为此设计了如下实验:利用惰性电极电解 的
的 溶液,探究外界条件对电极反应产物的影响,实验数据如下表所示:
溶液,探究外界条件对电极反应产物的影响,实验数据如下表所示:
①实验1中,阳极反应式是_____ ,阴极反应式为_____ 。
②实验1、3调节溶液的 宜选用
宜选用_____ (填“硝酸”或“硫酸”)。
③由实验1、2的现象可得出的结论为_____ ;由实验1、3可得出的结论为_____ 。
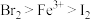 ,设计下列实验方案。
,设计下列实验方案。【查阅资料】电极电势如下表:(已知:电极电势越高,氧化性越强)
| 氧化还原电对(氧化型/还原型) | 电极反应式(氧化型 还原型) 还原型) | 电极电势 |
 / / | 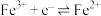 | 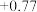 |
 / / |  | 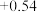 |
 / / |  | 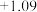 |
(1)利用
 和氯水,设计实验证明氧化性:
和氯水,设计实验证明氧化性: ,实验如图所示,实验过程中,能证明氧化性:
,实验如图所示,实验过程中,能证明氧化性: 的现象是
的现象是
(2)利用
 的
的 溶液和
溶液和 的
的 溶液,不用任何试剂证明氧化性:
溶液,不用任何试剂证明氧化性: ,
, 溶液和碘水颜色相近,设计的实验装置如图,实验过程中,电流计指针偏转,说明反应发生。
溶液和碘水颜色相近,设计的实验装置如图,实验过程中,电流计指针偏转,说明反应发生。
①通过外电路中电流方向:
 和
和 表示),可证明氧化性:
表示),可证明氧化性: 。
。②也可通过甲池中颜色变化证明,甲池中颜色变化为
(3)有同学认为还可以通过电解反应来证明氧化性:
 ,为此设计了如下实验:利用惰性电极电解
,为此设计了如下实验:利用惰性电极电解 的
的 溶液,探究外界条件对电极反应产物的影响,实验数据如下表所示:
溶液,探究外界条件对电极反应产物的影响,实验数据如下表所示:| 实验 | 电压 |  | 阳极现象 | 阴极现象 |
| 实验1 | 1.5 | 5.5 | 滴加淀粉溶液显蓝色,滴加 溶液不显红色 溶液不显红色 | 无气泡,银白色金属析出 |
| 实验2 | 3.0 | 5.5 | 滴加淀粉溶液显蓝色,滴加 溶液显浅红色 溶液显浅红色 | 无气泡,银白色金属析出 |
| 实验3 | 1.5 |  | 滴加淀粉溶液显蓝色,滴加 溶液不显红色 溶液不显红色 | 较多气泡,极少量金属析出 |
②实验1、3调节溶液的
 宜选用
宜选用③由实验1、2的现象可得出的结论为
您最近一年使用:0次
名校
8 . 某小组同学利用原电池装置探究物质的性质。资料显示:原电池装置中,负极反应物的还原性越强,或正极反应物的氧化性越强,原电池的电压越大。
(1)同学们利用下表中装置进行实验并记录。
①同学们认为实验Ⅰ中铁主要发生了析氢腐蚀,其正极反应式是_____________ 。
②针对实验Ⅱ现象:甲同学认为不可能发生析氢腐蚀,其判断依据是_______ ;乙同学认为实验Ⅱ中应发生吸氧腐蚀,其正极的电极反应式是___________ 。
(2)同学们仍用上述装置并用Cu和石墨为电极继续实验,探究实验Ⅱ指针偏转原因及影响O2氧化性因素。
①丙同学比较实验Ⅱ、Ⅲ、Ⅳ的电压表读数为:c>a>b,请解释原因是_____________ 。
②丁同学对Ⅳ、Ⅴ进行比较,其目的是探究_____________________ 对O2氧化性的影响;实验Ⅳ中加入Na2SO4溶液的目的是_____________ 。
(1)同学们利用下表中装置进行实验并记录。
| 装置 | 编号 | 电极A | 溶液B | 操作及现象 |
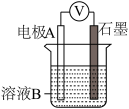 | Ⅰ | Fe | pH=2的H2SO4 | 连接装置后,石墨表面产生无色气泡;电压表指针偏转 |
| Ⅱ | Cu | pH=2的H2SO4 | 连接装置后,石墨表面无明显现象;电压表指针偏转,记录读数为a |
②针对实验Ⅱ现象:甲同学认为不可能发生析氢腐蚀,其判断依据是
(2)同学们仍用上述装置并用Cu和石墨为电极继续实验,探究实验Ⅱ指针偏转原因及影响O2氧化性因素。
| 编号 | 溶液B | 操作及现象 |
| Ⅲ | 经煮沸的pH=2的 H2SO4 | 溶液表面用煤油覆盖,连接装置后,电压表指针微微偏转,记录读数为b |
| Ⅳ | pH=2的H2SO4 | 在石墨一侧缓慢通入O2并连接装置,电压表指针偏转,记录读数为c;取出电极,向溶液中加入数滴浓Na2SO4溶液混合后,插入电极,保持O2通入,电压表读数仍为c |
| Ⅴ | pH=12的NaOH | 在石墨一侧缓慢通入O2并连接装置,电压表指针偏转,记录读数为d |
②丁同学对Ⅳ、Ⅴ进行比较,其目的是探究
您最近一年使用:0次
2019-11-21更新
|
1244次组卷
|
11卷引用:【教材实验热点】09 化学能与电能
(已下线)【教材实验热点】09 化学能与电能江苏省苏州市张家港高级中学2019-2020学年高二上学期期中考试化学试题安徽省太和第一中学2019-2020学年高一下学期期末考试化学试题河北省承德市隆化存瑞中学2019-2020学年高一下学期期末测试化学试题福建省厦门第一中学2020-2021学年高二10月月考化学试题(已下线)专题4.4 金属的电化学腐蚀与防护-2020-2021学年高二化学同步课堂帮帮帮(人教版选修4)(已下线)4.4 金属的电化学腐蚀与防护(重点练)-2020-2021学年高二化学上学期十分钟同步课堂专练(人教版选修4)(已下线)第4章 化学反应与电能(章末检测)-2021-2022学年高二化学课时过关提优AB练(人教版2019选择性必修1)(已下线)第4章 电化学基础(选拔卷)-【单元测试】2021-2022学年高二化学尖子生选拔卷(人教版选修4)河北省石家庄市第四十二中学2022-2023高二上学期10月月考化学试题福建省莆田第六中学2022-2023学年高二上学期第二次月考(B卷)化学试题
名校
解题方法
9 . 某学习小组的同学查阅相关资料知氧化性: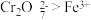 ,设计了盐桥式的原电池,如图所示,盐桥中装有琼脂与饱和
,设计了盐桥式的原电池,如图所示,盐桥中装有琼脂与饱和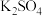 溶液。下列叙述中正确的是
溶液。下列叙述中正确的是
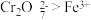 ,设计了盐桥式的原电池,如图所示,盐桥中装有琼脂与饱和
,设计了盐桥式的原电池,如图所示,盐桥中装有琼脂与饱和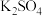 溶液。下列叙述中正确的是
溶液。下列叙述中正确的是
| A.甲烧杯的溶液中发生还原反应 |
B.乙烧杯中发生的电极反应为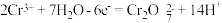 |
C.电池工作时,盐桥中的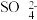 移向乙烧杯 移向乙烧杯 |
| D.外电路的电流方向为从b到a |
您最近一年使用:0次
2021-04-07更新
|
554次组卷
|
12卷引用:2019年9月15日 《每日一题》2020年一轮复习 —— 每周一测
(已下线)2019年9月15日 《每日一题》2020年一轮复习 —— 每周一测(已下线)第20讲 原电池 化学电源(精练)-2021年高考化学一轮复习讲练测(已下线)第16讲 原电池 (练) — 2022年高考化学一轮复习讲练测(新教材新高考)(已下线)第24讲原电池与化学电源2015届福建省长汀县第一中学高三上学期第四次月考化学试卷2016-2017学年浙江省嘉兴一中高二上期中化学试卷江西省宜春市奉新县第一中学2020-2021学年高二下学期第一次月考化学试题辽宁省沈阳市第二中学2021-2022学年高一下学期期中考试化学试题四川省南充市第一中学2021-2022学年高一下学期6月月考化学试题重庆市第一中学校2020-2021学年高二下学期期末考试化学试题广东省韶关市2022-2023学年高二下学期期末考试化学试题四川省射洪中学2022—2023学年高一下学期(强基班)第三次月考化学试题
名校
解题方法
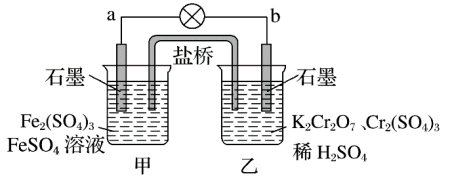
10 . 某学习小组的同学查阅相关资料得到氧化性: ,设计了如图所示的盐桥原电池。盐桥中装有含琼脂的饱和
,设计了如图所示的盐桥原电池。盐桥中装有含琼脂的饱和 溶液。下列叙述中正确的是
溶液。下列叙述中正确的是
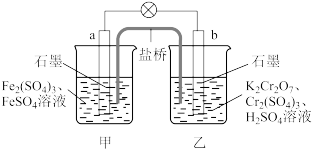
 ,设计了如图所示的盐桥原电池。盐桥中装有含琼脂的饱和
,设计了如图所示的盐桥原电池。盐桥中装有含琼脂的饱和 溶液。下列叙述中正确的是
溶液。下列叙述中正确的是
| A.甲烧杯的溶液中发生还原反应 |
| B.外电路的电流方向是从b极到a极 |
C.电池工作时,盐桥中的 移向乙烧杯 移向乙烧杯 |
D.乙烧杯中的电极反应式为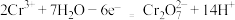 |
您最近一年使用:0次
2020-09-12更新
|
461次组卷
|
7卷引用:第16讲 原电池 (练) — 2022年高考化学一轮复习讲练测(新教材新高考)