名校
解题方法
1 . 下列实验操作能达到实验目的的是
| 选项 | 实验目的 | 实验操作 |
| A | 比较Cu和Ag的金属性 | 将银棒和铜棒分别插入AgNO3溶液与CuSO4溶液中,并用盐桥和导线(含电流表)将二者连接组成原电池 |
| B | 验证KI溶液与FeCl3溶液之间的反应为可逆反应 | 取2mL0.1mol/LKI溶液,加入5~6滴FeCl3溶液充分反应,再滴入2滴淀粉溶液 |
| C | 证明苯能与液溴发生取代反应 | 将苯与液溴反应生成的气体直接通入AgNO3溶液中 |
| D | 证明pH(CuSO4)随温度升高而增大 | 用pH计分别测量40℃和70℃时0.1mol/LCuSO4溶液的pH |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
2 . 下列实验能达到目的的是
| A.测定中和反应的反应热:用酸碱中和滴定法 |
| B.判断醋酸为弱电解质:测定并比较醋酸和盐酸的pH |
| C.用98%浓硫酸配制10%的稀硫酸:仪器为烧杯、玻璃棒 |
| D.测定镀锌铁皮的镀层厚度:将镀锌铁皮放入稀硫酸中,待产生氢气的速率突然减小,可以判断锌镀层已反应完全 |
您最近一年使用:0次
解题方法
3 . 按如图装置进行探究实验,关闭K后,反应开始。下列说法错误的是

| A.石墨电极A为正极 |
| B.U型管中M代表阳离子交换膜 |
C.a中产生白色沉淀,溶液中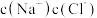 减小 减小 |
| D.b中溶液变为橙黄色,说明非金属性:Cl>Br |
您最近一年使用:0次
2024-03-22更新
|
820次组卷
|
3卷引用:河北省承德市部分高中2024届高三下学期二模化学试题
河北省承德市部分高中2024届高三下学期二模化学试题广东省佛山市2024届高三教学质量检测(一)化学试题(已下线)压轴题06?电化学原理综合分析(6大题型+方法总结+压轴题速练)-2024年高考化学压轴题专项训练(新高考通用)
4 . 下列措施是为了加快化学反应速率的是
| A.暖宝宝中除了主要加铁粉和水外,还额外加入适量的活性炭、无机盐等 |
| B.轮船外面镶嵌锌块 |
| C.在钢制大桥的表面涂油漆 |
| D.将河流中铁制闸门与外加直流电源的负极相连 |
您最近一年使用:0次
名校
解题方法
5 . 回答下列问题:
(1)电解硫酸亚铁和硫酸铝溶液得到液体聚合硫酸铝铁[AlaFeb(OH)m(SO4)n]。装置如图1所示(阴离子交换膜只允许阴离子通过,电极为惰性电极):
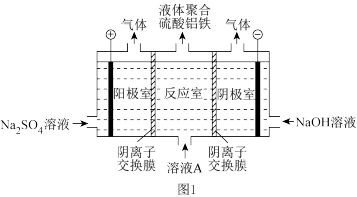
①电解过程阳极室溶液 pH 的变化是___________ (填“增大”、“减小”或“不变”)。
②简述在反应室中生成液体聚合硫酸铝铁的原理___________ 。
(2)如图2是一种用电解原理来制备 H2O2,并用产生的 H2O2处理废氨水的装置。

①Ir-Ru 惰性电极吸附 O2生成 H2O2,其电极反应式为___________ 。。
②理论上电路中每转移3 mol e-,最多可以处理废氨水中溶质(以NH3计)的质量是___________ g。
(3)为探究金属的腐蚀情况,某同学取一张用饱和 NaCl 溶液浸湿的石蕊试纸,平铺在一块金属板上,按如图3所示的方法连接电路。
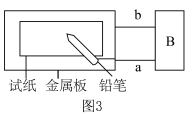
①若试纸为红色石蕊试纸,金属板为一锌片,B 处为一灵敏电流计,接通电路,将铅笔芯(主要成分为石墨)放置在试纸上一段时间,发现电流计指针发生偏转,则铅笔芯与试纸接触处颜色___________ 。
②若金属板为一铂片,B 处为一直流电源,接通电源后,若试纸为蓝色石蕊试纸,将铅笔芯放置在试纸上一段时间后,若接触处出现一个双色同心圆,内圈为白色,外圈呈浅红色,则铅笔芯与试纸接触处的电极反应式为___________ 。
(1)电解硫酸亚铁和硫酸铝溶液得到液体聚合硫酸铝铁[AlaFeb(OH)m(SO4)n]。装置如图1所示(阴离子交换膜只允许阴离子通过,电极为惰性电极):

①电解过程阳极室溶液 pH 的变化是
②简述在反应室中生成液体聚合硫酸铝铁的原理
(2)如图2是一种用电解原理来制备 H2O2,并用产生的 H2O2处理废氨水的装置。

①Ir-Ru 惰性电极吸附 O2生成 H2O2,其电极反应式为
②理论上电路中每转移3 mol e-,最多可以处理废氨水中溶质(以NH3计)的质量是
(3)为探究金属的腐蚀情况,某同学取一张用饱和 NaCl 溶液浸湿的石蕊试纸,平铺在一块金属板上,按如图3所示的方法连接电路。

①若试纸为红色石蕊试纸,金属板为一锌片,B 处为一灵敏电流计,接通电路,将铅笔芯(主要成分为石墨)放置在试纸上一段时间,发现电流计指针发生偏转,则铅笔芯与试纸接触处颜色
②若金属板为一铂片,B 处为一直流电源,接通电源后,若试纸为蓝色石蕊试纸,将铅笔芯放置在试纸上一段时间后,若接触处出现一个双色同心圆,内圈为白色,外圈呈浅红色,则铅笔芯与试纸接触处的电极反应式为
您最近一年使用:0次
2023-09-19更新
|
71次组卷
|
2卷引用:河北省唐县第一中学2023-2024学年高二上学期9月月考化学试题
解题方法
6 . 锂与生活息息相关,个人携带的笔记本电脑、手机、蓝牙耳机等数码产品中应用的锂离子电池中就含有丰富的锂元素。锂晶胞为最密六方堆积(如图),图中底边长为apm,高为bpm,设NA为阿伏加德罗常数的值,下列说法错误的是


| A.该结构中含有6个Li原子 |
| B.该结构中Li的配位数为6 |
C.锂晶体的密度为 |
| D.锂离子电池放电时,Li+从负极脱嵌,经过电解质嵌入正极 |
您最近一年使用:0次
2023-08-31更新
|
297次组卷
|
4卷引用:河北省保定市部分高中2023-2024学年高三上学期开学考试化学试题
7 . 下列事实能用平衡移动原理解释的是
A. 溶液中加入少量 溶液中加入少量 固体,促进 固体,促进 分解 分解 |
B.密闭烧瓶内的 和 和 的混合气体,受热后颜色加深 的混合气体,受热后颜色加深 |
C.铁钉放入浓 中,待不再变化后,加热能产生大量红棕色气体 中,待不再变化后,加热能产生大量红棕色气体 |
D.锌片与稀 反应过程中,加入少量 反应过程中,加入少量 固体,促进 固体,促进 的产生 的产生 |
您最近一年使用:0次
2023-06-28更新
|
8246次组卷
|
24卷引用:河北省唐山市第一中学2023-2024学年高二上学期10月月考化学试题
河北省唐山市第一中学2023-2024学年高二上学期10月月考化学试题河北省石家庄市河北正定中学2024届高三上学期第二次月考化学试题2023年高考北京卷化学真题(已下线)专题15 化学反应速率和化学平衡(已下线)专题15 化学反应速率和化学平衡(已下线)2023年北京卷高考真题变式题(选择题1-5)(已下线)专题08 反应速率与化学平衡-2023年高考化学真题题源解密(新高考专用)(已下线)专题11 化学反应速率与化学平衡-2023年高考化学真题题源解密(全国通用)(已下线)考点22 化学平衡状态与化学平衡(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)第28讲化化学平衡的移动及反应进行的方向(已下线)实验02 定性与定量研究影响化学反应速率的因素-【同步实验课】2023-2024学年高二化学教材实验大盘点(人教版2019选择性必修1)(已下线)实验03 探究外界条件对化学平衡移动的影响-【同步实验课】2023-2024学年高二化学教材实验大盘点(人教版2019选择性必修1)(已下线)专题05 影响化学平衡的因素【考题猜想】(6大题型)-2023-2024学年高二化学期中考点大串讲(人教版2019选择性必修1)辽宁省东北育才学校2023-2024学年高二上学期第一次月考化学试题(已下线)考点2 化学平衡 (核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)山东省枣庄市第三中学2023-2024学年高三上学期10月月考化学试题重庆市第七中学校2023-2024学年高三上学期11月月考化学试卷北京市中关村中学2023-2024学年高二上学期期中考试化学试题新疆乌鲁木齐八一中学2023-2024学年高二上学期第一次月考化学试题北京师范大学第二附属中学2023-2024学年高三上学期期中考试化学试题北京市第一六一中学2023-2024学年高三上学期12月月考化学试题(已下线)专题07 原电池-【寒假自学课】2024年高二化学寒假提升学与练(人教版2019)北京师范大学附属中学2023-2024学年高三上学期12月月考化学(2)试题湖北省武汉市常青联合体联考2023-2024学年高二上学期1月期末考试化学试题
名校
8 . 氢气既是一种清洁能源,又是重要的化工原料。回答下列问题:
(1)已知:断裂1molH-H、1molO=O、1molH-O键吸收的能量依次为436kJ、498kJ、467kJ,在2H2(g)+O2(g)=2H2O(g)反应中,44.8LH2(标准状况治好完全反应放出的能量为_____ kJ。
(2)实验室用纯净的铝片与稀硫酸反应制取氢气。
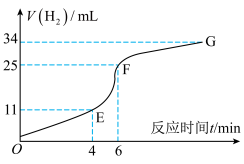
①实验过程如图所示,分析判断_____ 段化学反应速率最快(填OE、EF或FG)。
②将铝片投入盛有稀硫酸的烧杯中,刚开始时产生H2的速率逐渐加快,其原因是_____ 。
(3)要加快铝与硫酸溶液制H2的反应速率,小组成员提出一系列方案,比如:①加入某种催化剂;②加入蒸馏水:③将铝片换成铝粉;④增加硫酸的浓度至18mol/L;⑤_____ ;⑥_____ 。以上方案不合理的有_____ ;请你再补充两种合理方案,填入空白⑤⑥处。
(1)已知:断裂1molH-H、1molO=O、1molH-O键吸收的能量依次为436kJ、498kJ、467kJ,在2H2(g)+O2(g)=2H2O(g)反应中,44.8LH2(标准状况治好完全反应放出的能量为
(2)实验室用纯净的铝片与稀硫酸反应制取氢气。
①实验过程如图所示,分析判断

②将铝片投入盛有稀硫酸的烧杯中,刚开始时产生H2的速率逐渐加快,其原因是
(3)要加快铝与硫酸溶液制H2的反应速率,小组成员提出一系列方案,比如:①加入某种催化剂;②加入蒸馏水:③将铝片换成铝粉;④增加硫酸的浓度至18mol/L;⑤
您最近一年使用:0次
9 . 近年来随着中国科技的崛起,中国电动汽车也随之获得迅猛发展。下列说法错误的是
| A.电动汽车行驶时电池将化学能转化为电能 |
| B.电动汽车行驶时电池的正极发生氧化反应 |
| C.电动汽车充电时电池将电能转化为化学能 |
| D.电动汽车充电时电池的阴极发生还原反应 |
您最近一年使用:0次
名校
解题方法
10 . 下列有关说法不正确的是
| A.盐酸与锌粉反应时,若加入少量CuSO4溶液,能加快H2产生速率 |
| B.增大反应物的浓度,平衡向右移动,生成物的体积分数不一定增大 |
| C.钢铁浸泡于食盐水中发生电化学腐蚀时的正极反应为:2H2O+2e-=H2↑+2OH- |
| D.已知:S(g)+O2(g)=SO2(g) ΔH1;S(s)+O2(g)=SO2(g) ΔH2,则ΔH1<ΔH2 |
您最近一年使用:0次
2022-09-27更新
|
175次组卷
|
2卷引用:河北省昌黎第一中学2023届高三下学期第七次调研考试化学试题



