名校
解题方法
1 . 下列四个常用电化学装置的叙述错误的是
 | 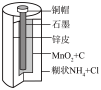 | 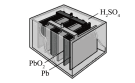 |  |
| 图Ⅰ水果电池图 | 图Ⅱ干电池 | 图Ⅲ铅酸蓄电池 | 图Ⅳ氢氧燃料电池 |
| A.图Ⅰ所示电池中,电流从铜片流出 |
| B.图Ⅱ所示干电池中锌皮作负极 |
| C.图Ⅲ所示电池为二次电池,放电过程中负极质量增加 |
D.图Ⅳ所示电池中正极反应为: |
您最近一年使用:0次
2022-07-20更新
|
234次组卷
|
2卷引用:黑龙江省大庆市实验中学2021-2022学年高一下学期期末考试化学试题
名校
2 . 下列关于化学反应原理说法正确的是
| A.金属钠与足量水反应,增加水的量能加快反应速率 |
| B.外界条件相同时,放热反应的速率一定大于吸热反应的速率 |
C.同温同压下, 在光照和点燃条件的 在光照和点燃条件的 相同 相同 |
D.2.8g铁片与  的稀硫酸反应,加入少量 的稀硫酸反应,加入少量 固体,可以在加快反应速率的同时不改变 固体,可以在加快反应速率的同时不改变 的产量 的产量 |
您最近一年使用:0次
名校
解题方法
3 . 下列实验装置不能达到实验目的的是
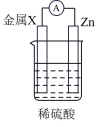 | 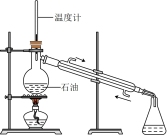 |  | 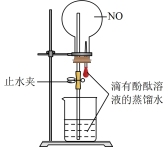 |
| A.比较金属X和Zn的金属活动性强弱 | B.石油的分馏 | C.制取少量乙酸乙酯 | D.喷泉实验 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2022-07-04更新
|
150次组卷
|
3卷引用:黑龙江省牡丹江市第二高级中学2022-2023学年高一下学期7月期末考试化学试题
名校
解题方法
4 . a、b两试管中分别盛装足量等体积、等浓度的稀硫酸溶液,向a、b两试管中加少量等质量的锌粉,同时向b试管中加入少量 固体粉末,让a、b两试管同时开始反应,则产生H2的物质的量随时间变化关系如图所示,其中正确的是
固体粉末,让a、b两试管同时开始反应,则产生H2的物质的量随时间变化关系如图所示,其中正确的是
 固体粉末,让a、b两试管同时开始反应,则产生H2的物质的量随时间变化关系如图所示,其中正确的是
固体粉末,让a、b两试管同时开始反应,则产生H2的物质的量随时间变化关系如图所示,其中正确的是A.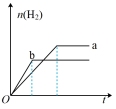 | B.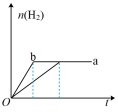 | C.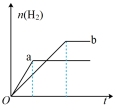 | D.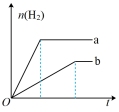 |
您最近一年使用:0次
2022-07-02更新
|
363次组卷
|
7卷引用:黑龙江省鸡西市第四中学2020-2021学年高一下学期期末考试化学试题
黑龙江省鸡西市第四中学2020-2021学年高一下学期期末考试化学试题黑龙江省齐齐哈尔市第八中学2022-2023学年高二上学期开学考试化学试题黑龙江省齐齐哈尔市八校联考2022-2023学年高一下学期期末考试化学试题河南省开封五县2021-2022学年高一下学期期末考试化学试题山西长治上党区第一中学校2021-2022学年高一下学期期末考试化学试题辽宁省朝阳市建平县2021-2022学年高一下学期期末考试化学试题(已下线)重难点01 浓硫酸、浓硝酸的性质与反应计算-【好题汇编】备战2023-2024学年高一化学下学期期末真题分类汇编(人教版2019必修第二册)
名校
解题方法
5 . 理想的碳封存技术应该可以产生电能,而不是消耗能量。一种能够捕捉二氧化碳的原电池的工作原理如图所示。下列有关说法错误的是
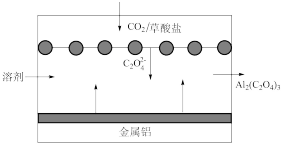

A.金属铝电极发生反应: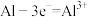 |
B.通入 的一极电极反应式为 的一极电极反应式为 |
C.每得到1mol 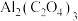 ,电路中转移6mol电子 ,电路中转移6mol电子 |
D.该电池工作过程中,电子由Al经溶剂到 |
您最近一年使用:0次
2022-06-22更新
|
207次组卷
|
3卷引用:黑龙江省哈尔滨市第九中学校2022--2023学年高一下学期6月月考化学试题
名校
解题方法
6 . 纽扣电池可作计算器、电子表等的电源。有一种纽扣电池,其电极分别为Zn和 ,用KOH溶液作电解质溶液,电池的总反应为
,用KOH溶液作电解质溶液,电池的总反应为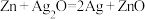 。关于该电池下列叙述不正确的是
。关于该电池下列叙述不正确的是
 ,用KOH溶液作电解质溶液,电池的总反应为
,用KOH溶液作电解质溶液,电池的总反应为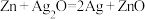 。关于该电池下列叙述不正确的是
。关于该电池下列叙述不正确的是| A.电池的正极发生了还原反应 |
| B.Zn为负极,发生氧化反应,反应的过程中失去电子 |
| C.电池工作时,电解质溶液中的阳离子移向正极 |
| D.电池使用时,电子由Zn极经电解质溶液流向Ag2O极 |
您最近一年使用:0次
2022-06-01更新
|
279次组卷
|
2卷引用:黑龙江省大庆市大庆中学2021-2022学年高一下学期期中考试化学试题
名校
解题方法
7 . 一种检测空气中甲醛(HCHO)含量的电化学传感器的工作原理如图所示。下列说法正确的是
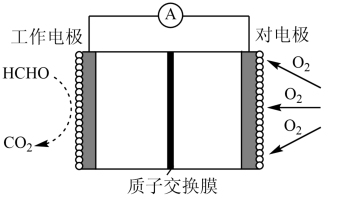

| A.传感器工作时,工作电极电势高 |
| B.工作时H+通过交换膜向工作电极附近移动 |
| C.当导线中通过1.2×10-6mol电子,进入传感器的甲醛为9×10-3mg |
| D.工作时,对电极区电解质溶液的pH减小 |
您最近一年使用:0次
2022-05-25更新
|
200次组卷
|
3卷引用:黑龙江省大庆铁人中学2021-2022学年高一下学期期中考试化学试题
名校
解题方法
8 . 下列关于化学反应速率的说法中,正确的是
| A.用铁片和稀硫酸反应制取氢气时,改用98%的浓硫酸可以加快产生氢气的速率 |
| B.决定化学反应速率的主要因素是反应物的浓度 |
| C.增大压强,一定能加快化学反应速率 |
| D.用锌与稀硫酸反应制H2时,滴加几滴硫酸铜溶液能加快反应速率 |
您最近一年使用:0次
2022-05-22更新
|
391次组卷
|
3卷引用:黑龙江省牡丹江市第三高级中学2021-2022学年高一下学期期末考试化学试题
名校
解题方法
9 . 卤素的单质及其化合物参与的很多反应在研究化学动力学和化学热力学时,都有着重要的意义。元素的 /F-Z图是以元素的不同氧化态(可理解为化合价)Z与对应物种的
/F-Z图是以元素的不同氧化态(可理解为化合价)Z与对应物种的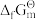 /F在热力学标准态pH=0或pH=14作图。图中任何2种物种连线的斜率在数值上等于相应电对的标准电极电势φA
/F在热力学标准态pH=0或pH=14作图。图中任何2种物种连线的斜率在数值上等于相应电对的标准电极电势φA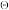 或φB
或φB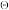 ,A、B分别表示pH=0(实线)或pH=14(虚线)。
,A、B分别表示pH=0(实线)或pH=14(虚线)。
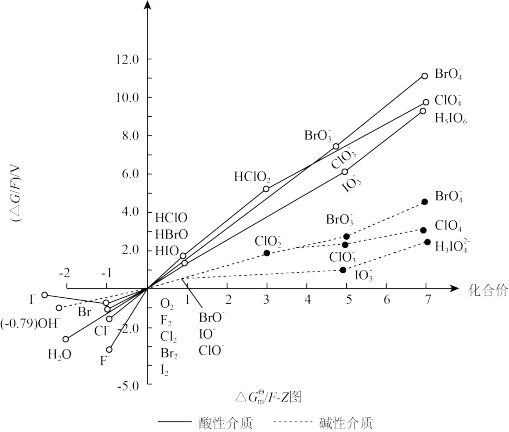
上图中各物种的 /F图的数值如下表所示:
/F图的数值如下表所示:
已知:标准电极电势越大,氧化能力越强。
(1)用上表提供的数据计算φB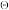 (
(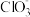 /Cl-)=0.62,则φA
/Cl-)=0.62,则φA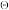 (
(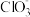 /Cl-)=
/Cl-)=_______ 。
(2)通过计算得出结论:对同一氧化态的卤素,氧化能力比较,含氧酸_______ 含氧酸盐(填“大于”、“等于”或“小于”)
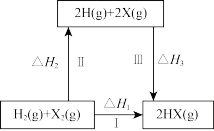
(3)在如图的转化关系中(X代表卤素)。△H1、△H2和△H3三者存在的等式关系为_______ ,卤素单质中(F2、Cl2、Br2、I2)与H2化合最难的是_______ ;试通过电对(X2/X-)的标准电极电势解释原因_______ 。
(4)在起始温度相同(T℃)的条件下,分别向容积相同的密闭容器甲、乙、丙中加入等量NH4I(s),发生反应:①NH4I(s)⇌NH3+HI △H>0,②2HI⇌I2(g)+H2,容器如图所示。

①已知H-H键的键能是436kJ/mol,I-I键的键能是151kJ/mol,H-I键的键能是299kJ/mol,写出反应②的热化学方程式:_______ 。
②甲、乙、丙三个容器中反应均达到平衡时,I2(g)的体积分数由大到小的顺序是_______ 。
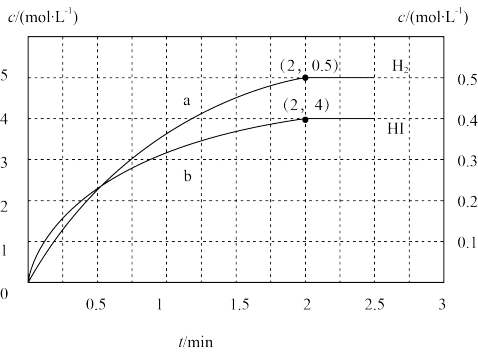
③在反应过程中,测得丙容器中HI、H2的物质的量浓度(c)随时间(t)变化如图所示。0~2min内,用NH3表示的反应速率为_______ ,HI的分解率为_______ 。若平衡时总压强为P,则反应②的平衡常数Kp=_______ 。
 /F-Z图是以元素的不同氧化态(可理解为化合价)Z与对应物种的
/F-Z图是以元素的不同氧化态(可理解为化合价)Z与对应物种的 /F在热力学标准态pH=0或pH=14作图。图中任何2种物种连线的斜率在数值上等于相应电对的标准电极电势φA
/F在热力学标准态pH=0或pH=14作图。图中任何2种物种连线的斜率在数值上等于相应电对的标准电极电势φA 或φB
或φB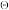 ,A、B分别表示pH=0(实线)或pH=14(虚线)。
,A、B分别表示pH=0(实线)或pH=14(虚线)。
上图中各物种的
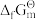 /F图的数值如下表所示:
/F图的数值如下表所示:| A | X- | X2 | HXO | HXO2 |  | 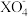 | B | X- | X2 |  | 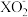 |  |  |
| F | -3.06 | 0 | / | / | / | / | F | -3.06 | 0 | / | / | / | / |
| Cl | -1.36 | 0 | 1.61 | 4.91 | 7.32 | 9.79 | Cl | -1.36 | 0 | 0.40 | 1.72 | 2.38 | 3.18 |
| Br | -1.06 | 0 | 1.60 | / | 7.60 | 11.12 | Br | -1.06 | 0 | 0.45 | / | 2.61 | 4.47 |
| I | -0.54 | 0 | 1.45 | / | 5.97 | 9.27 | I | -0.54 | 0 | 0.45 | / | 1.01 | 2.41 |
已知:标准电极电势越大,氧化能力越强。
(1)用上表提供的数据计算φB
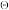 (
(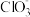 /Cl-)=0.62,则φA
/Cl-)=0.62,则φA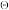 (
(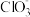 /Cl-)=
/Cl-)=(2)通过计算得出结论:对同一氧化态的卤素,氧化能力比较,含氧酸
(3)在如图的转化关系中(X代表卤素)。△H1、△H2和△H3三者存在的等式关系为

(4)在起始温度相同(T℃)的条件下,分别向容积相同的密闭容器甲、乙、丙中加入等量NH4I(s),发生反应:①NH4I(s)⇌NH3+HI △H>0,②2HI⇌I2(g)+H2,容器如图所示。

①已知H-H键的键能是436kJ/mol,I-I键的键能是151kJ/mol,H-I键的键能是299kJ/mol,写出反应②的热化学方程式:
②甲、乙、丙三个容器中反应均达到平衡时,I2(g)的体积分数由大到小的顺序是
③在反应过程中,测得丙容器中HI、H2的物质的量浓度(c)随时间(t)变化如图所示。0~2min内,用NH3表示的反应速率为

您最近一年使用:0次
名校
解题方法
10 . 请根据化学能和热能、电能相关的知识,问答下列问题:
(1)下列变化中,属于吸热反应的是_______ (填序号)。
①液态水汽化 ② 与固体
与固体 混合 ③浓
混合 ③浓 稀释
稀释
④ ⑤生石灰跟水反应生成熟石灰 ⑥
⑤生石灰跟水反应生成熟石灰 ⑥
(2)已知在101kPa、273K时,1g甲烷 燃烧生成
燃烧生成 和液态水,放出55.6kJ的热量,则甲烷燃烧热的热化学方程式为
和液态水,放出55.6kJ的热量,则甲烷燃烧热的热化学方程式为_______ 。
(3)已知:
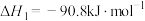



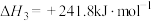
根据上述反应

_______ 
(4)航天技术上使用的氢—氧燃料电池原理可以简单看作下图,则:
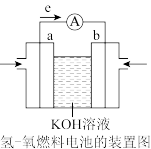
①原电池工作时涉及的能量转化形式是_______ 。
②a极为电池的_______ (填“正极”或“负极”);溶液中 移向
移向_______ 电极(填“a”或“b”);
该氢氧燃料电池的正极反应式为_______ 。
③如把 改为乙醇蒸汽(
改为乙醇蒸汽( ),则负极电极反应式为:
),则负极电极反应式为:_______ 。
(5)某学校化学兴趣小组的同学发现:实验室用稀硫酸和锌粒制取 时,加入几滴硫酸铜溶液,生成氢气的速率明显加快,并且反应结束后容器中有少量红色固体剩余。已知:将氧化还原反应设计成原电池时会加快反应速率,则在本实验中,加入几滴
时,加入几滴硫酸铜溶液,生成氢气的速率明显加快,并且反应结束后容器中有少量红色固体剩余。已知:将氧化还原反应设计成原电池时会加快反应速率,则在本实验中,加入几滴 溶液可以加快生成氢气的速率的原因是
溶液可以加快生成氢气的速率的原因是_______ 。
(6)实验室中现有 、
、 、
、 、
、 等4种溶液,可与上述实验中
等4种溶液,可与上述实验中 溶液起相似作用的是
溶液起相似作用的是_______ 。
(1)下列变化中,属于吸热反应的是
①液态水汽化 ②
 与固体
与固体 混合 ③浓
混合 ③浓 稀释
稀释④
 ⑤生石灰跟水反应生成熟石灰 ⑥
⑤生石灰跟水反应生成熟石灰 ⑥
(2)已知在101kPa、273K时,1g甲烷
 燃烧生成
燃烧生成 和液态水,放出55.6kJ的热量,则甲烷燃烧热的热化学方程式为
和液态水,放出55.6kJ的热量,则甲烷燃烧热的热化学方程式为(3)已知:

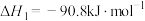



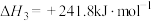
根据上述反应



(4)航天技术上使用的氢—氧燃料电池原理可以简单看作下图,则:

①原电池工作时涉及的能量转化形式是
②a极为电池的
 移向
移向该氢氧燃料电池的正极反应式为
③如把
 改为乙醇蒸汽(
改为乙醇蒸汽( ),则负极电极反应式为:
),则负极电极反应式为:(5)某学校化学兴趣小组的同学发现:实验室用稀硫酸和锌粒制取
 时,加入几滴硫酸铜溶液,生成氢气的速率明显加快,并且反应结束后容器中有少量红色固体剩余。已知:将氧化还原反应设计成原电池时会加快反应速率,则在本实验中,加入几滴
时,加入几滴硫酸铜溶液,生成氢气的速率明显加快,并且反应结束后容器中有少量红色固体剩余。已知:将氧化还原反应设计成原电池时会加快反应速率,则在本实验中,加入几滴 溶液可以加快生成氢气的速率的原因是
溶液可以加快生成氢气的速率的原因是(6)实验室中现有
 、
、 、
、 、
、 等4种溶液,可与上述实验中
等4种溶液,可与上述实验中 溶液起相似作用的是
溶液起相似作用的是
您最近一年使用:0次



