名校
解题方法
1 . 某小组同学利用原电池装置探究物质的性质。
(1)同学们利用下表中装置进行实验并记录。
①同学们认为实验Ⅰ中铁主要发生了析氢腐蚀,其正极反应式是______________ 。
②针对实验Ⅱ现象:甲同学认为不可能发生析氢腐蚀,其判断依据是______________ ;乙同学认为实验Ⅱ中应发生吸氧腐蚀,其正极的电极反应式是___________________ 。
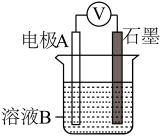
(2)同学们仍用上述装置并用Cu和石墨为电极继续实验,探究实验Ⅱ指针偏转原因及影响O2氧化性的因素。
①丙同学比较实验Ⅱ、Ⅲ、Ⅳ的电压表读数为:c>a>b,请解释原因是__________ 。
②丁同学对Ⅳ、Ⅴ进行比较,其目的是探究________ 对O2氧化性的影响。
③实验Ⅳ中加入Na2SO4溶液的目的是_____________ 。
④为达到丁同学的目的,经讨论,同学们认为应改用下图装置对Ⅳ、Ⅴ重复进行实验,其设计意图是________ ;重复实验时,记录电压表读数依次为c′、d′,且c′>d′,由此得出的结论是______________________________ 。
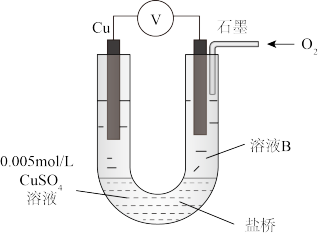
| 资料显示:原电池装置中,负极反应物的还原性越强,或正极反应物的氧化性越强,原电池的电压越大。 |
| 装置 | 编号 | 电极A | 溶液B | 操作及现象 |
 | Ⅰ | Fe | pH=2的H2SO4 | 连接装置后,石墨表面产生无色气泡;电压表指针偏转 |
| Ⅱ | Cu | pH=2的H2SO4 | 连接装置后,石墨表面无明显现象;电压表指针偏转,记录读数为a |
②针对实验Ⅱ现象:甲同学认为不可能发生析氢腐蚀,其判断依据是
(2)同学们仍用上述装置并用Cu和石墨为电极继续实验,探究实验Ⅱ指针偏转原因及影响O2氧化性的因素。
| 编号 | 溶液B | 操作及现象 |
| Ⅲ | 经煮沸的pH=2的 H2SO4 | 溶液表面用煤油覆盖,连接装置后,电压表指针微微偏转,记录读数为b |
| Ⅳ | pH=2的H2SO4 | 在石墨一侧缓慢通入O2并连接装置,电压表指针偏转,记录读数为c;取出电极,向溶液中加入数滴浓Na2SO4溶液混合后,插入电极,保持O2通入,电压表读数仍为c |
| Ⅴ | pH=12的NaOH | 在石墨一侧缓慢通入O2并连接装置,电压表指针偏转,记录读数为d |
②丁同学对Ⅳ、Ⅴ进行比较,其目的是探究
③实验Ⅳ中加入Na2SO4溶液的目的是
④为达到丁同学的目的,经讨论,同学们认为应改用下图装置对Ⅳ、Ⅴ重复进行实验,其设计意图是

您最近一年使用:0次
2018-06-04更新
|
266次组卷
|
7卷引用:2016届北京市东城区高三一模理综化学试卷
解题方法
2 . 资料显示,水溶液中 与
与 发生互促水解生成蓝色沉淀
发生互促水解生成蓝色沉淀 。某小组同学设计实验探究水溶液中
。某小组同学设计实验探究水溶液中 与
与 反应的产物。
反应的产物。
实验记录如下:将 溶液逐滴加入盐酸酸化的
溶液逐滴加入盐酸酸化的 溶液中,溶液蓝色变浅,有白色沉淀生成。
溶液中,溶液蓝色变浅,有白色沉淀生成。
(1) 溶液用盐酸酸化的目的是
溶液用盐酸酸化的目的是___________ 。
(2)查阅资料得知,该白色沉淀是 。写出产生
。写出产生 的离子方程式:
的离子方程式:___________ 。
(3)甲同学认为:要证明 氧化了
氧化了 ,可检验溶液中含有
,可检验溶液中含有 。操作为:取少量上层清液于试管中,
。操作为:取少量上层清液于试管中,___________ (将操作和现象补充完整)。
(4)乙同学认为:溶液中存在 不一定是
不一定是 氧化的,体系中存在的
氧化的,体系中存在的 会干扰实验,于是设计了如下4个装置排除体系中的
会干扰实验,于是设计了如下4个装置排除体系中的 。其中合理的是
。其中合理的是___________ (填字母),仪器a的名称是___________ 。
(5)丙同学认为: 的还原性大
的还原性大 ,也可与盐酸酸化的
,也可与盐酸酸化的 溶液反应生成
溶液反应生成 沉淀,你认为是否合理,如果合理,简述你的实验方案,如果不合理,说明理由:
沉淀,你认为是否合理,如果合理,简述你的实验方案,如果不合理,说明理由:___________ 。
(6)称取沉淀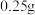 与过量氯化铁溶液反应,待样品完全溶解后,加水
与过量氯化铁溶液反应,待样品完全溶解后,加水 、邻菲啰啉溶液2滴,用
、邻菲啰啉溶液2滴,用 硫酸铈
硫酸铈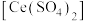 标准溶液滴定,滴定终点时消耗标准溶液
标准溶液滴定,滴定终点时消耗标准溶液 (已知:
(已知:
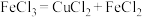 ,
, )。邻菲啰啉溶液的作用是
)。邻菲啰啉溶液的作用是___________ ,沉淀中 的质量分数为
的质量分数为___________ 。
 与
与 发生互促水解生成蓝色沉淀
发生互促水解生成蓝色沉淀 。某小组同学设计实验探究水溶液中
。某小组同学设计实验探究水溶液中 与
与 反应的产物。
反应的产物。实验记录如下:将
 溶液逐滴加入盐酸酸化的
溶液逐滴加入盐酸酸化的 溶液中,溶液蓝色变浅,有白色沉淀生成。
溶液中,溶液蓝色变浅,有白色沉淀生成。(1)
 溶液用盐酸酸化的目的是
溶液用盐酸酸化的目的是(2)查阅资料得知,该白色沉淀是
 。写出产生
。写出产生 的离子方程式:
的离子方程式:(3)甲同学认为:要证明
 氧化了
氧化了 ,可检验溶液中含有
,可检验溶液中含有 。操作为:取少量上层清液于试管中,
。操作为:取少量上层清液于试管中,(4)乙同学认为:溶液中存在
 不一定是
不一定是 氧化的,体系中存在的
氧化的,体系中存在的 会干扰实验,于是设计了如下4个装置排除体系中的
会干扰实验,于是设计了如下4个装置排除体系中的 。其中合理的是
。其中合理的是
(5)丙同学认为:
 的还原性大
的还原性大 ,也可与盐酸酸化的
,也可与盐酸酸化的 溶液反应生成
溶液反应生成 沉淀,你认为是否合理,如果合理,简述你的实验方案,如果不合理,说明理由:
沉淀,你认为是否合理,如果合理,简述你的实验方案,如果不合理,说明理由:(6)称取沉淀
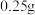 与过量氯化铁溶液反应,待样品完全溶解后,加水
与过量氯化铁溶液反应,待样品完全溶解后,加水 、邻菲啰啉溶液2滴,用
、邻菲啰啉溶液2滴,用 硫酸铈
硫酸铈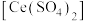 标准溶液滴定,滴定终点时消耗标准溶液
标准溶液滴定,滴定终点时消耗标准溶液 (已知:
(已知:
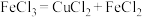 ,
, )。邻菲啰啉溶液的作用是
)。邻菲啰啉溶液的作用是 的质量分数为
的质量分数为
您最近一年使用:0次
解题方法
3 . 某小组研究Cu2+和Fe3+的氧化性,进行如下实验。
实验Ⅰ: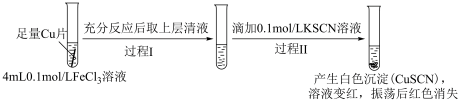
已知:1.(SCN)2 是黄色液体,氧化性:I2 < (SCN)2 < Br2。
2.K3[Fe(CN)6]溶液可用于Fe2+的检验,生成蓝色沉淀。
3.Fe3+与SCN-可以形成多种微粒,例如[Fe(SCN)]2+、Fe(SCN)3等溶液显红色。
(1)实验Ⅰ过程Ⅰ中Cu与FeCl3反应的化学方程式是___________ 。
(2)实验Ⅰ过程Ⅱ中溶液变红,说明产生了Fe3+,分析可能原因。
假设①:Fe2+被Cu2+氧化。
过程Ⅱ发生反应的电极反应式:
a.氧化反应:Fe2+-e-+3SCN-=Fe(SCN)3
b.还原反应:___________ 。
假设②:Cu2+和SCN-发生反应生成(SCN)2,进而将清液中的Fe2+氧化为Fe3+。
设计实验Ⅱ证实假设。
实验Ⅱ:
i.
___________ 。
ⅱ.实验Ⅱ中过程Ⅱ的离子方程式为___________ 。
(3)设计实验进一步研究Fe3+能否氧化SCN-。
实验Ⅲ:
①实验Ⅲ中加入K3[Fe(CN)6]溶液后,若___________ (写出实验现象),
说明在该实验条件下,Fe3+未能氧化SCN-。
②进一步查阅资料发现:Fe3+与SCN-可以发生氧化还原反应。该小组通过实验证明了该反应的发生。请你在答题卡方框中用文字或图示 设计实验方案,并描述相关的实验现象:___________ 。
实验Ⅰ:

已知:1.(SCN)2 是黄色液体,氧化性:I2 < (SCN)2 < Br2。
2.K3[Fe(CN)6]溶液可用于Fe2+的检验,生成蓝色沉淀。
3.Fe3+与SCN-可以形成多种微粒,例如[Fe(SCN)]2+、Fe(SCN)3等溶液显红色。
(1)实验Ⅰ过程Ⅰ中Cu与FeCl3反应的化学方程式是
(2)实验Ⅰ过程Ⅱ中溶液变红,说明产生了Fe3+,分析可能原因。
假设①:Fe2+被Cu2+氧化。
过程Ⅱ发生反应的电极反应式:
a.氧化反应:Fe2+-e-+3SCN-=Fe(SCN)3
b.还原反应:
假设②:Cu2+和SCN-发生反应生成(SCN)2,进而将清液中的Fe2+氧化为Fe3+。
设计实验Ⅱ证实假设。
实验Ⅱ:

i.

ⅱ.实验Ⅱ中过程Ⅱ的离子方程式为
(3)设计实验进一步研究Fe3+能否氧化SCN-。
实验Ⅲ:

①实验Ⅲ中加入K3[Fe(CN)6]溶液后,若
说明在该实验条件下,Fe3+未能氧化SCN-。
②进一步查阅资料发现:Fe3+与SCN-可以发生氧化还原反应。该小组通过实验证明了该反应的发生。请你在
您最近一年使用:0次
名校
解题方法
4 . 砷及其化合物是实验研究热点物质。某小组开展对砷的化学物研究。
实验1:资料显示,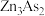 可与稀硫酸反应生成
可与稀硫酸反应生成 。设计如图装置探究
。设计如图装置探究 的性质(反应开始前,向装置中通入氦气,一段时间后,关闭弹簧夹K)。
的性质(反应开始前,向装置中通入氦气,一段时间后,关闭弹簧夹K)。
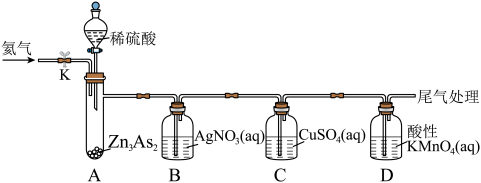
(1)A装置中盛装稀硫酸的仪器名称是___________ 。B装置中发生氧化还原反应,生成一种由过滤元素组成的黑色固体单质,该固体单质的化学式为___________ 。
(2)已知:C装置中反应生成砷化亚铜固体、一种常见的最高价含氧酸和一种固体单质,则该反应的化学方程式为___________ 。
(3)D装置中溶液由紫红色变为无色,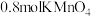 恰好氧化
恰好氧化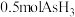 ,则氧化产物中砷元素的化合价为
,则氧化产物中砷元素的化合价为___________ 。
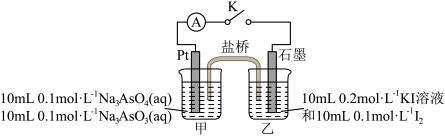
实验2:查阅资料发现, 和
和 的氧化性差异不大。推测在一定条件下
的氧化性差异不大。推测在一定条件下 和
和 反应可能是可逆反应。用如图所示装置进行探究。连接装置(盐桥中的物质不参与反应),进行下表中实验操作并记录电流表读数。
反应可能是可逆反应。用如图所示装置进行探究。连接装置(盐桥中的物质不参与反应),进行下表中实验操作并记录电流表读数。
(4)根据步骤Ⅲ中电流表读数 ,可以确定上述反应是可逆反应,则读数
,可以确定上述反应是可逆反应,则读数
___________ 0(填“>”或“<”)。请具体说明如何根据电流表读数 可判断此反应是可逆反应:
可判断此反应是可逆反应:___________ 。
(5)根据上述探究, 和
和 能否发生反应与
能否发生反应与___________ 有关(填序号)。
①浓度 ②温度 ③pH ④催化剂
向甲烧杯中滴加稀硫酸后,装置中发生的总反应的离子方程式为___________ 。
实验1:资料显示,
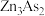 可与稀硫酸反应生成
可与稀硫酸反应生成 。设计如图装置探究
。设计如图装置探究 的性质(反应开始前,向装置中通入氦气,一段时间后,关闭弹簧夹K)。
的性质(反应开始前,向装置中通入氦气,一段时间后,关闭弹簧夹K)。
(1)A装置中盛装稀硫酸的仪器名称是
(2)已知:C装置中反应生成砷化亚铜固体、一种常见的最高价含氧酸和一种固体单质,则该反应的化学方程式为
(3)D装置中溶液由紫红色变为无色,
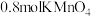 恰好氧化
恰好氧化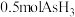 ,则氧化产物中砷元素的化合价为
,则氧化产物中砷元素的化合价为实验2:查阅资料发现,
 和
和 的氧化性差异不大。推测在一定条件下
的氧化性差异不大。推测在一定条件下 和
和 反应可能是可逆反应。用如图所示装置进行探究。连接装置(盐桥中的物质不参与反应),进行下表中实验操作并记录电流表读数。
反应可能是可逆反应。用如图所示装置进行探究。连接装置(盐桥中的物质不参与反应),进行下表中实验操作并记录电流表读数。
| 序号 | 实验步骤 | 电流表读数(A) |
| Ⅰ | 按图2所示连接装置并加入药品,闭合开关K。向甲烧杯中滴加浓NaOH溶液,电流表指针偏转,乙烧杯中溶液颜色变浅,读出电流表读数为 |  |
| Ⅱ | 充分反应一段时间后,读出电流表读数为 | 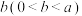 |
| Ⅲ | 当电流表读数为0时,向甲烧杯中缓缓加入稀硫酸,读出电流表读数为 |  |
 ,可以确定上述反应是可逆反应,则读数
,可以确定上述反应是可逆反应,则读数
 可判断此反应是可逆反应:
可判断此反应是可逆反应:(5)根据上述探究,
 和
和 能否发生反应与
能否发生反应与①浓度 ②温度 ③pH ④催化剂
向甲烧杯中滴加稀硫酸后,装置中发生的总反应的离子方程式为
您最近一年使用:0次
2023-10-09更新
|
123次组卷
|
2卷引用:江西省大余中学2023-2024学年高三上学期10月月考化学试题
名校
解题方法
5 . 某实验小组学生为探究氧化性: Br2 > Fe3+ > I2,设计下列实验方案。
【查阅资料】电极电势如下表:(已知:电极电势越高,氧化性越强)
(1)FeCl3溶液的配制:取FeCl3固体溶于___________ ,再稀释至指定浓度。配制250mL 0.1mol/L FeCl3溶液,需5.0 mol/L FeCl3溶液的体积为___________ mL,配制过程,图中不需要使用的仪器有___________ (填仪器名称)。

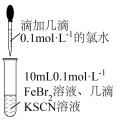
(2)利用FeBr2和氯水,设计实验证明氧化性:Br2 > Fe3+,实验如图所示,实验过程中,能证明氧化性:Br2 > Fe3+的现象是___________ 。
(3)利用0.1mol/L的FeCl3溶液和0.1mol/L的 溶液,不用任何试剂证明氧化性:Fe3+ > I2,FeCl3溶液和碘水颜色相近,设计的实验装置如图,实验过程中,电流计指针偏转,说明反应发生。
溶液,不用任何试剂证明氧化性:Fe3+ > I2,FeCl3溶液和碘水颜色相近,设计的实验装置如图,实验过程中,电流计指针偏转,说明反应发生。
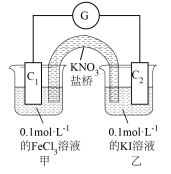
①通过外电路中电子流向:___________ (用C1、C2和→表示),可证明氧化性: 。
。
②也可通过甲池中颜色变化证明,甲池中颜色变化为___________ 。
(4)化学能可转化为电能,写出其在生活中常见的一种应用___________ 。
【查阅资料】电极电势如下表:(已知:电极电势越高,氧化性越强)
| 氧化还原电对(氧化型/还原型) | 电极反应式(氧化型+ne-=还原型) | 电极电势(E0/V) |
| Fe3+ +/ Fe2 | Fe3+ + e- = Fe2+ | 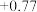 |
| I2 /I- | I2 + 2e- = 2I- | 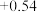 |
| Br2 /Br- | Br2 + 2e- = 2 Br- | 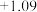 |

(2)利用FeBr2和氯水,设计实验证明氧化性:Br2 > Fe3+,实验如图所示,实验过程中,能证明氧化性:Br2 > Fe3+的现象是

(3)利用0.1mol/L的FeCl3溶液和0.1mol/L的
 溶液,不用任何试剂证明氧化性:Fe3+ > I2,FeCl3溶液和碘水颜色相近,设计的实验装置如图,实验过程中,电流计指针偏转,说明反应发生。
溶液,不用任何试剂证明氧化性:Fe3+ > I2,FeCl3溶液和碘水颜色相近,设计的实验装置如图,实验过程中,电流计指针偏转,说明反应发生。
①通过外电路中电子流向:
 。
。②也可通过甲池中颜色变化证明,甲池中颜色变化为
(4)化学能可转化为电能,写出其在生活中常见的一种应用
您最近一年使用:0次
6 . 某小组设计实验探究重铬酸铵[(NH4)2Cr2O7]的部分性质:资料显示:
①(NH4)2Cr2O7呈橙红色,Cr2O3呈绿色,Cr3+呈绿色。
②Mg3N2遇水蒸气剧烈反应生成NH3。
(1)探究重铬酸铵分解产物是否有NH3(装置如图1所示)。
B中倒置的干燥管作用是_____________________ 。实验中,没有观察到B中颜色发生变化,实验结论是_________________________________ 。
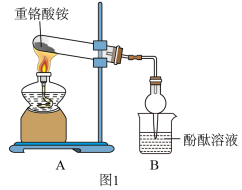
(2)探究(NH4)2Cr2O7 N2↑+Cr2O3+4H2O的真实性(如下
N2↑+Cr2O3+4H2O的真实性(如下装置可以重复使用 ):
①气流从左至右,装置连接顺序D、________________________________ 。
②点燃E处酒精灯之前,先通入一段时间CO2,其目的是_______________ 能证明有水生成的实验现象是_________________ 。
③能说明D中分解反应已发生的实验依据是_______________ 。
④设计实验证明重铬酸铵分解生成了N2:取反应后E中残留固体于试管,滴加蒸馏水,____ 。
(3)探究(NH4)2Cr2O7的氧化性(按如图2装置进行实验)。为了探究(NH4)2Cr2O7与Na2S反应的氧化产物是否是SO42-,设计如下方案。连接K,观察到左烧杯中溶液由橙色逐渐变成绿色,电流计指针有明显偏转。实验完毕后,向右烧杯滴加BaCl2溶液,产生白色沉淀。
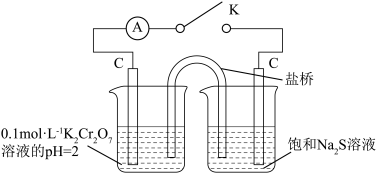
图2中负极的电极反应式为________________________ (不考虑后续反应)。
①(NH4)2Cr2O7呈橙红色,Cr2O3呈绿色,Cr3+呈绿色。
②Mg3N2遇水蒸气剧烈反应生成NH3。
(1)探究重铬酸铵分解产物是否有NH3(装置如图1所示)。

B中倒置的干燥管作用是
(2)探究(NH4)2Cr2O7
 N2↑+Cr2O3+4H2O的真实性(如下
N2↑+Cr2O3+4H2O的真实性(如下
①气流从左至右,装置连接顺序D、
②点燃E处酒精灯之前,先通入一段时间CO2,其目的是
③能说明D中分解反应已发生的实验依据是
④设计实验证明重铬酸铵分解生成了N2:取反应后E中残留固体于试管,滴加蒸馏水,
(3)探究(NH4)2Cr2O7的氧化性(按如图2装置进行实验)。为了探究(NH4)2Cr2O7与Na2S反应的氧化产物是否是SO42-,设计如下方案。连接K,观察到左烧杯中溶液由橙色逐渐变成绿色,电流计指针有明显偏转。实验完毕后,向右烧杯滴加BaCl2溶液,产生白色沉淀。

图2中负极的电极反应式为
您最近一年使用:0次
7 . 某小组研究Na2S 溶液与KMnO4溶液反应,探究过程如下。
资料:i. 在强酸性条件下被还原为Mn2+,在近中性条件下被还原为
在强酸性条件下被还原为Mn2+,在近中性条件下被还原为 。
。
ii.单质硫可溶于硫化钠溶液,溶液呈淡黄色。
(1)根据实验可知,Na2S具有_______ 性。
(2)甲同学预测实验I中S2-被氧化成 。
。
①根据实验现象,乙同学认为甲的预测不合理,理由是_______ 。
②乙同学取实验I中少量溶液进行实验,检测到有 ,得出S2-被氧化成
,得出S2-被氧化成 的结论,丙同学否定了该结论,理由是
的结论,丙同学否定了该结论,理由是_______ 。
③同学们经讨论后,设计了如下实验,证实该条件下 的确可以将S2-氧化成
的确可以将S2-氧化成 。
。
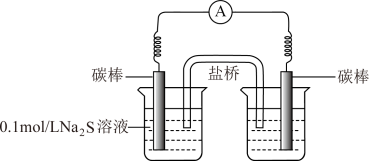
a.右侧烧杯中的溶液是_______ 。
b.连通后电流计指针偏转,一段时间后,_______ (填操作和现象)。
(3)实验I的现象与资料ⅰ存在差异,其原因是新生成的产物(Mn2+)与过量的反应物( )发生反应,该反应的离子方程式是
)发生反应,该反应的离子方程式是_______ 。
(4)实验II的现象与资料也不完全相符,丁同学猜想其原因与(3)相似,经验证猜想成立,他的实验方案是_______ 。
(5)反思该实验,反应物相同,而现象不同,体现了物质变化不仅与其自身的性质有关,还与_______ 因素有关。
| 实验序号 | I | II |
| 实验过程 | 加10滴(约0.3mL)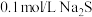 溶液 溶液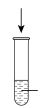 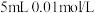 酸性KMnO4溶液( 酸性KMnO4溶液( 酸化至 酸化至 ) ) | 滴加10滴约(0.3mL)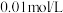 酸性KMnO4溶液( 酸性KMnO4溶液( 酸化至 酸化至 ) )  溶液 溶液 |
| 实验现象 | 紫色变浅( ),生成棕褐色沉淀( ),生成棕褐色沉淀( ) ) | 溶液呈淡黄色( ),生成浅粉色沉淀( ),生成浅粉色沉淀( ) ) |
 在强酸性条件下被还原为Mn2+,在近中性条件下被还原为
在强酸性条件下被还原为Mn2+,在近中性条件下被还原为 。
。ii.单质硫可溶于硫化钠溶液,溶液呈淡黄色。
(1)根据实验可知,Na2S具有
(2)甲同学预测实验I中S2-被氧化成
 。
。 ①根据实验现象,乙同学认为甲的预测不合理,理由是
②乙同学取实验I中少量溶液进行实验,检测到有
 ,得出S2-被氧化成
,得出S2-被氧化成 的结论,丙同学否定了该结论,理由是
的结论,丙同学否定了该结论,理由是③同学们经讨论后,设计了如下实验,证实该条件下
 的确可以将S2-氧化成
的确可以将S2-氧化成 。
。
a.右侧烧杯中的溶液是
b.连通后电流计指针偏转,一段时间后,
(3)实验I的现象与资料ⅰ存在差异,其原因是新生成的产物(Mn2+)与过量的反应物(
 )发生反应,该反应的离子方程式是
)发生反应,该反应的离子方程式是(4)实验II的现象与资料也不完全相符,丁同学猜想其原因与(3)相似,经验证猜想成立,他的实验方案是
(5)反思该实验,反应物相同,而现象不同,体现了物质变化不仅与其自身的性质有关,还与
您最近一年使用:0次
名校
解题方法
8 . 当电解质中某离子的浓度越大时,其氧化性或还原性越强。利用这一性质,有人设计出如图所示“浓差电池”(其电动势取决于物质的浓度差,是由一种物质从高浓度向低浓度转移而产生的)。实验开始先断开K1,闭合K2,发现电流计指针发生偏转。下列说法错误的是
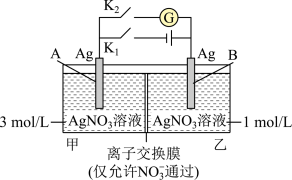

| A.断开K1、闭合K2,一段时间后电流计指针归零,此时两池Ag+浓度相等 |
| B.断开K1、闭合K2,当转移0.1mol e-时,乙池溶液质量增加17.0 g |
| C.当电流计指针归零后,断开K2、闭合K1,一段时间后B电极的质量增加 |
| D.当电流计指针归零后,断开K2、闭合K1,乙池溶液浓度增大 |
您最近一年使用:0次
2020-06-20更新
|
415次组卷
|
2卷引用:河北省石家庄市2020届高中毕业班综合训练(二)理综化学试题
解题方法
9 . ORP传感器(如下图)测定物质的氧化性的原理:将Pt电极插入待测溶液中,Pt电极、Ag/AgCl电极与待测溶液组成原电池,测得的电压越高,溶液的氧化性越强。向NaIO3溶液、FeCl3溶液中分别滴加2滴H2SO4溶液,测得前者的电压增大,后者的几乎不变。
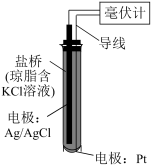
下列说法不正确 的是

下列说法
| A.盐桥中的Cl-移向Ag/AgCl电极 |
| B.Ag/AgCl电极反应是Ag-e-+Cl-=AgCl |
C.酸性越强, 的氧化性越强 的氧化性越强 |
| D.向FeCl3溶液中滴加浓NaOH溶液至碱性,测得电压几乎不变 |
您最近一年使用:0次
名校
解题方法
10 . 下列实验方案的设计能达到相应实验目的的是
| 选项 | 实验目的 | 实验方案 |
| A | 验证Cl2的氧化性强于Br2 | 向FeBr2溶液中通入少量Cl2 |
| B | 比较HF与HClO的酸性强弱 | 常温下,用pH计分别测定浓度为0.1 mol/L的NaF溶液和NaClO溶液的pH |
| C | 验证FeCl3与KI的反应是可逆反应 | 向1 mL0.1 mol/L FeCl3的溶液中滴加5 mL0.1mol/LKI溶液,充分反应后,取少量混合液滴加淀粉溶液 |
| D | 比较Fe与Cu的金属活动性 | 常温下,将Fe、Cu与浓硝酸组成原电池 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次



