1 . FeSO4溶液放置在空气中容易变质,因此为了方便使用Fe2+,实验室中常保存硫酸亚铁铵晶体[俗称“摩尔盐”,化学式为(NH4)2Fe(SO4)2•6H2O],它比绿矾或绿矾溶液更稳定。
I.某兴趣小组设计实验制备硫酸亚铁铵晶体。
本实验中,配制溶液以及后续使用到的蒸馏水都经过煮沸、冷却后再使用。向FeSO4溶液中加入饱和(NH4)2SO4溶液,经过操作_______ 、冷却结晶、过滤、洗涤和干燥后得到一种浅蓝绿色的晶体。
II.实验探究影响溶液中Fe2+稳定性的因素
(1)配制0.8 mol/L的FeSO4溶液(pH=4.5)和0.8 mol/L的(NH4)2Fe(SO4)2溶液(pH=4.0),各取2 mL上述溶液于两支试管中,刚开始两种溶液都是浅绿色,分别同时滴加2滴0.01mol/L的KSCN溶液,15min后观察可见:(NH4)2Fe(SO4)2溶液仍然为浅绿色透明澄清溶液,FeSO4溶液则出现淡黄色浑浊。
【资料1】
①请用离子方程式解释FeSO4溶液产生淡黄色浑浊的原因___________________ 。
②讨论影响Fe2+稳定性的因素,小组同学提出以下3种假设:
假设1:其他条件相同时,NH4+的存在使(NH4)2Fe(SO4)2溶液中Fe2+稳定性较好。
假设2:其他条件相同时,在一定 pH范围内,溶液 pH越小Fe2+稳定性越好。
假设3:__________________________________________________ 。
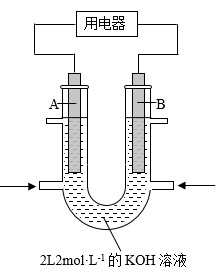
(2)小组同学用如图装置(G为灵敏电流计),滴入适量的硫酸溶液分别控制溶液A(0.2 mol/L NaCl)和溶液B(0.1mol/L FeSO4)为不同的 pH,观察记录电流计读数,对假设2进行实验研究,实验结果如下表所示。
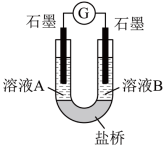
【资料2】原电池装置中,其他条件相同时,负极反应物的还原性越强或正极反应物的氧化性越强,该原电池的电流越大。
【资料3】常温下,0.1mol/LpH=1的FeSO4溶液比pH=5的FeSO4溶液稳定性更好。
根据以上实验结果和资料信息,经小组讨论可以得出以下结论:
①U型管中左池的电极反应式_________________ 。
②对比实验1和2(或3和4),在一定pH范围内,可得出的结论为______ 。
③对比实验_____ 和_____ 还可得出在一定 pH范围内,溶液酸碱性变化是对O2氧化性强弱的影响因素。
④对【资料3】实验事实的解释为____________________ 。
I.某兴趣小组设计实验制备硫酸亚铁铵晶体。
本实验中,配制溶液以及后续使用到的蒸馏水都经过煮沸、冷却后再使用。向FeSO4溶液中加入饱和(NH4)2SO4溶液,经过操作
II.实验探究影响溶液中Fe2+稳定性的因素
(1)配制0.8 mol/L的FeSO4溶液(pH=4.5)和0.8 mol/L的(NH4)2Fe(SO4)2溶液(pH=4.0),各取2 mL上述溶液于两支试管中,刚开始两种溶液都是浅绿色,分别同时滴加2滴0.01mol/L的KSCN溶液,15min后观察可见:(NH4)2Fe(SO4)2溶液仍然为浅绿色透明澄清溶液,FeSO4溶液则出现淡黄色浑浊。
【资料1】
| 沉淀 | Fe(OH)2 | Fe(OH)3 |
| 开始沉淀 pH | 7.6 | 2.7 |
| 完全沉淀 pH | 9.6 | 3.7 |
②讨论影响Fe2+稳定性的因素,小组同学提出以下3种假设:
假设1:其他条件相同时,NH4+的存在使(NH4)2Fe(SO4)2溶液中Fe2+稳定性较好。
假设2:其他条件相同时,在一定 pH范围内,溶液 pH越小Fe2+稳定性越好。
假设3:
(2)小组同学用如图装置(G为灵敏电流计),滴入适量的硫酸溶液分别控制溶液A(0.2 mol/L NaCl)和溶液B(0.1mol/L FeSO4)为不同的 pH,观察记录电流计读数,对假设2进行实验研究,实验结果如下表所示。
| 序号 | A 0.2mol/LNaCl | B 0.1mol/LFeSO4 | 电流计读数 |
| 实验1 | pH=1 | pH=5 | 8.4 |
| 实验2 | pH=1 | pH=1 | 6.5 |
| 实验3 | pH=6 | pH=5 | 7.8 |
| 实验4 | pH=6 | pH=1 | 5.5 |

【资料2】原电池装置中,其他条件相同时,负极反应物的还原性越强或正极反应物的氧化性越强,该原电池的电流越大。
【资料3】常温下,0.1mol/LpH=1的FeSO4溶液比pH=5的FeSO4溶液稳定性更好。
根据以上实验结果和资料信息,经小组讨论可以得出以下结论:
①U型管中左池的电极反应式
②对比实验1和2(或3和4),在一定pH范围内,可得出的结论为
③对比实验
④对【资料3】实验事实的解释为
您最近一年使用:0次
2020-04-02更新
|
344次组卷
|
4卷引用:江苏省昆山中学2022-2023学年高一下学期期中考试化学试题
江苏省昆山中学2022-2023学年高一下学期期中考试化学试题北京市门头沟区2020届高三3月综合练习化学试题山东省2020届高三模拟考试化学试题(已下线)北京市2019-2020学年高三各区一模化学考试分类汇编:科学探究
名校
解题方法
2 . 当电解质中某离子的浓度越大时,其氧化性或还原性越强。利用这一性质,有人设计出如图所示“浓差电池”(其电动势取决于物质的浓度差,是由一种物质从高浓度向低浓度转移而产生的)。实验开始先断开K1,闭合K2,发现电流计指针发生偏转。下列说法错误的是
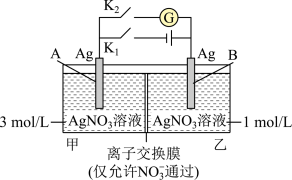

| A.断开K1、闭合K2,一段时间后电流计指针归零,此时两池Ag+浓度相等 |
| B.断开K1、闭合K2,当转移0.1mol e-时,乙池溶液质量增加17.0 g |
| C.当电流计指针归零后,断开K2、闭合K1,一段时间后B电极的质量增加 |
| D.当电流计指针归零后,断开K2、闭合K1,乙池溶液浓度增大 |
您最近一年使用:0次
2020-06-20更新
|
415次组卷
|
2卷引用:吉林省长春市第一中学2019-2020学年高一下学期月考化学试题
名校
3 . 相同条件下,草酸根(C2O )的还原性强于Fe2+。为检验这一结论,进行以下实验:
)的还原性强于Fe2+。为检验这一结论,进行以下实验:
资料:i.工业上,向炽热铁屑中通入氯化氢生产无水氯化亚铁。
ii.K3[Fe(C2O4)3]・3H2O(三草酸合铁酸钾)为亮绿色晶体,光照易分解。其水溶液中存在[Fe(C2O4)3]3- Fe3++3C2O
Fe3++3C2O K=6.3×10-21
K=6.3×10-21
(实验1)用以下装置制取无水氯化亚铁

(1)仪器a的名称为___________ ,B的作用为___________ 。
(2)欲制得纯净的FeCl2,实验过程中点燃A、C酒精灯的先后顺序是___________ 。
(3)D中用NaOH溶液进行尾气处理,存在的问题是___________ 、___________ 。
(实验2)通过Fe3+和C2O 在溶液中的反应比较Fe2+和C2O
在溶液中的反应比较Fe2+和C2O 的还原性强弱。
的还原性强弱。
(4)取实验2中少量晶体洗净,配成溶液,滴加KSCN溶液,不变红。继续加入硫酸,溶液变红,说明晶体中含有+3价的铁元素。加硫酸后溶液变红的原因是___________ 。
(5)经检验,亮绿色晶体为K3Fe(C2O4)3・3H2O。设计实验,确认实验2中没有发生氧化还原反应的操作和现象是___________ 。
(6)取实验2中的亮绿色溶液光照一段时间,产生黄色浑浊且有气泡产生。补全反应的离子方程式:___________ [Fe(C2O4)3]3-
___________ FeC2O4↓+___________ ↑+___________
(实验3)又设计以下装置直接比较Fe2+和C2O 的还原性强弱,并达到了预期的目的。
的还原性强弱,并达到了预期的目的。
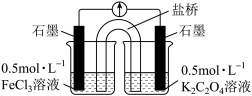
(7)描述达到预期目的可能产生的现象:___________ 。
 )的还原性强于Fe2+。为检验这一结论,进行以下实验:
)的还原性强于Fe2+。为检验这一结论,进行以下实验:资料:i.工业上,向炽热铁屑中通入氯化氢生产无水氯化亚铁。
ii.K3[Fe(C2O4)3]・3H2O(三草酸合铁酸钾)为亮绿色晶体,光照易分解。其水溶液中存在[Fe(C2O4)3]3-
 Fe3++3C2O
Fe3++3C2O K=6.3×10-21
K=6.3×10-21(实验1)用以下装置制取无水氯化亚铁

(1)仪器a的名称为
(2)欲制得纯净的FeCl2,实验过程中点燃A、C酒精灯的先后顺序是
(3)D中用NaOH溶液进行尾气处理,存在的问题是
(实验2)通过Fe3+和C2O
 在溶液中的反应比较Fe2+和C2O
在溶液中的反应比较Fe2+和C2O 的还原性强弱。
的还原性强弱。操作 | 现象 |
| 在避光处,向10mL 0.5 mol·L-1FeCl3溶液中缓慢加入0.5 mol·L-1K2C2O4溶液至过量,搅拌,充分反应后,冰水浴冷却,过滤 | 得到亮绿色溶液和亮绿色晶体 |
(5)经检验,亮绿色晶体为K3Fe(C2O4)3・3H2O。设计实验,确认实验2中没有发生氧化还原反应的操作和现象是
(6)取实验2中的亮绿色溶液光照一段时间,产生黄色浑浊且有气泡产生。补全反应的离子方程式:

(实验3)又设计以下装置直接比较Fe2+和C2O
 的还原性强弱,并达到了预期的目的。
的还原性强弱,并达到了预期的目的。
(7)描述达到预期目的可能产生的现象:
您最近一年使用:0次
2020-12-11更新
|
1228次组卷
|
4卷引用:重庆南开中学2021-2022学年高一下学期4月第一次月考化学试题
重庆南开中学2021-2022学年高一下学期4月第一次月考化学试题黑龙江省哈尔滨市第三中学2021届高三上学期第四次验收考试化学试题(已下线)培优01 无机制备类实验 基础训练-2021年高考化学大题培优练(新高考地区专用)黑龙江省哈尔滨市第九中学2021届高三上学期第四次验收化学试卷
4 . 下列实验装置能达到实验目的的是
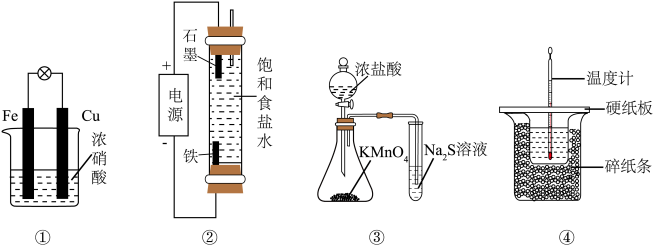
| A.装置①验证Fe和Cu的还原性强弱 | B.装置②制备少量NaClO |
C.装置③比较 、 、 和S的氧化性 和S的氧化性 | D.装置④测定中和反应的反应热 |
您最近一年使用:0次
解题方法
5 . 能量转化是化学变化的主要特征之一,按要求回答下列问题。
(1)页岩气是从页岩层中开采出来的天然气,成分以甲烷为主,页岩气的资源潜力可能大于常规天然气。下列有关页岩气的叙述错误的是_______(填序号)。
(2)有关的电池装置如下:
①上述四种电池中,属于二次电池的是_______ (填序号,下同),属于干电池的是_______ 。
②a装置中,外电路中电子的流向是_______ (填“从Zn流向Cu”或“从Cu流向Zn”)。
③c装置中,若电解质改为碱性介质,则负极的电极反应式为_______ 。
(3)氧化还原反应一般可以设计成原电池。若将反应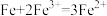 设计成原电池,则:
设计成原电池,则:
①该电池的电解质溶液可以是_______ 。
②当外电路中转移1mol e-时,电解质溶液增加的质量是_______ g。
(1)页岩气是从页岩层中开采出来的天然气,成分以甲烷为主,页岩气的资源潜力可能大于常规天然气。下列有关页岩气的叙述错误的是_______(填序号)。
| A.页岩气属于新能源 |
| B.页岩气和氧气的反应是放热反应 |
| C.甲烷中每个原子的最外层电子排布都达到8电子稳定结构 |
| D.页岩气可以作燃料电池的负极燃料 |
| 电池装置 | 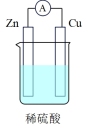 | 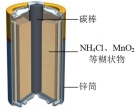 | 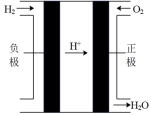 | 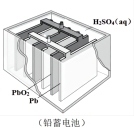 |
| 编号 | a | b | c | d |
①上述四种电池中,属于二次电池的是
②a装置中,外电路中电子的流向是
③c装置中,若电解质改为碱性介质,则负极的电极反应式为
(3)氧化还原反应一般可以设计成原电池。若将反应
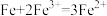 设计成原电池,则:
设计成原电池,则:①该电池的电解质溶液可以是
②当外电路中转移1mol e-时,电解质溶液增加的质量是
您最近一年使用:0次
名校
6 . 几种离子在水溶液中有如下转化关系。下列说法正确的是


A.该条件下的氧化性: |
B.反应(1)中,每生成 ,转移3mol电子 ,转移3mol电子 |
C.将反应(2)设计成原电池, 向负极迁移 向负极迁移 |
D. 与 与 反应生成 反应生成 和 和 时,氧化剂与还原剂的物质的量之比为1∶2 时,氧化剂与还原剂的物质的量之比为1∶2 |
您最近一年使用:0次
2022-03-06更新
|
1066次组卷
|
8卷引用:广东省广州市第十六中学2021-2022学年高一下学期期中检测 化学试题
广东省广州市第十六中学2021-2022学年高一下学期期中检测 化学试题广东省江门市新会第一中学2022-2023学年高一下学期3月月考化学试题(已下线)【2023】【高一下】【其他】【余高2】【高中化学】【刘尼尼收集】河北省秦皇岛市青龙满族自治县 2021-2022学年高三下学期月考化学试题(已下线)秘籍12 原电池原理及应用-备战2022年高考化学抢分秘籍(全国通用)(已下线)专题04 氧化还原反应-三年(2020-2022)高考真题分项汇编(已下线)专题04 氧化还原反应-2022年高考真题模拟题分项汇编(已下线)微专题08 氧化性和还原性强弱的实验探究及应用-备战2023年高考化学一轮复习考点微专题
名校
解题方法
7 . 以菱铁矿(主要成分是碳酸亚铁 )为原料制取铁的流程如图:
)为原料制取铁的流程如图:
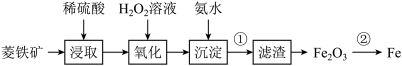
(1)“浸取”时通常将菱铁矿石进行粉碎,其目的_______ ;
(2)“氧化”时发生反应的离子方程式:_______ ;
(3)“沉淀”时发生反应的离子方程式:_______ ;
(4)现有如下两个反应:①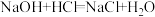 ②
②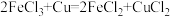 。根据两反应本质,判断能设计成原电池的反应是
。根据两反应本质,判断能设计成原电池的反应是_______ (填序号)。该电池的正极材料是_______ 。
(5)锌锰干电池是最早使用的化学电池,其基本构造如图1所示:电路中每通过 ,负极质量减少
,负极质量减少_______ g;工作时 在正极放电产生两种气体,其中一种气体分子是
在正极放电产生两种气体,其中一种气体分子是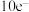 的微粒,正极的电极反应式是
的微粒,正极的电极反应式是_______ 。
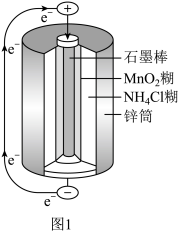
(6)图2为氢氧燃料电池原理示意图。该燃料电池正极的电极反应式_______ 。若导线中通过 个电子,负极消耗气体的体积为
个电子,负极消耗气体的体积为_______ (标况下)。
(7)直接乙醇燃料电池( )具有很多优点。现有以下三种乙醇燃料电池。
)具有很多优点。现有以下三种乙醇燃料电池。
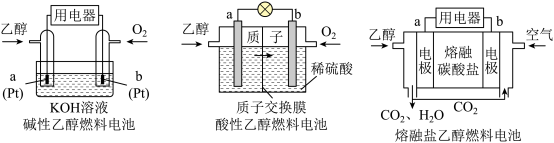
①碱性乙醇燃料电池中,电极a上发生的电极反应式为_______ 。
②酸性乙醇燃料电池中,电极a上发生的电极反应式为_______ 。
③熔融碳酸盐乙醇燃料电池中,电极b上发生的电极反应式为_______ 。
 )为原料制取铁的流程如图:
)为原料制取铁的流程如图:
(1)“浸取”时通常将菱铁矿石进行粉碎,其目的
(2)“氧化”时发生反应的离子方程式:
(3)“沉淀”时发生反应的离子方程式:
(4)现有如下两个反应:①
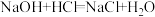 ②
②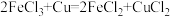 。根据两反应本质,判断能设计成原电池的反应是
。根据两反应本质,判断能设计成原电池的反应是(5)锌锰干电池是最早使用的化学电池,其基本构造如图1所示:电路中每通过
 ,负极质量减少
,负极质量减少 在正极放电产生两种气体,其中一种气体分子是
在正极放电产生两种气体,其中一种气体分子是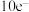 的微粒,正极的电极反应式是
的微粒,正极的电极反应式是
(6)图2为氢氧燃料电池原理示意图。该燃料电池正极的电极反应式
 个电子,负极消耗气体的体积为
个电子,负极消耗气体的体积为
(7)直接乙醇燃料电池(
 )具有很多优点。现有以下三种乙醇燃料电池。
)具有很多优点。现有以下三种乙醇燃料电池。
①碱性乙醇燃料电池中,电极a上发生的电极反应式为
②酸性乙醇燃料电池中,电极a上发生的电极反应式为
③熔融碳酸盐乙醇燃料电池中,电极b上发生的电极反应式为
您最近一年使用:0次
解题方法
8 . I.原电池可将化学能转化为电能。由A、B、C、D四种金属按下表中装置进行实验:
(1)装置甲中 向
向___________ 极移动(填“A”或“B”);
(2)四种金属活动性由强到弱的顺序是___________ ;
(3)若装置丙中的电极为质量相等的铁棒和铜棒,电池工作一段时间后,取出洗净、干燥、称量,两电极质量差为6g.则导线中通过电子的物质的量为___________ mol。
II.化学电池在通讯、交通及日常生活中有着广泛的应用。
(1)下图为甲烷燃料电池的构造示意图,由此判断

Y极为电池的___________ 极,X极的电极反应方程式为___________ ,电路中每转移0.2mol电子,标准状况下正极上消耗气体的体积是___________ L。
(2)为了验证Fe3+与Cu2+氧化性强弱,设计一个装置,下列装置既能产生电流又能达到实验目的的是___________ 。
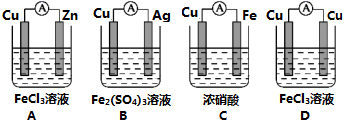
(3)铅蓄电池是常见的化学电源之一,其充电、放电的总反应是:2PbSO4+2H2O Pb +PbO2+2H2SO4.铅蓄电池放电时正极是
Pb +PbO2+2H2SO4.铅蓄电池放电时正极是___________ (填物质化学式),该电极质量___________ (填“增加”或“减少)。若电解液体积为2L(反应过程溶液体积变化忽略不计),放电过程中外电路中转移3mol电子,则硫酸浓度由5mol/L下降到___________ mol/L。
| 装置 | 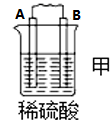 | 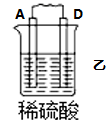 | 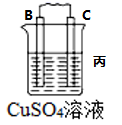 |
| 现象 | B上有气体产生 | D不断溶解 | C质量增加 |
(1)装置甲中
 向
向(2)四种金属活动性由强到弱的顺序是
(3)若装置丙中的电极为质量相等的铁棒和铜棒,电池工作一段时间后,取出洗净、干燥、称量,两电极质量差为6g.则导线中通过电子的物质的量为
II.化学电池在通讯、交通及日常生活中有着广泛的应用。
(1)下图为甲烷燃料电池的构造示意图,由此判断

Y极为电池的
(2)为了验证Fe3+与Cu2+氧化性强弱,设计一个装置,下列装置既能产生电流又能达到实验目的的是

(3)铅蓄电池是常见的化学电源之一,其充电、放电的总反应是:2PbSO4+2H2O
 Pb +PbO2+2H2SO4.铅蓄电池放电时正极是
Pb +PbO2+2H2SO4.铅蓄电池放电时正极是
您最近一年使用:0次
解题方法
9 . 为验证元素金属性和非金属性强弱,某兴趣小组的同学设计下列两组实验。请回答下列问题:
实验一:验证卤族元素氯、溴、碘的非金属性强弱。
(1)步骤3的实验现象是_______ 。
(2)步骤1中加入过量氯水对实验结果_______ (填“有”或“无”)影响,解释原因_______ 。
(3)根据实验结果判断氯、溴、碘单质的氧化性由强到弱的顺序为_______ (用化学式表示)。
实验二:为验证Mg、Al金属性的强弱,设计如下实验。

根据表中的实验现象回答下列问题:
(4)实验Ⅰ中电池工作时电解质溶液中 移向
移向_______ (填“Mg”或“石墨”)电极。
(5)根据实验_______ (填实验编号)可判断Mg、Al两种元素的金属性强弱。
(6)实验Ⅲ中电流表指针偏向Mg的原因是_______ ;该电池负极的电极反应式为_______ 。
实验一:验证卤族元素氯、溴、碘的非金属性强弱。
| 步骤1 | 步骤2 | 步骤3 | |
| 实验 | 向 的 的 溶液中滴加少量氯水,振荡 溶液中滴加少量氯水,振荡 | 继续加入 的KI溶液,振荡后加入 的KI溶液,振荡后加入 ,继续振荡 ,继续振荡 | 另取 的KI溶液,滴加氯水,加入 的KI溶液,滴加氯水,加入 ,振荡 ,振荡 |
(2)步骤1中加入过量氯水对实验结果
(3)根据实验结果判断氯、溴、碘单质的氧化性由强到弱的顺序为
实验二:为验证Mg、Al金属性的强弱,设计如下实验。
| 编号 | 电极材料 | 电解质溶液 | 电流表指针 |
| Ⅰ | Mg、石墨 | 稀 | 偏向石墨 |
| Ⅱ | Mg、Al | 稀 | 偏向Al |
| Ⅲ | Mg、Al |  溶液 溶液 | 偏向Mg |

根据表中的实验现象回答下列问题:
(4)实验Ⅰ中电池工作时电解质溶液中
 移向
移向(5)根据实验
(6)实验Ⅲ中电流表指针偏向Mg的原因是
您最近一年使用:0次
2021-05-07更新
|
153次组卷
|
2卷引用:河南名校联盟2020-2021学年高一下学期期中考试化学试题
10 . 电池在我们的生活中有着重要的应用,请回答下列问题:
(1)为了验证与 和
和 的氧化性强弱,下列装置能达到实验目的的是
的氧化性强弱,下列装置能达到实验目的的是____________________ (填序号),写出正极的电极反应式___________________ 。若构建原电池时两个电极的质量相等,当导线中通过 电子时,两个电极的质量差为
电子时,两个电极的质量差为____________________ 。

(2)将 设计成燃料电池,其利用率更高,装置如图所示(A、B为多孔碳棒)。
设计成燃料电池,其利用率更高,装置如图所示(A、B为多孔碳棒)。
实验测得电池工作时 向B电极定向移动,则
向B电极定向移动,则____________________ (填“A”或“B”)处电极入口通甲烷,其电极反应式为_____________ 。
(3)以氨作为燃料的燃料电池,具有能量效率高的特点,另外氨气含氢量高,易液化,方便运输和贮存,是很好的氢源载体。燃料电池的结构如图所示:

①a极是电池的____________________ (填“正”或“负”)极,电极反应式为_______________________ 。
②当生成 时,电路中通过的电子的物质的量为
时,电路中通过的电子的物质的量为____________________ 。
(1)为了验证与
 和
和 的氧化性强弱,下列装置能达到实验目的的是
的氧化性强弱,下列装置能达到实验目的的是 电子时,两个电极的质量差为
电子时,两个电极的质量差为
(2)将
 设计成燃料电池,其利用率更高,装置如图所示(A、B为多孔碳棒)。
设计成燃料电池,其利用率更高,装置如图所示(A、B为多孔碳棒)。
实验测得电池工作时
 向B电极定向移动,则
向B电极定向移动,则(3)以氨作为燃料的燃料电池,具有能量效率高的特点,另外氨气含氢量高,易液化,方便运输和贮存,是很好的氢源载体。燃料电池的结构如图所示:

①a极是电池的
②当生成
 时,电路中通过的电子的物质的量为
时,电路中通过的电子的物质的量为
您最近一年使用:0次



