1 . FeSO4溶液放置在空气中容易变质,因此为了方便使用Fe2+,实验室中常保存硫酸亚铁铵晶体[俗称“摩尔盐”,化学式为(NH4)2Fe(SO4)2•6H2O],它比绿矾或绿矾溶液更稳定。
I.某兴趣小组设计实验制备硫酸亚铁铵晶体。
本实验中,配制溶液以及后续使用到的蒸馏水都经过煮沸、冷却后再使用。向FeSO4溶液中加入饱和(NH4)2SO4溶液,经过操作_______ 、冷却结晶、过滤、洗涤和干燥后得到一种浅蓝绿色的晶体。
II.实验探究影响溶液中Fe2+稳定性的因素
(1)配制0.8 mol/L的FeSO4溶液(pH=4.5)和0.8 mol/L的(NH4)2Fe(SO4)2溶液(pH=4.0),各取2 mL上述溶液于两支试管中,刚开始两种溶液都是浅绿色,分别同时滴加2滴0.01mol/L的KSCN溶液,15min后观察可见:(NH4)2Fe(SO4)2溶液仍然为浅绿色透明澄清溶液,FeSO4溶液则出现淡黄色浑浊。
【资料1】
①请用离子方程式解释FeSO4溶液产生淡黄色浑浊的原因___________________ 。
②讨论影响Fe2+稳定性的因素,小组同学提出以下3种假设:
假设1:其他条件相同时,NH4+的存在使(NH4)2Fe(SO4)2溶液中Fe2+稳定性较好。
假设2:其他条件相同时,在一定 pH范围内,溶液 pH越小Fe2+稳定性越好。
假设3:__________________________________________________ 。
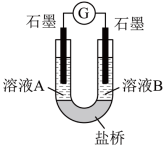
(2)小组同学用如图装置(G为灵敏电流计),滴入适量的硫酸溶液分别控制溶液A(0.2 mol/L NaCl)和溶液B(0.1mol/L FeSO4)为不同的 pH,观察记录电流计读数,对假设2进行实验研究,实验结果如下表所示。
【资料2】原电池装置中,其他条件相同时,负极反应物的还原性越强或正极反应物的氧化性越强,该原电池的电流越大。
【资料3】常温下,0.1mol/LpH=1的FeSO4溶液比pH=5的FeSO4溶液稳定性更好。
根据以上实验结果和资料信息,经小组讨论可以得出以下结论:
①U型管中左池的电极反应式_________________ 。
②对比实验1和2(或3和4),在一定pH范围内,可得出的结论为______ 。
③对比实验_____ 和_____ 还可得出在一定 pH范围内,溶液酸碱性变化是对O2氧化性强弱的影响因素。
④对【资料3】实验事实的解释为____________________ 。
I.某兴趣小组设计实验制备硫酸亚铁铵晶体。
本实验中,配制溶液以及后续使用到的蒸馏水都经过煮沸、冷却后再使用。向FeSO4溶液中加入饱和(NH4)2SO4溶液,经过操作
II.实验探究影响溶液中Fe2+稳定性的因素
(1)配制0.8 mol/L的FeSO4溶液(pH=4.5)和0.8 mol/L的(NH4)2Fe(SO4)2溶液(pH=4.0),各取2 mL上述溶液于两支试管中,刚开始两种溶液都是浅绿色,分别同时滴加2滴0.01mol/L的KSCN溶液,15min后观察可见:(NH4)2Fe(SO4)2溶液仍然为浅绿色透明澄清溶液,FeSO4溶液则出现淡黄色浑浊。
【资料1】
| 沉淀 | Fe(OH)2 | Fe(OH)3 |
| 开始沉淀 pH | 7.6 | 2.7 |
| 完全沉淀 pH | 9.6 | 3.7 |
②讨论影响Fe2+稳定性的因素,小组同学提出以下3种假设:
假设1:其他条件相同时,NH4+的存在使(NH4)2Fe(SO4)2溶液中Fe2+稳定性较好。
假设2:其他条件相同时,在一定 pH范围内,溶液 pH越小Fe2+稳定性越好。
假设3:
(2)小组同学用如图装置(G为灵敏电流计),滴入适量的硫酸溶液分别控制溶液A(0.2 mol/L NaCl)和溶液B(0.1mol/L FeSO4)为不同的 pH,观察记录电流计读数,对假设2进行实验研究,实验结果如下表所示。
| 序号 | A 0.2mol/LNaCl | B 0.1mol/LFeSO4 | 电流计读数 |
| 实验1 | pH=1 | pH=5 | 8.4 |
| 实验2 | pH=1 | pH=1 | 6.5 |
| 实验3 | pH=6 | pH=5 | 7.8 |
| 实验4 | pH=6 | pH=1 | 5.5 |

【资料2】原电池装置中,其他条件相同时,负极反应物的还原性越强或正极反应物的氧化性越强,该原电池的电流越大。
【资料3】常温下,0.1mol/LpH=1的FeSO4溶液比pH=5的FeSO4溶液稳定性更好。
根据以上实验结果和资料信息,经小组讨论可以得出以下结论:
①U型管中左池的电极反应式
②对比实验1和2(或3和4),在一定pH范围内,可得出的结论为
③对比实验
④对【资料3】实验事实的解释为
您最近一年使用:0次
2020-04-02更新
|
344次组卷
|
4卷引用:江苏省昆山中学2022-2023学年高一下学期期中考试化学试题
江苏省昆山中学2022-2023学年高一下学期期中考试化学试题北京市门头沟区2020届高三3月综合练习化学试题山东省2020届高三模拟考试化学试题(已下线)北京市2019-2020学年高三各区一模化学考试分类汇编:科学探究
名校
解题方法
2 . 某小组同学利用原电池装置探究物质的性质。
(1)同学们利用下表中装置进行实验并记录。
①同学们认为实验Ⅰ中铁主要发生了析氢腐蚀,其正极反应式是______________ 。
②针对实验Ⅱ现象:甲同学认为不可能发生析氢腐蚀,其判断依据是______________ ;乙同学认为实验Ⅱ中应发生吸氧腐蚀,其正极的电极反应式是___________________ 。
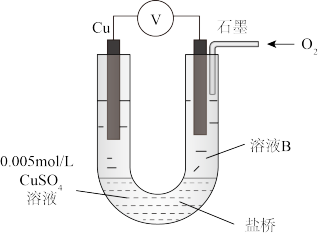
(2)同学们仍用上述装置并用Cu和石墨为电极继续实验,探究实验Ⅱ指针偏转原因及影响O2氧化性的因素。
①丙同学比较实验Ⅱ、Ⅲ、Ⅳ的电压表读数为:c>a>b,请解释原因是__________ 。
②丁同学对Ⅳ、Ⅴ进行比较,其目的是探究________ 对O2氧化性的影响。
③实验Ⅳ中加入Na2SO4溶液的目的是_____________ 。
④为达到丁同学的目的,经讨论,同学们认为应改用下图装置对Ⅳ、Ⅴ重复进行实验,其设计意图是________ ;重复实验时,记录电压表读数依次为c′、d′,且c′>d′,由此得出的结论是______________________________ 。
| 资料显示:原电池装置中,负极反应物的还原性越强,或正极反应物的氧化性越强,原电池的电压越大。 |
| 装置 | 编号 | 电极A | 溶液B | 操作及现象 |
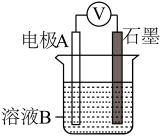 | Ⅰ | Fe | pH=2的H2SO4 | 连接装置后,石墨表面产生无色气泡;电压表指针偏转 |
| Ⅱ | Cu | pH=2的H2SO4 | 连接装置后,石墨表面无明显现象;电压表指针偏转,记录读数为a |
②针对实验Ⅱ现象:甲同学认为不可能发生析氢腐蚀,其判断依据是
(2)同学们仍用上述装置并用Cu和石墨为电极继续实验,探究实验Ⅱ指针偏转原因及影响O2氧化性的因素。
| 编号 | 溶液B | 操作及现象 |
| Ⅲ | 经煮沸的pH=2的 H2SO4 | 溶液表面用煤油覆盖,连接装置后,电压表指针微微偏转,记录读数为b |
| Ⅳ | pH=2的H2SO4 | 在石墨一侧缓慢通入O2并连接装置,电压表指针偏转,记录读数为c;取出电极,向溶液中加入数滴浓Na2SO4溶液混合后,插入电极,保持O2通入,电压表读数仍为c |
| Ⅴ | pH=12的NaOH | 在石墨一侧缓慢通入O2并连接装置,电压表指针偏转,记录读数为d |
②丁同学对Ⅳ、Ⅴ进行比较,其目的是探究
③实验Ⅳ中加入Na2SO4溶液的目的是
④为达到丁同学的目的,经讨论,同学们认为应改用下图装置对Ⅳ、Ⅴ重复进行实验,其设计意图是

您最近一年使用:0次
2018-06-04更新
|
266次组卷
|
7卷引用:【校级联考】浙江省温州市“十五校联合体”2018-2019学年高二上学期期中联考化学试题
名校
3 . 1841年美国学者Fremy首次合成了 ,它是一种“环境友好型氧化剂”。某小组拟制备
,它是一种“环境友好型氧化剂”。某小组拟制备 ,并探究其性质。已知20℃时KCl的溶解度为37.4g,
,并探究其性质。已知20℃时KCl的溶解度为37.4g, 的溶解度为11.1g。
的溶解度为11.1g。
实验(一)制备 ,装置如图所示:
,装置如图所示:___________ 。
(2)甲装置中副产物为氯化钾,写出生成 的离子方程式:
的离子方程式:___________ ,实验完毕后,对甲装置中混合液进行___________ 过滤、洗涤、低温干燥。
实验(二)探究 性质及应用。
性质及应用。
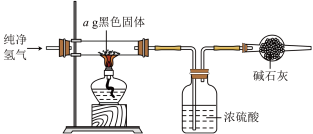
取10g草酸溶于40mL水中,加入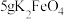 粉末,充分混合,观察到有大量气泡产生,并产生黑色固体。将所得气体通入足量澄清石灰水中,溶液变浑浊。根据上述实验现象,可以判断产生的气体中含有
粉末,充分混合,观察到有大量气泡产生,并产生黑色固体。将所得气体通入足量澄清石灰水中,溶液变浑浊。根据上述实验现象,可以判断产生的气体中含有 ,经测定所得气体中还含有
,经测定所得气体中还含有 。
。
(3)实验完毕后,将混合物经过滤、洗涤、干燥得到黑色固体,利用如图实验装置探究黑色固体的成分,当黑色固体完全反应后,测得浓硫酸质量净增bg,当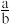 等于
等于___________ (用最简分数比表示)时,黑色固体为 。
。 稳定性(用
稳定性(用 浓度表示)与pH关系如图,其消毒效率与温度关系如图所示:
浓度表示)与pH关系如图,其消毒效率与温度关系如图所示:___________ 。
②在相同条件下, 作消毒剂最佳温度是
作消毒剂最佳温度是___________ 。
(5)查阅资料可知, 溶液呈紫红色,为探究
溶液呈紫红色,为探究 和
和 的电位相对大小,设计如下方案。(已知:电位一般指“电势”,用“
的电位相对大小,设计如下方案。(已知:电位一般指“电势”,用“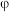 ”表示。氧化剂的电位是衡量其氧化性强度主要参数,电位越高,对应2条件下氧化剂的氧化性越强。)
”表示。氧化剂的电位是衡量其氧化性强度主要参数,电位越高,对应2条件下氧化剂的氧化性越强。)
方案1:在 溶液中加过量的
溶液中加过量的 粉末,溶液呈紫红色。
粉末,溶液呈紫红色。
方案2:如图所示,关闭K时,观察到电流计指针偏转,铂极产生红褐色物质,石墨极附近无色溶液变紫红色。___________ (填“1”或“2”)能证明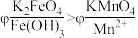 ,石墨极的电极反应式为
,石墨极的电极反应式为___________ 。
 ,它是一种“环境友好型氧化剂”。某小组拟制备
,它是一种“环境友好型氧化剂”。某小组拟制备 ,并探究其性质。已知20℃时KCl的溶解度为37.4g,
,并探究其性质。已知20℃时KCl的溶解度为37.4g, 的溶解度为11.1g。
的溶解度为11.1g。实验(一)制备
 ,装置如图所示:
,装置如图所示: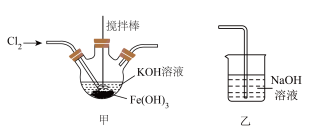
(2)甲装置中副产物为氯化钾,写出生成
 的离子方程式:
的离子方程式:实验(二)探究
 性质及应用。
性质及应用。取10g草酸溶于40mL水中,加入
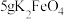 粉末,充分混合,观察到有大量气泡产生,并产生黑色固体。将所得气体通入足量澄清石灰水中,溶液变浑浊。根据上述实验现象,可以判断产生的气体中含有
粉末,充分混合,观察到有大量气泡产生,并产生黑色固体。将所得气体通入足量澄清石灰水中,溶液变浑浊。根据上述实验现象,可以判断产生的气体中含有 ,经测定所得气体中还含有
,经测定所得气体中还含有 。
。(3)实验完毕后,将混合物经过滤、洗涤、干燥得到黑色固体,利用如图实验装置探究黑色固体的成分,当黑色固体完全反应后,测得浓硫酸质量净增bg,当
 等于
等于 。
。
 稳定性(用
稳定性(用 浓度表示)与pH关系如图,其消毒效率与温度关系如图所示:
浓度表示)与pH关系如图,其消毒效率与温度关系如图所示: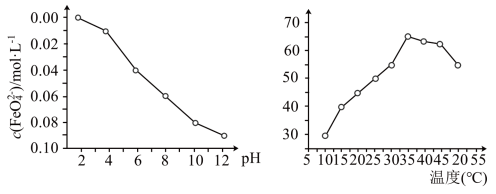
②在相同条件下,
 作消毒剂最佳温度是
作消毒剂最佳温度是(5)查阅资料可知,
 溶液呈紫红色,为探究
溶液呈紫红色,为探究 和
和 的电位相对大小,设计如下方案。(已知:电位一般指“电势”,用“
的电位相对大小,设计如下方案。(已知:电位一般指“电势”,用“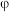 ”表示。氧化剂的电位是衡量其氧化性强度主要参数,电位越高,对应2条件下氧化剂的氧化性越强。)
”表示。氧化剂的电位是衡量其氧化性强度主要参数,电位越高,对应2条件下氧化剂的氧化性越强。)方案1:在
 溶液中加过量的
溶液中加过量的 粉末,溶液呈紫红色。
粉末,溶液呈紫红色。方案2:如图所示,关闭K时,观察到电流计指针偏转,铂极产生红褐色物质,石墨极附近无色溶液变紫红色。
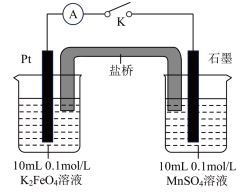
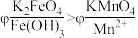 ,石墨极的电极反应式为
,石墨极的电极反应式为
您最近一年使用:0次
解题方法
4 . 某小组研究Cu2+和Fe3+的氧化性,进行如下实验。
实验Ⅰ: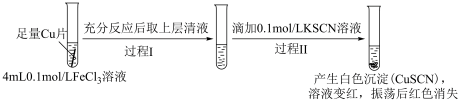
已知:1.(SCN)2 是黄色液体,氧化性:I2 < (SCN)2 < Br2。
2.K3[Fe(CN)6]溶液可用于Fe2+的检验,生成蓝色沉淀。
3.Fe3+与SCN-可以形成多种微粒,例如[Fe(SCN)]2+、Fe(SCN)3等溶液显红色。
(1)实验Ⅰ过程Ⅰ中Cu与FeCl3反应的化学方程式是___________ 。
(2)实验Ⅰ过程Ⅱ中溶液变红,说明产生了Fe3+,分析可能原因。
假设①:Fe2+被Cu2+氧化。
过程Ⅱ发生反应的电极反应式:
a.氧化反应:Fe2+-e-+3SCN-=Fe(SCN)3
b.还原反应:___________ 。
假设②:Cu2+和SCN-发生反应生成(SCN)2,进而将清液中的Fe2+氧化为Fe3+。
设计实验Ⅱ证实假设。
实验Ⅱ: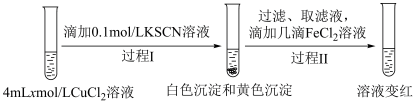
i.
___________ 。
ⅱ.实验Ⅱ中过程Ⅱ的离子方程式为___________ 。
(3)设计实验进一步研究Fe3+能否氧化SCN-。
实验Ⅲ:
①实验Ⅲ中加入K3[Fe(CN)6]溶液后,若___________ (写出实验现象),
说明在该实验条件下,Fe3+未能氧化SCN-。
②进一步查阅资料发现:Fe3+与SCN-可以发生氧化还原反应。该小组通过实验证明了该反应的发生。请你在答题卡方框中用文字或图示 设计实验方案,并描述相关的实验现象:___________ 。
实验Ⅰ:

已知:1.(SCN)2 是黄色液体,氧化性:I2 < (SCN)2 < Br2。
2.K3[Fe(CN)6]溶液可用于Fe2+的检验,生成蓝色沉淀。
3.Fe3+与SCN-可以形成多种微粒,例如[Fe(SCN)]2+、Fe(SCN)3等溶液显红色。
(1)实验Ⅰ过程Ⅰ中Cu与FeCl3反应的化学方程式是
(2)实验Ⅰ过程Ⅱ中溶液变红,说明产生了Fe3+,分析可能原因。
假设①:Fe2+被Cu2+氧化。
过程Ⅱ发生反应的电极反应式:
a.氧化反应:Fe2+-e-+3SCN-=Fe(SCN)3
b.还原反应:
假设②:Cu2+和SCN-发生反应生成(SCN)2,进而将清液中的Fe2+氧化为Fe3+。
设计实验Ⅱ证实假设。
实验Ⅱ:

i.

ⅱ.实验Ⅱ中过程Ⅱ的离子方程式为
(3)设计实验进一步研究Fe3+能否氧化SCN-。
实验Ⅲ:

①实验Ⅲ中加入K3[Fe(CN)6]溶液后,若
说明在该实验条件下,Fe3+未能氧化SCN-。
②进一步查阅资料发现:Fe3+与SCN-可以发生氧化还原反应。该小组通过实验证明了该反应的发生。请你在
您最近一年使用:0次
5 . 下列实验装置能达到实验目的的是
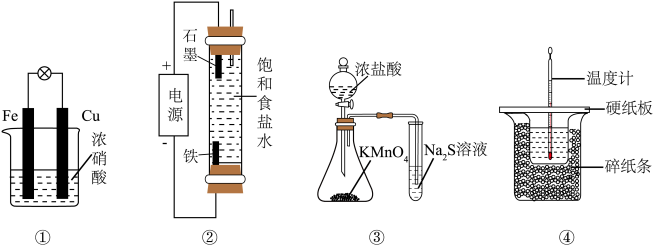
| A.装置①验证Fe和Cu的还原性强弱 | B.装置②制备少量NaClO |
C.装置③比较 、 、 和S的氧化性 和S的氧化性 | D.装置④测定中和反应的反应热 |
您最近一年使用:0次
名校
解题方法
6 . 实验室探究 溶液与
溶液与 的反应。
的反应。
I.如图所示制备(经检验装置气密性良好)。

(1)仪器a的名称是_______ 。
(2)写出C中制备 的离子方程式
的离子方程式_______ 。
II.探究 溶液与
溶液与 的反应,过程如图所示:
的反应,过程如图所示:

已知:硫酸亚铜易溶于水。
回答下列问题:
(3)加入 固体后产生的无色气体和白色沉淀经检验分别是
固体后产生的无色气体和白色沉淀经检验分别是 和
和 ,说明发生了氧化还原反应。加入
,说明发生了氧化还原反应。加入 固体发生反应的原因。
固体发生反应的原因。
a. 改变了
改变了 的还原性 b.
的还原性 b. 改变了
改变了 的氧化性
的氧化性
用原电池原理进行试验,探究上述现象可能的原因。
①由实验1、2可知原因a不合理,依据是_______ 。
②实验3:用如图所示装置实验,B中有白色沉淀生成,证明原因b合理。

i.补全电化学装置示意图_______ 。
ii.写出B中的电极反应方程式中_______ 。
iii.请从反应原理的角度解释原因: 与
与 的还原产物
的还原产物 形成沉淀,
形成沉淀,_______ ,使 与
与 的反应能够反应完全。
的反应能够反应完全。
 溶液与
溶液与 的反应。
的反应。I.如图所示制备(经检验装置气密性良好)。

(1)仪器a的名称是
(2)写出C中制备
 的离子方程式
的离子方程式II.探究
 溶液与
溶液与 的反应,过程如图所示:
的反应,过程如图所示:
已知:硫酸亚铜易溶于水。
回答下列问题:
(3)加入
 固体后产生的无色气体和白色沉淀经检验分别是
固体后产生的无色气体和白色沉淀经检验分别是 和
和 ,说明发生了氧化还原反应。加入
,说明发生了氧化还原反应。加入 固体发生反应的原因。
固体发生反应的原因。a.
 改变了
改变了 的还原性 b.
的还原性 b. 改变了
改变了 的氧化性
的氧化性用原电池原理进行试验,探究上述现象可能的原因。
| 编号 | 实验1 | 实验2 |
| 实验 |  |  |
| 现象 | 闭合开关K,电流计指针发生微小偏转,烧杯中未见明显现象 | 闭合开关K,电流计指针发生微小偏转,烧杯中未见明显现象 |
②实验3:用如图所示装置实验,B中有白色沉淀生成,证明原因b合理。

i.补全电化学装置示意图
ii.写出B中的电极反应方程式中
iii.请从反应原理的角度解释原因:
 与
与 的还原产物
的还原产物 形成沉淀,
形成沉淀, 与
与 的反应能够反应完全。
的反应能够反应完全。
您最近一年使用:0次
名校
解题方法
7 . 将铜棒插入浓、稀 溶液中(装置如图)、观察到电流计指针发生偏转,一段时间后,浸入浓
溶液中(装置如图)、观察到电流计指针发生偏转,一段时间后,浸入浓 溶液的铜棒变粗。下列说法不正确的是
溶液的铜棒变粗。下列说法不正确的是
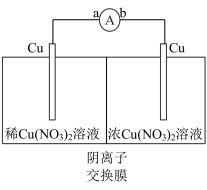
 溶液中(装置如图)、观察到电流计指针发生偏转,一段时间后,浸入浓
溶液中(装置如图)、观察到电流计指针发生偏转,一段时间后,浸入浓 溶液的铜棒变粗。下列说法不正确的是
溶液的铜棒变粗。下列说法不正确的是
A.铜棒变粗的反应: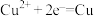 |
| B.导线中电子移动的方向:b→a |
C.随着反应的进行,浓、稀 溶液的浓度逐渐接近 溶液的浓度逐渐接近 |
D. 的氧化性随 的氧化性随 增大而增强,Cu的还原性随 增大而增强,Cu的还原性随 增大而减弱 增大而减弱 |
您最近一年使用:0次
2023-03-30更新
|
507次组卷
|
4卷引用:北京市第五中学2023-2024学年高三上学期期中考试化学试题
解题方法
8 . 能量转化是化学变化的主要特征之一,按要求回答下列问题。
(1)页岩气是从页岩层中开采出来的天然气,成分以甲烷为主,页岩气的资源潜力可能大于常规天然气。下列有关页岩气的叙述错误的是_______(填序号)。
(2)有关的电池装置如下:
①上述四种电池中,属于二次电池的是_______ (填序号,下同),属于干电池的是_______ 。
②a装置中,外电路中电子的流向是_______ (填“从Zn流向Cu”或“从Cu流向Zn”)。
③c装置中,若电解质改为碱性介质,则负极的电极反应式为_______ 。
(3)氧化还原反应一般可以设计成原电池。若将反应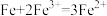 设计成原电池,则:
设计成原电池,则:
①该电池的电解质溶液可以是_______ 。
②当外电路中转移1mol e-时,电解质溶液增加的质量是_______ g。
(1)页岩气是从页岩层中开采出来的天然气,成分以甲烷为主,页岩气的资源潜力可能大于常规天然气。下列有关页岩气的叙述错误的是_______(填序号)。
| A.页岩气属于新能源 |
| B.页岩气和氧气的反应是放热反应 |
| C.甲烷中每个原子的最外层电子排布都达到8电子稳定结构 |
| D.页岩气可以作燃料电池的负极燃料 |
| 电池装置 | 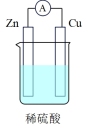 | 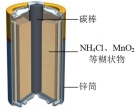 | 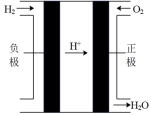 | 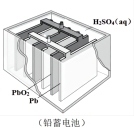 |
| 编号 | a | b | c | d |
①上述四种电池中,属于二次电池的是
②a装置中,外电路中电子的流向是
③c装置中,若电解质改为碱性介质,则负极的电极反应式为
(3)氧化还原反应一般可以设计成原电池。若将反应
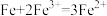 设计成原电池,则:
设计成原电池,则:①该电池的电解质溶液可以是
②当外电路中转移1mol e-时,电解质溶液增加的质量是
您最近一年使用:0次
名校
9 . 几种离子在水溶液中有如下转化关系。下列说法正确的是


A.该条件下的氧化性: |
B.反应(1)中,每生成 ,转移3mol电子 ,转移3mol电子 |
C.将反应(2)设计成原电池, 向负极迁移 向负极迁移 |
D. 与 与 反应生成 反应生成 和 和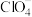 时,氧化剂与还原剂的物质的量之比为1∶2 时,氧化剂与还原剂的物质的量之比为1∶2 |
您最近一年使用:0次
2022-03-06更新
|
1069次组卷
|
8卷引用:广东省广州市第十六中学2021-2022学年高一下学期期中检测 化学试题
广东省广州市第十六中学2021-2022学年高一下学期期中检测 化学试题(已下线)【2023】【高一下】【其他】【余高2】【高中化学】【刘尼尼收集】河北省秦皇岛市青龙满族自治县 2021-2022学年高三下学期月考化学试题(已下线)秘籍12 原电池原理及应用-备战2022年高考化学抢分秘籍(全国通用)(已下线)专题04 氧化还原反应-三年(2020-2022)高考真题分项汇编(已下线)专题04 氧化还原反应-2022年高考真题模拟题分项汇编(已下线)微专题08 氧化性和还原性强弱的实验探究及应用-备战2023年高考化学一轮复习考点微专题广东省江门市新会第一中学2022-2023学年高一下学期3月月考化学试题
解题方法
10 . I.原电池可将化学能转化为电能。由A、B、C、D四种金属按下表中装置进行实验:
(1)装置甲中 向
向___________ 极移动(填“A”或“B”);
(2)四种金属活动性由强到弱的顺序是___________ ;
(3)若装置丙中的电极为质量相等的铁棒和铜棒,电池工作一段时间后,取出洗净、干燥、称量,两电极质量差为6g.则导线中通过电子的物质的量为___________ mol。
II.化学电池在通讯、交通及日常生活中有着广泛的应用。
(1)下图为甲烷燃料电池的构造示意图,由此判断

Y极为电池的___________ 极,X极的电极反应方程式为___________ ,电路中每转移0.2mol电子,标准状况下正极上消耗气体的体积是___________ L。
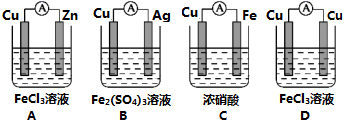
(2)为了验证Fe3+与Cu2+氧化性强弱,设计一个装置,下列装置既能产生电流又能达到实验目的的是___________ 。
(3)铅蓄电池是常见的化学电源之一,其充电、放电的总反应是:2PbSO4+2H2O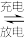 Pb +PbO2+2H2SO4.铅蓄电池放电时正极是
Pb +PbO2+2H2SO4.铅蓄电池放电时正极是___________ (填物质化学式),该电极质量___________ (填“增加”或“减少)。若电解液体积为2L(反应过程溶液体积变化忽略不计),放电过程中外电路中转移3mol电子,则硫酸浓度由5mol/L下降到___________ mol/L。
| 装置 | 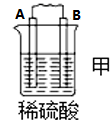 | 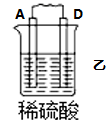 | 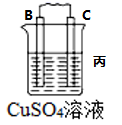 |
| 现象 | B上有气体产生 | D不断溶解 | C质量增加 |
(1)装置甲中
 向
向(2)四种金属活动性由强到弱的顺序是
(3)若装置丙中的电极为质量相等的铁棒和铜棒,电池工作一段时间后,取出洗净、干燥、称量,两电极质量差为6g.则导线中通过电子的物质的量为
II.化学电池在通讯、交通及日常生活中有着广泛的应用。
(1)下图为甲烷燃料电池的构造示意图,由此判断

Y极为电池的
(2)为了验证Fe3+与Cu2+氧化性强弱,设计一个装置,下列装置既能产生电流又能达到实验目的的是

(3)铅蓄电池是常见的化学电源之一,其充电、放电的总反应是:2PbSO4+2H2O
 Pb +PbO2+2H2SO4.铅蓄电池放电时正极是
Pb +PbO2+2H2SO4.铅蓄电池放电时正极是
您最近一年使用:0次



