解题方法
1 . 根据化学能转化为电能的相关知识,回答下列问题:
Ⅰ.理论上讲,任何自发的氧化还原反应都可以设计成原电池。有甲、乙两位同学设计了如图所示的原电池。
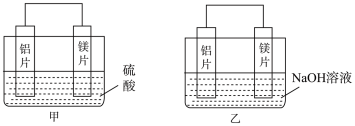
(1)写出甲中正极上的电极反应式:_______ 。
(2)乙中负极为_______ (填名称),总反应的离子方程式为_______ 。
Ⅱ.铅蓄电池是常用的化学电源,其电极材料分别是 和PbO2,电解液为稀硫酸。工作时,该电池总反应式为
和PbO2,电解液为稀硫酸。工作时,该电池总反应式为 。
。
(3)铅蓄电池属于_______ (填“一次”或“二次”)电池,该蓄电池放电时,负极材料是_______ (填化学式),放电时 被
被_______ (填“氧化”或“还原”)。
(4)该蓄电池放电时,电解质溶液中阴离子移向_______ (填“正”或“负”)极。
(5)已知硫酸铅为不溶于水的白色固体,生成时附着在电极上。写出该电池放电时,正极上的电极反应式:_______ 。
(6)充电时,以氢氧燃料电池(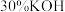 溶液为电解质溶液)为电源,则该氢氧燃料电池负极上的电极反应式为
溶液为电解质溶液)为电源,则该氢氧燃料电池负极上的电极反应式为_______ 。
Ⅰ.理论上讲,任何自发的氧化还原反应都可以设计成原电池。有甲、乙两位同学设计了如图所示的原电池。

(1)写出甲中正极上的电极反应式:
(2)乙中负极为
Ⅱ.铅蓄电池是常用的化学电源,其电极材料分别是
 和PbO2,电解液为稀硫酸。工作时,该电池总反应式为
和PbO2,电解液为稀硫酸。工作时,该电池总反应式为 。
。(3)铅蓄电池属于
 被
被(4)该蓄电池放电时,电解质溶液中阴离子移向
(5)已知硫酸铅为不溶于水的白色固体,生成时附着在电极上。写出该电池放电时,正极上的电极反应式:
(6)充电时,以氢氧燃料电池(
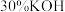 溶液为电解质溶液)为电源,则该氢氧燃料电池负极上的电极反应式为
溶液为电解质溶液)为电源,则该氢氧燃料电池负极上的电极反应式为
您最近一年使用:0次
2022-05-01更新
|
240次组卷
|
2卷引用:河北省保定市2021-2022学年高一下学期第一次月考化学试题
名校
解题方法
2 . 完成下列问题。
(1)节能减排是当今社会的热门话题,研发混合动力汽车对于中国汽车业的未来具有重要的战略意义。混合动力汽车持续工作时间长,动力性好的优点,无污染、低噪声的好处,汽车的热效率可提高10%以上,废气排放可改善30%以上,某种混合动力汽车的动力系统由“1.6L汽油机+自动变速器+20kW+200V镍氢电池”组成。
①混合动力汽车所用的燃料之一是乙醇,lg乙醇完全燃烧生成CO2气体和液态H2O放出30.0kJ热量,写出乙醇燃烧的燃烧热的热化学方程式_______ 。
②镍氢电池的使用可以减少对环境的污染,它采用储氢金属为负极,碱液NaOH为电解液,镍氢电池充电时发生反应Ni(OH)2=NiO(OH)+ H2。其放电时的正极的电极反应方程式为
H2。其放电时的正极的电极反应方程式为_______ 。
(2)二氧化锰、锌是制备干电池的重要原料,工业上用软锰矿(含MnO2)和闪锌矿(含ZnS)联合生产二氧化锰、锌的工艺如下:
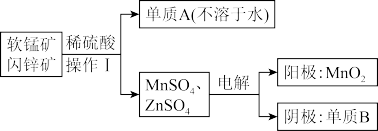
①操作I需要的玻璃仪器是_______ 。
②软锰矿(含MnO2)和闪锌矿与硫酸反应的化学方程式为_______ ,上述电解过程中,当阴极生成6.5gB时,阳极生成的MnO2的质量为_______ 。
③利用铝热反应原理,可以从软锰矿中提取锰,发生的化学方程式为_______ 。
(1)节能减排是当今社会的热门话题,研发混合动力汽车对于中国汽车业的未来具有重要的战略意义。混合动力汽车持续工作时间长,动力性好的优点,无污染、低噪声的好处,汽车的热效率可提高10%以上,废气排放可改善30%以上,某种混合动力汽车的动力系统由“1.6L汽油机+自动变速器+20kW+200V镍氢电池”组成。
①混合动力汽车所用的燃料之一是乙醇,lg乙醇完全燃烧生成CO2气体和液态H2O放出30.0kJ热量,写出乙醇燃烧的燃烧热的热化学方程式
②镍氢电池的使用可以减少对环境的污染,它采用储氢金属为负极,碱液NaOH为电解液,镍氢电池充电时发生反应Ni(OH)2=NiO(OH)+
 H2。其放电时的正极的电极反应方程式为
H2。其放电时的正极的电极反应方程式为(2)二氧化锰、锌是制备干电池的重要原料,工业上用软锰矿(含MnO2)和闪锌矿(含ZnS)联合生产二氧化锰、锌的工艺如下:

①操作I需要的玻璃仪器是
②软锰矿(含MnO2)和闪锌矿与硫酸反应的化学方程式为
③利用铝热反应原理,可以从软锰矿中提取锰,发生的化学方程式为
您最近一年使用:0次
3 . SO2是一种污染性气体,减少SO2在大气中的排放是环境保护的重要内容回答下列问题:
(1)已知:S(s)+O2(g)=SO2(g) ∆H=—297.2kJ·mol-1,CH4(g)+2SO2(g)=CO2(g)+2S(s)+2H2O(l) ∆H=—295.9kJ·mol-1,若CH4(g)+2O2(g)=CO2(g)+2H2O(l)反应物的能量为E1,则生成物的能量E2是___________
(2)利用反应:C(s)+SO2(g) CO2(g)+S(g),可减少SO2在大气中的排放,在密闭容器中投入足量的反应物,不同实验条件下达到平衡,测得T=600℃下的x(SO2)—p和p=105Pa下—1gKc—t如图所示[x(SO2)表示SO2平衡时含量,Kc表示平衡常数]。该反应的正反应是
CO2(g)+S(g),可减少SO2在大气中的排放,在密闭容器中投入足量的反应物,不同实验条件下达到平衡,测得T=600℃下的x(SO2)—p和p=105Pa下—1gKc—t如图所示[x(SO2)表示SO2平衡时含量,Kc表示平衡常数]。该反应的正反应是___________ 反应(填“放热”、“吸热”),理由是___________ 。
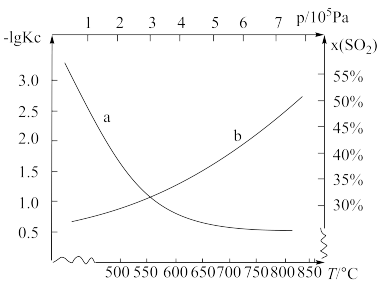
(3)恒温恒容条件下,下列事实不能说明反应C(s)+SO2(g) CO2(g)+S(g)达到平衡状态的是___________(填字母)
CO2(g)+S(g)达到平衡状态的是___________(填字母)
(4)800℃,在1.0L的恒容密闭容器中投入1.0molSO2和120gC,容器中压强为p0kPa,发生反应C(s)+SO2(g) CO2(g)+S(g),5min时容器中CO2的体积分数为20%,10min时达平衡,容器中压强为pkPa时。0~5minv(SO2)
CO2(g)+S(g),5min时容器中CO2的体积分数为20%,10min时达平衡,容器中压强为pkPa时。0~5minv(SO2)___________ kPa·min-1,800℃的化学平衡常数Kc=___________ mol/L。
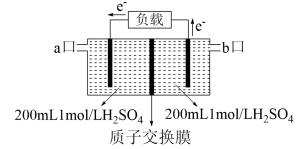
(5)用电化学原理吸收烟道气中SO2以减少其排放,其装置示意图。H2O2从___________ 口进入,电路中通过1mol电子时,正极区溶液的c(H+)将___________ ,负极区n(H2SO4)=___________ 。
(1)已知:S(s)+O2(g)=SO2(g) ∆H=—297.2kJ·mol-1,CH4(g)+2SO2(g)=CO2(g)+2S(s)+2H2O(l) ∆H=—295.9kJ·mol-1,若CH4(g)+2O2(g)=CO2(g)+2H2O(l)反应物的能量为E1,则生成物的能量E2是
(2)利用反应:C(s)+SO2(g)
 CO2(g)+S(g),可减少SO2在大气中的排放,在密闭容器中投入足量的反应物,不同实验条件下达到平衡,测得T=600℃下的x(SO2)—p和p=105Pa下—1gKc—t如图所示[x(SO2)表示SO2平衡时含量,Kc表示平衡常数]。该反应的正反应是
CO2(g)+S(g),可减少SO2在大气中的排放,在密闭容器中投入足量的反应物,不同实验条件下达到平衡,测得T=600℃下的x(SO2)—p和p=105Pa下—1gKc—t如图所示[x(SO2)表示SO2平衡时含量,Kc表示平衡常数]。该反应的正反应是
(3)恒温恒容条件下,下列事实不能说明反应C(s)+SO2(g)
 CO2(g)+S(g)达到平衡状态的是___________(填字母)
CO2(g)+S(g)达到平衡状态的是___________(填字母)A. 不变 不变 |
| B.v(CO2)正=v(SO2)逆 |
| C.混合气体的总压强不再改变 |
| D.混合气体的密度不再改变 |
 CO2(g)+S(g),5min时容器中CO2的体积分数为20%,10min时达平衡,容器中压强为pkPa时。0~5minv(SO2)
CO2(g)+S(g),5min时容器中CO2的体积分数为20%,10min时达平衡,容器中压强为pkPa时。0~5minv(SO2)(5)用电化学原理吸收烟道气中SO2以减少其排放,其装置示意图。H2O2从

您最近一年使用:0次
2021-12-11更新
|
606次组卷
|
3卷引用:河北省秦皇岛市青龙县2022-2023学年高三上学期期中考试化学试题
4 . 碘、氮及其化合物在生产中应用广泛。
(1)在2HI(g)⇌H2(g)+ I2(g)反应中,三种分子化学键断裂时能量变化如图1所示。其他条件相同,1 mol HI在不同温度分解达平衡时,测得体系中I2的物质的量随温度变化的曲线如图2所示。已知:对于吸热反应,升高温度平衡向右移动。
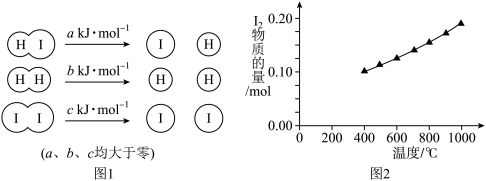
分析图1和图2,比较b+c_______ 2a(填“<”、“>”或“=”),理由是_______ 。
(2)碱性条件下3I2+6OH-=5I-+IO +3H2O,电解KI溶液制备KIO3的工作原理如下图所示。电解过程中观察到阳极液变蓝,一段时间后又逐渐变浅。
+3H2O,电解KI溶液制备KIO3的工作原理如下图所示。电解过程中观察到阳极液变蓝,一段时间后又逐渐变浅。

①b连接电源的_______ 极。
②简要说明制备KIO3的原理:_______ 。
(3)通过NOx,传感器可监测NOx的含量,其工作原理示意图如下:

①NiO电极上发生的是_______ 反应(填氧化或还原)。
②写出NiO电极的电极反应式:_______ 。
(1)在2HI(g)⇌H2(g)+ I2(g)反应中,三种分子化学键断裂时能量变化如图1所示。其他条件相同,1 mol HI在不同温度分解达平衡时,测得体系中I2的物质的量随温度变化的曲线如图2所示。已知:对于吸热反应,升高温度平衡向右移动。

分析图1和图2,比较b+c
(2)碱性条件下3I2+6OH-=5I-+IO
 +3H2O,电解KI溶液制备KIO3的工作原理如下图所示。电解过程中观察到阳极液变蓝,一段时间后又逐渐变浅。
+3H2O,电解KI溶液制备KIO3的工作原理如下图所示。电解过程中观察到阳极液变蓝,一段时间后又逐渐变浅。
①b连接电源的
②简要说明制备KIO3的原理:
(3)通过NOx,传感器可监测NOx的含量,其工作原理示意图如下:

①NiO电极上发生的是
②写出NiO电极的电极反应式:
您最近一年使用:0次
5 . 为应对全球气候变化,早日实现“碳达峰”“碳中和”目标,研发 利用技术,降低空气中
利用技术,降低空气中 含量成为研究热点。
含量成为研究热点。
I.研究证明, 可作为合成低碳烯烃的原料,目前利用
可作为合成低碳烯烃的原料,目前利用 合成乙烯相关的热化学方程式如下:
合成乙烯相关的热化学方程式如下:
反应ⅰ: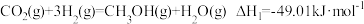
反应ⅱ:
反应ⅲ:
反应ⅳ:
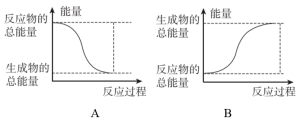
(1)反应ⅰ为反应_____ (填“放热”或“吸热”),能正确表示该反应的图示是______ (填标号)。
(2)计算可知∆H4=____ ,则利用反应ⅳ生产标准状况下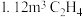 时,放出热量
时,放出热量_______ 。
II.具有广泛应用前景的新型 电化学储能系统吸引了广大科研工作者的研究兴趣。
电化学储能系统吸引了广大科研工作者的研究兴趣。 电池中,
电池中, 为单质锂片,该电池反应产物为碳酸锂和单质碳。
为单质锂片,该电池反应产物为碳酸锂和单质碳。
(3)则该电池中的 在
在___________ (填“正”或“负”)极发生电化学反应。
(4) 电池工作的总反应式为
电池工作的总反应式为___________ 。
III.可利用电还原方法将 转化成燃料。
转化成燃料。
(5) 在碱性介质中电还原为甲醇(
在碱性介质中电还原为甲醇( )的电极反应式为
)的电极反应式为___________ 。
 利用技术,降低空气中
利用技术,降低空气中 含量成为研究热点。
含量成为研究热点。I.研究证明,
 可作为合成低碳烯烃的原料,目前利用
可作为合成低碳烯烃的原料,目前利用 合成乙烯相关的热化学方程式如下:
合成乙烯相关的热化学方程式如下:反应ⅰ:
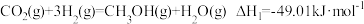
反应ⅱ:

反应ⅲ:

反应ⅳ:

(1)反应ⅰ为反应

(2)计算可知∆H4=
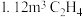 时,放出热量
时,放出热量II.具有广泛应用前景的新型
 电化学储能系统吸引了广大科研工作者的研究兴趣。
电化学储能系统吸引了广大科研工作者的研究兴趣。 电池中,
电池中, 为单质锂片,该电池反应产物为碳酸锂和单质碳。
为单质锂片,该电池反应产物为碳酸锂和单质碳。(3)则该电池中的
 在
在(4)
 电池工作的总反应式为
电池工作的总反应式为III.可利用电还原方法将
 转化成燃料。
转化成燃料。(5)
 在碱性介质中电还原为甲醇(
在碱性介质中电还原为甲醇( )的电极反应式为
)的电极反应式为
您最近一年使用:0次
6 . 依据氧化还原反应: 设计的原电池如图所示。盐桥是为了让两个池形成闭合回路。
设计的原电池如图所示。盐桥是为了让两个池形成闭合回路。
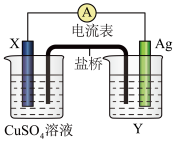
(1)电极X的材料是______ ;电解质溶液Y是______ 。
(2)银电极为电池的______ 极,发生的电极反应为 ____________ ,X电极上发生的电极反应为______________________ 。
(3)外电路中的电子是从______ 电极流向______ 电极。
(4)X电极看到的现象是_________________ ,发生 ___________  填氧化或还原
填氧化或还原 反应。
反应。
(5)上述原电池每消耗64gCu同时转移电子数为______________________ 。
 设计的原电池如图所示。盐桥是为了让两个池形成闭合回路。
设计的原电池如图所示。盐桥是为了让两个池形成闭合回路。
(1)电极X的材料是
(2)银电极为电池的
(3)外电路中的电子是从
(4)X电极看到的现象是
 填氧化或还原
填氧化或还原 反应。
反应。(5)上述原电池每消耗64gCu同时转移电子数为
您最近一年使用:0次
2020-10-15更新
|
381次组卷
|
5卷引用:河北省邯郸市永年区第二中学2020-2021学年高二上学期第一次月考教学质量检测化学试题
河北省邯郸市永年区第二中学2020-2021学年高二上学期第一次月考教学质量检测化学试题(已下线)专题4.1 原电池-2020-2021学年高二化学同步课堂帮帮帮(人教版选修4)(已下线)4.1 原电池(基础练)-2020-2021学年高二化学上学期十分钟同步课堂专练(人教版选修4)(已下线)4.1.1 原电池的工作原理(基础过关A练)-2021-2022学年高二化学课时过关提优AB练(人教版2019选择性必修1)(已下线)第四章 化学反应与电能(A卷·知识通关练)-【单元测试】2022-2023学年高二化学分层训练AB卷(人教版2019选择性必修1)
名校
解题方法
7 . 为节省药品和时间,甲、乙、丙三位同学选用铜片、锌片、稀硫酸、CuSO4溶液、直流电源、石墨电极、导线、烧杯、试管等中学化学中常见的药品和仪器(用品),以巧妙的构思,“接力”的方式,设计了比较铜与锌的金属活动性相对强弱的系列实验。试回答下列问题:
(1)甲同学分别将一小片铜片、锌片置于烧杯底部(铜与锌不接触),小心向烧杯中加入稀硫酸,可以观察到的现象是:_______________________ 。甲同学的设计思路是_______________________ 。
(2)乙同学接着甲同学的实验,向烧杯中滴加少量_________ (填化学式)溶液,进而观察到的现象是_______________ 。乙同学判断锌、铜的金属活动性相对强弱所依据的原理是________________________ 。
(3)再单独设计一个电化学方面的实验(试剂、仪器自选), 在方框内画出装置图_________ ,探究锌和铜的金属活动性的相对强弱(简要说明操作和现象)_____________________________________ 。
(1)甲同学分别将一小片铜片、锌片置于烧杯底部(铜与锌不接触),小心向烧杯中加入稀硫酸,可以观察到的现象是:
(2)乙同学接着甲同学的实验,向烧杯中滴加少量
(3)再单独设计一个电化学方面的实验(试剂、仪器自选), 在方框内画出装置图
您最近一年使用:0次
解题方法
8 . 某同学在用稀硫酸与锌制取氢气的实验中,发现加入少量硫酸铜溶液可加快氢气的生成速率。请回答下列问题:
(1)上述实验中发生反应的离子方程式有_______________________________ ;
(2)硫酸铜溶液可以加快氢气生成速率的原因是__________________________ ;
(3)要加快上述实验中气体产生的速率,还可采取的措施有______________ (答两种);
(4)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列实验。将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需时间。
①请完成此实验设计,其中:V1=_______ ,V6=________ ,V7=________ ,V9=________ ;
②该同学最后得出的结论为:当加入少量CuSO4溶液时,生成氢气的速率会大大提高。但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降。请分析氢气生成速率下降的主要原因:___________________________________________ 。
(1)上述实验中发生反应的离子方程式有
(2)硫酸铜溶液可以加快氢气生成速率的原因是
(3)要加快上述实验中气体产生的速率,还可采取的措施有
(4)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列实验。将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需时间。
| 实验 混合溶液 | A | B | C | D | E | F |
| 4mol·L-1H2SO4/mL | 30 | V1 | V2 | V3 | V4 | V5 |
| 饱和CuSO4溶液/mL | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
| H2O/mL | V7 | V8 | V9 | V10 | 10 | 0 |
①请完成此实验设计,其中:V1=
②该同学最后得出的结论为:当加入少量CuSO4溶液时,生成氢气的速率会大大提高。但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降。请分析氢气生成速率下降的主要原因:
您最近一年使用:0次
2020-09-21更新
|
147次组卷
|
3卷引用:河北省正定县弘文中学2020-2021学年高二上学期9月月考化学(理)试题
解题方法
9 . 1799年,伏打仔细研究了伽伐尼的发现,以含食盐水的湿抹布,夹在银和锌的圆形版中间,堆积成圆柱状,制造出世界上最早的电池-伏打电池。将洁净的金属片A、B、D、E分别放置在浸有盐溶液的滤纸上面并压紧(如下图所示)。在每次实验时,记录电压表指针的移动方向和电压表的读数如下:

已知:构成两电极的金属其金属活泼性相差越大,电压表的读数越大。
①请依据表中数据判断:_______ 金属可能是最强的还原剂;______ 金属一定不能从硫酸铜溶液中置换出铜。
②1836年,英国科学家丹尼尔对伏打电池进行改进,获得了世界上第一个具有稳定电流的电池,下图是丹尼尔电池的简易装置。(提示:盐桥的作用是通过离子定向移动导电)

该电池的正极反应是________ ,负极反应 _________ 。

金属 | 电子流动方向 | 电压(V) |
A | A→Cu | +0.78 |
B | Cu→B | -0.15 |
D | D→Cu | +1.35 |
E | E→Cu | +0.30 |
①请依据表中数据判断:
②1836年,英国科学家丹尼尔对伏打电池进行改进,获得了世界上第一个具有稳定电流的电池,下图是丹尼尔电池的简易装置。(提示:盐桥的作用是通过离子定向移动导电)

该电池的正极反应是
您最近一年使用:0次
名校
解题方法
10 . 用零价铁(Fe)去除水体中的硝酸盐(NO3-)已成为环境修复研究的热点之一。
(1)Fe还原水体中NO3-的反应原理如图所示,
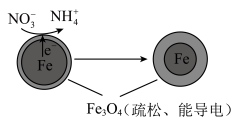
①作负极的物质是____ 。
②正极的电极反应式是____ 。
(2)将足量铁粉投入水体中,经24小时测定NO3-的去除率和pH,结果如下:
pH=4.5时,NO3-的去除率低。其原因是____ 。
(4)其他条件与(2)相同,经1小时测定NO3-的去除率和pH,结果如下:
与(2)中数据对比,解释(2)中初始pH不同时,NO3-去除率和铁的最终物质形态不同的原因:____ 。
(1)Fe还原水体中NO3-的反应原理如图所示,

①作负极的物质是
②正极的电极反应式是
(2)将足量铁粉投入水体中,经24小时测定NO3-的去除率和pH,结果如下:
| 初始pH | pH=2.5 | pH=4.5 |
| NO3-的去除率 | 接近100% | <50% |
| 24小时pH | 接近中性 | 接近中性 |
| 铁的最终物质形态 | 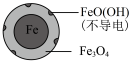 |  |
(4)其他条件与(2)相同,经1小时测定NO3-的去除率和pH,结果如下:
| 初始pH | pH=2.5 | pH=4.5 |
| NO3-的去除率 | 约10% | 约3% |
| 1小时pH | 接近中性 | 接近中性 |
您最近一年使用:0次
2020-05-07更新
|
372次组卷
|
6卷引用:河北省衡水中学2020届高三四月份质量监测理综化学试题



