名校
1 . 某化学兴趣小组为了探索 电极在原电池中的作用,设计并进行了以下一系列实验。已知:
电极在原电池中的作用,设计并进行了以下一系列实验。已知: 与
与 的化学性质基本相似,
的化学性质基本相似, 。回答下列问题:
。回答下列问题:
(1)实验1:电极材料为 和
和 ,电解质溶液为稀盐酸,该电池工作时,电流表指针偏向
,电解质溶液为稀盐酸,该电池工作时,电流表指针偏向 。
。
①正极的电极反应式为___________ 。
②每转移 电子,此时负极材料减少的质量为
电子,此时负极材料减少的质量为___________ g。
(2)实验2:电极材料为 和
和 ,电解质溶液为稀盐酸,该电池工作时,电流表指针偏向
,电解质溶液为稀盐酸,该电池工作时,电流表指针偏向 。
。
由实验1和实验2可知, 三种金属活动性由强到弱的顺序为
三种金属活动性由强到弱的顺序为___________ 。
(3)实验3:电极材料为石墨和 ,电解质溶液为稀盐酸,该电池工作时,电流表指针偏向石墨。
,电解质溶液为稀盐酸,该电池工作时,电流表指针偏向石墨。
①电池工作一段时间后,电解质溶液的 将
将___________ (填“变大”、“变小”或“不变”)。
②石墨电极上发生___________ (填“氧化”或“还原”)反应。
(4)实验4:电极材料为 和
和 ,电解质溶液为氢氧化钠溶液,该电池工作时,电流表指针偏向
,电解质溶液为氢氧化钠溶液,该电池工作时,电流表指针偏向 。
。
①负极的电极反应式为___________ 。
②外电路中电子的流动方向为___________ 。
 电极在原电池中的作用,设计并进行了以下一系列实验。已知:
电极在原电池中的作用,设计并进行了以下一系列实验。已知: 与
与 的化学性质基本相似,
的化学性质基本相似, 。回答下列问题:
。回答下列问题:(1)实验1:电极材料为
 和
和 ,电解质溶液为稀盐酸,该电池工作时,电流表指针偏向
,电解质溶液为稀盐酸,该电池工作时,电流表指针偏向 。
。①正极的电极反应式为
②每转移
 电子,此时负极材料减少的质量为
电子,此时负极材料减少的质量为(2)实验2:电极材料为
 和
和 ,电解质溶液为稀盐酸,该电池工作时,电流表指针偏向
,电解质溶液为稀盐酸,该电池工作时,电流表指针偏向 。
。由实验1和实验2可知,
 三种金属活动性由强到弱的顺序为
三种金属活动性由强到弱的顺序为(3)实验3:电极材料为石墨和
 ,电解质溶液为稀盐酸,该电池工作时,电流表指针偏向石墨。
,电解质溶液为稀盐酸,该电池工作时,电流表指针偏向石墨。①电池工作一段时间后,电解质溶液的
 将
将②石墨电极上发生
(4)实验4:电极材料为
 和
和 ,电解质溶液为氢氧化钠溶液,该电池工作时,电流表指针偏向
,电解质溶液为氢氧化钠溶液,该电池工作时,电流表指针偏向 。
。①负极的电极反应式为
②外电路中电子的流动方向为
您最近一年使用:0次
23-24高一上·全国·假期作业
解题方法
2 . 某兴趣小组为研究原电池原理,设计如图装置。

(1)a和b不连接时,烧杯中发生反应的离子方程式是___________ 。
(2)a和b用导线连接,Cu极为原电池___________ 极(填“正”或“负”),Zn极发生___________ 反应。
(3)外电路中,电子流向___________ 极(填“正”或“负”,下同),内电路溶液中,SO 移向
移向___________ 极。
(4)有同学想把CuO与稀H2SO4的反应设计成原电池,你认为是否可行___________ (填“是”或“否”),理由是___________ 。
(5)若反应中有0.2mol电子转移,则生成的氢气在标准状况下的体积为___________ 。

(1)a和b不连接时,烧杯中发生反应的离子方程式是
(2)a和b用导线连接,Cu极为原电池
(3)外电路中,电子流向
 移向
移向(4)有同学想把CuO与稀H2SO4的反应设计成原电池,你认为是否可行
(5)若反应中有0.2mol电子转移,则生成的氢气在标准状况下的体积为
您最近一年使用:0次
名校
解题方法
3 . 十九大报告提出要对环境问题进行全面、系统的可持续治理。回答下列问题:
Ⅰ.电化学气敏传感器可用于监测环境中NH3的含量,其工作原理示意图如图。

(1)Pt电极(a)为_______ 极(填“正”或“负”) ;Pt电极(b)上的电极反应式为:_______ 。
(2)该过程总反应的化学反应方程式为_______ ,反应一段时间后,KOH溶液的浓度将_______ (填“增大”“减小”或“不变”)。当消耗0.1 mol O2时,理论上转移电子个数为_______ ;
Ⅱ. 以TiO2为催化剂的光热化学循环分解CO2反应为温室气体减排提供了一个新途径,该反应的机理及各分子化学键完全断裂时的能量变化如图所示。
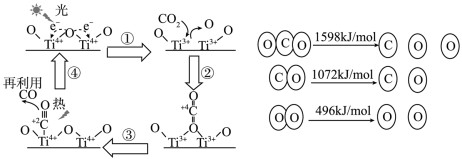
(1)上述过程中,能量的变化形式是由_______ 转化为_______ 。
(2)根据数据计算,分解1molCO2需_______ (填“吸收”或“放出”) _______ kJ的能量。
Ⅰ.电化学气敏传感器可用于监测环境中NH3的含量,其工作原理示意图如图。

(1)Pt电极(a)为
(2)该过程总反应的化学反应方程式为
Ⅱ. 以TiO2为催化剂的光热化学循环分解CO2反应为温室气体减排提供了一个新途径,该反应的机理及各分子化学键完全断裂时的能量变化如图所示。

(1)上述过程中,能量的变化形式是由
(2)根据数据计算,分解1molCO2需
您最近一年使用:0次
2021-07-17更新
|
617次组卷
|
4卷引用:甘肃省会宁县第一中学2020-2021学年高一下学期期末考试化学试题
甘肃省会宁县第一中学2020-2021学年高一下学期期末考试化学试题(已下线)6.1.2 化学反应与电能-2021-2022学年高一化学课后培优练(人教版2019必修第二册)广东省深圳市南头中学2021-2022学年高一下学期期中考试选考科目化学试题河南省信阳市2021-2022学年高二下学期期末教学质量检测化学试题
解题方法
4 . I.通常将一定量的有机物充分燃烧转化为简单的无机物,根据产物的质量确定有机物的组成。如图所示是用燃烧法确定有机物分子式的常用装置,将含有C、H、O的有机物3.24 g装入元素分析装置,通入足量的O2使之完全燃烧,实验过程中CaCl2管(B)增加了2.16 g和NaOH(A)管增加了9.24 g,试回答。
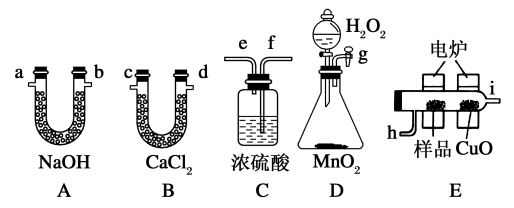
(1)使产生的O2按从左到右的方向流动,则所选装置中各导管的正确连接顺序是________ 。
(2)装置C中浓硫酸的作用是________ ,燃烧管中CuO的作用是__________ 。
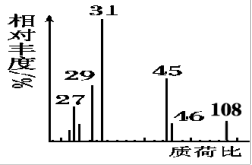
(3)已知质谱仪分析如图,则该有机物的分子式为________________ 。
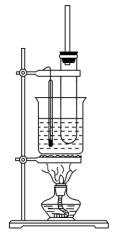
II.实验室通过苯与浓硫酸和浓硝酸的混合液在50~60 ℃的水浴中加热制备硝基苯。
已知苯与硝基苯的某些物理性质如表所示。
(1)添加药品时的操作是________________________ 。
(2)用水浴加热的优点是____________ ;
(3)大试管上安装一长导管的作用是:________________________ 。
(4)简述获得纯净的溴苯应进行的实验操作:________________________ 。
III.认真观察下列装置,回答下列问题:
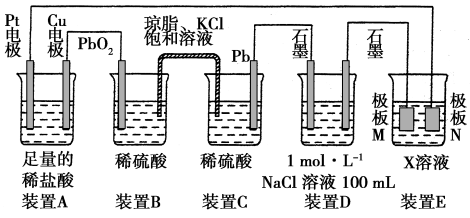
(1)装置B中PbO2上发生的电极反应方程式为_________________________ 。
(2)当装置A中Cu电极质量改变6.4 g时,装置D中产生的气体体积为________ L(标准状况下)

(1)使产生的O2按从左到右的方向流动,则所选装置中各导管的正确连接顺序是
(2)装置C中浓硫酸的作用是
(3)已知质谱仪分析如图,则该有机物的分子式为

II.实验室通过苯与浓硫酸和浓硝酸的混合液在50~60 ℃的水浴中加热制备硝基苯。

已知苯与硝基苯的某些物理性质如表所示。
| 熔点/℃ | 沸点/℃ | 状态 | |
| 苯 | 5.5 | 80.1 | 液体 |
| 硝基苯 | 5.7 | 210.9 | 液体 |
(2)用水浴加热的优点是
(3)大试管上安装一长导管的作用是:
(4)简述获得纯净的溴苯应进行的实验操作:
III.认真观察下列装置,回答下列问题:

(1)装置B中PbO2上发生的电极反应方程式为
(2)当装置A中Cu电极质量改变6.4 g时,装置D中产生的气体体积为
您最近一年使用:0次
5 . 化学反应速率、限度及能量与生产、生活密切相关。
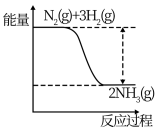
(1)氮是动植物生长不可缺少的元素,合成氨的反应对人类解决粮食问题贡献巨大,反应如下:N2+3H2 2NH3。合成氨反应中的能量变化如图所示,该反应中,反应物化学键断裂吸收的总能量
2NH3。合成氨反应中的能量变化如图所示,该反应中,反应物化学键断裂吸收的总能量___ (填“大于”或“小于”)生成物化学键形成放出的总能量。
(2)小王同学为了探究锌与盐酸反应过程中的速率变化,他在200mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如下(累计值):
①求2~4分钟时间段以盐酸的浓度变化来表示的该反应速率___ 。(设溶液体积不变)
②小蒋同学认为在盐酸溶液中滴入少量的CuSO4溶液可以加快反应的速率,请从电化学的角度给子分析:构成的原电池中负极反应式为___ ;溶液中H+移向___ 极(填“正“或“负")。
(3)某温度下在4L恒容密闭容器中,3种气态物质X、Y、Z的物质的量随时间变化曲线如图。
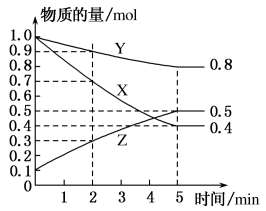
①写出该反应的化学方程式___ 。
②在5min时,该反应达到了平衡状态,下列可作为判断反应已达到该状态的是___ 。
A.X、Y、Z的浓度相等
B.容器内气体压强保持不变
C.X、Y的反应速率比为3:1
D.生成1molY的同时生成2molZ
③该反应达平衡时,X的转化率为___ 。
(1)氮是动植物生长不可缺少的元素,合成氨的反应对人类解决粮食问题贡献巨大,反应如下:N2+3H2
 2NH3。合成氨反应中的能量变化如图所示,该反应中,反应物化学键断裂吸收的总能量
2NH3。合成氨反应中的能量变化如图所示,该反应中,反应物化学键断裂吸收的总能量
(2)小王同学为了探究锌与盐酸反应过程中的速率变化,他在200mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如下(累计值):
| 时间(min) | 1 | 2 | 3 | 4 | 5 |
| 氢气体积(mL)(标准状况) | 50 | 190 | 414 | 526 | 570 |
①求2~4分钟时间段以盐酸的浓度变化来表示的该反应速率
②小蒋同学认为在盐酸溶液中滴入少量的CuSO4溶液可以加快反应的速率,请从电化学的角度给子分析:构成的原电池中负极反应式为
(3)某温度下在4L恒容密闭容器中,3种气态物质X、Y、Z的物质的量随时间变化曲线如图。

①写出该反应的化学方程式
②在5min时,该反应达到了平衡状态,下列可作为判断反应已达到该状态的是
A.X、Y、Z的浓度相等
B.容器内气体压强保持不变
C.X、Y的反应速率比为3:1
D.生成1molY的同时生成2molZ
③该反应达平衡时,X的转化率为
您最近一年使用:0次
2020-07-18更新
|
478次组卷
|
2卷引用:甘肃省张掖市高台县第一中学2021-2022学年高一下学期6月月考化学试题
名校
解题方法
6 . 能源与材料、信息一起被称为现代社会发展的三大支柱。面对能源枯竭的危机,提高能源利用率和开辟新能源是解决这一问题的两个主要方向。
(1)化学反应速率和限度与生产、生活密切相关,这是化学学科关注的方面之一。某学生为了探究锌与盐酸反应过程中的速率变化,在400mL稀盐酸中加入足量的锌粉,用排水法收集反应放出的氢气,实验记录如下(累计值):
①哪一段时间内反应速率最大:__________ min(填“0~1”“1~2”“2~3”“3~4”或“4~5”)。
②另一学生为控制反应速率防止反应过快难以测量氢气体积。他事先在盐酸中加入等体积的下列溶液以减慢反应速率但不影响生成氢气的量。你认为可行的是____________ (填字母序号)。
A.KCl溶液 B.浓盐酸 C.蒸馏水 D.CuSO4溶液
(2)如图为原电池装置示意图:
①将铝片和铜片用导线相连,一组插入浓硝酸中,一组插入烧碱溶液中,分别形成了原电池,在这两个原电池中,作负极的分别是_______ (填字母)。
A.铝片、铜片 B.铜片、铝片
C.铝片、铝片 D.铜片、铜片
写出插入浓硝酸溶液中形成的原电池的负极反应式:_______________ 。
②若A为Cu,B为石墨,电解质为FeCl3溶液,工作时的总反应为2FeCl3+Cu=2FeCl2+CuCl2。写出B电极反应式:________ ;该电池在工作时,A电极的质量将_____ (填“增加”“减小”或“不变”)。若该电池反应消耗了0.1mol FeCl3,则转移电子的数目为_______ 。
(1)化学反应速率和限度与生产、生活密切相关,这是化学学科关注的方面之一。某学生为了探究锌与盐酸反应过程中的速率变化,在400mL稀盐酸中加入足量的锌粉,用排水法收集反应放出的氢气,实验记录如下(累计值):
| 时间/min | 1 | 2 | 3 | 4 | 5 |
| 氢气体积/mL(标况) | 100 | 240 | 464 | 576 | 620 |
①哪一段时间内反应速率最大:
②另一学生为控制反应速率防止反应过快难以测量氢气体积。他事先在盐酸中加入等体积的下列溶液以减慢反应速率但不影响生成氢气的量。你认为可行的是
A.KCl溶液 B.浓盐酸 C.蒸馏水 D.CuSO4溶液
(2)如图为原电池装置示意图:

①将铝片和铜片用导线相连,一组插入浓硝酸中,一组插入烧碱溶液中,分别形成了原电池,在这两个原电池中,作负极的分别是
A.铝片、铜片 B.铜片、铝片
C.铝片、铝片 D.铜片、铜片
写出插入浓硝酸溶液中形成的原电池的负极反应式:
②若A为Cu,B为石墨,电解质为FeCl3溶液,工作时的总反应为2FeCl3+Cu=2FeCl2+CuCl2。写出B电极反应式:
您最近一年使用:0次
2020-04-21更新
|
292次组卷
|
5卷引用:甘肃省张掖市高台县第一中学2019-2020学年高一下学期期中考试化学试题
7 . 取长约6 cm、宽约2 cm的铜片和铝片各一片,分别用接线柱平行地固定在一块塑料板上(间隔2 cm)。将铜片和铝片分别和电流表的“+”“-”端相连接,电流表指针调到中间位置。取两个50 mL的小烧杯,在一个烧杯中注入约40 mL的0.5 mol·L-1的硝酸溶液,在另一个烧杯中注入40 mL的浓硝酸(注:电流表指针的偏转方向与电流方向一致)。
试回答下列问题:
(1)两电极同时插入稀硝酸中,电流表指针偏向________ (填“铝”或“铜”)极,铝片上发生的电极反应式为_____________________________________________ 。
(2)两电极同时插入浓硝酸中,电流表指针偏向________ (填“铝”或“铜”)极,此时铝片是________ (填“正”或“负”)极,铝片上发生的电极反应式为__________________________ 。
试回答下列问题:
(1)两电极同时插入稀硝酸中,电流表指针偏向
(2)两电极同时插入浓硝酸中,电流表指针偏向
您最近一年使用:0次
名校
解题方法
8 . 如图所示装置可构成原电池。试回答下列问题:

(1)电解质溶液为浓硝酸时,灯泡______ (填“亮”或“不亮”,填“亮”做a题,填“不亮”做b题)。
a.若灯泡亮,则Mg电极上发生的反应为:____________ ;
b.若灯泡不亮,其理由为:_______________________
(2)电解质溶液为NaOH溶液时,灯泡______ (填“亮或“不亮”,填“亮”做a题,填“不亮”做b题)。
a.若灯泡亮,则Mg电极反应式为:_____________________ ;
b.若灯泡不亮,其理由为:________________________ 。

(1)电解质溶液为浓硝酸时,灯泡
a.若灯泡亮,则Mg电极上发生的反应为:
b.若灯泡不亮,其理由为:
(2)电解质溶液为NaOH溶液时,灯泡
a.若灯泡亮,则Mg电极反应式为:
b.若灯泡不亮,其理由为:
您最近一年使用:0次
2017-05-06更新
|
235次组卷
|
3卷引用:【全国百强校】甘肃省兰州市第一中学2018-2019学年高二上学期12月月考化学试题
9 . 某化学兴趣小组为了测定铁碳合金中铁的质量分数,并探究浓硫酸的某些性质,设计了下图所示的实验装置和实验方案,请并回答相应问题。
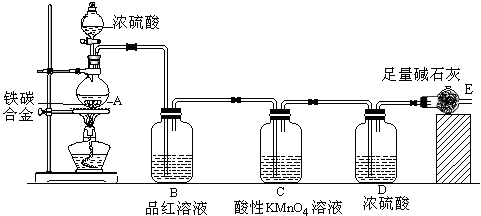
Ⅰ.探究浓硫酸的某些性质:
(1)按图示的连接装置,检查装置的气密性,称量E的质量。
(2)将ag铁碳合金样品放入A中,再加入适量的浓硫酸,未点燃酒精灯前,A、B基本上均无明显现象,其原因是_____________ ;加热A一段时间后,A、B中可观察到明显的现象,其中B中的现象__________ ,任写出一个A中发生反应的化学方程式________________________________________ 。
(3)反应相当一段时间后,从A中逸出气体的速率仍然较快,除因温度较高,其它可能的原因是____ 。并且发现此时产生的气体具有可燃性,请用离子方程式表示产生此种气体的原因______________ 。
Ⅱ.测定铁的质量分数
(4)待A中不再逸出气体时,停止加热,拆下E并称重。E增重bg。则铁碳合金中铁的质量分数
为__________________________ (写表达式)。
(5)最后对所得测量结果进行评价时,小组内有同学提出,本套装置在设计上存在多处缺陷而导致实验结果不准确,其中会导致铁质量分数测量值偏低是(任答一条即可)____________________ 。

Ⅰ.探究浓硫酸的某些性质:
(1)按图示的连接装置,检查装置的气密性,称量E的质量。
(2)将ag铁碳合金样品放入A中,再加入适量的浓硫酸,未点燃酒精灯前,A、B基本上均无明显现象,其原因是
(3)反应相当一段时间后,从A中逸出气体的速率仍然较快,除因温度较高,其它可能的原因是
Ⅱ.测定铁的质量分数
(4)待A中不再逸出气体时,停止加热,拆下E并称重。E增重bg。则铁碳合金中铁的质量分数
为
(5)最后对所得测量结果进行评价时,小组内有同学提出,本套装置在设计上存在多处缺陷而导致实验结果不准确,其中会导致铁质量分数测量值偏低是(任答一条即可)
您最近一年使用:0次
11-12高二上·辽宁大连·开学考试
名校
10 . 由A、B、C、D四种金属按下表中装置进行实验。
根据实验现象回答下列问题:
(1)装置甲中负极的电极反应式是______________________________________ 。
(2)装置乙中正极的电极反应式是_______________________________________ 。
(3)装置丙中溶液的pH________ (填“变大”、“变小”或“不变”)。
(4)四种金属活动性由强到弱的顺序是___________________________________ 。
| 装置 |  |  |  |
| 现象 | 二价金属A不断溶解 | C的质量增加 | A上有气体产生 |
(1)装置甲中负极的电极反应式是
(2)装置乙中正极的电极反应式是
(3)装置丙中溶液的pH
(4)四种金属活动性由强到弱的顺序是
您最近一年使用:0次
2016-12-09更新
|
1312次组卷
|
25卷引用:【全国百强校】甘肃省会宁县第一中学2017-2018学年高一下学期期末考试化学试题
【全国百强校】甘肃省会宁县第一中学2017-2018学年高一下学期期末考试化学试题甘肃省武威市第十八中学2018-2019学年高二上学期期末考试化学试题(已下线)2011-2012学年辽宁省庄河六中高二上学期开学初考试化学试卷(已下线)2011-2012学年江西上饶中学高一潜能班下期末考试化学试卷2014-2015四川省大竹县文星中学高一4月月考化学试卷2015-2016学年河北省唐山一中高一下期中化学试卷2016-2017学年河北省张家口市第一中学高一(衔接班)3月月考(文)化学试卷高中化学人教版 选修四 第四章 电化学基础 第一节 原电池 原电池海南省海南枫叶国际学校2018-2019学年高二下学期期中考试化学试题福建省莆田第七中学2019-2020学年高二上学期期中复习检测化学试题26.1.2 化学反应与电能——2020年春高一新人教版第二册化学一课一练2020年春高一化学新人教版第二册课后同步:6.1.2 化学反应与电能(已下线)1.2.1 原电池的工作原理 练习《新教材同步备课》(鲁科版选择性必修1)(已下线)练习13 原电池-2020-2021学年【补习教材·寒假作业】高二化学(人教版)(已下线)6.1.3 原电池原理的应用与化学电源(练好题)(基础过关)-2020-2021学年高一化学新教材新理念新设计同步课堂(人教2019必修第二册)江苏省淮安市盱眙中学2020-2021学年高一下学期第一次学情调研化学试题(已下线)【浙江新东方】双师185高一下(已下线)【浙江新东方】在线化学93高一下河北省石家庄私立第一中学2020-2021学年高一下学期第二次调研考试化学试题江苏省仪征中学2020-2021学年高一下学期4月学情检测化学试题(已下线)1.2.1 原电池的工作原理(备作业)-【上好课】2021-2022学年高二化学同步备课系列(苏教版2019选择性必修1)宁夏银川市景博中学2021-2022学年高二上学期第二次月考化学试题宁夏银川市唐徕中学2022-2023学年高二下学期3月月考化学试题5.3.2 化学变化中的能量变化(第2课时)-【帮课堂】高一化学同步精品讲义(沪科版2020必修第二册)(已下线)BBWYhjhx1110.pdf



