名校
解题方法
1 . 下列实验装置和操作能达到实验目的或者对实验装置中的现象描述正确的是
A.+测定化学反应速率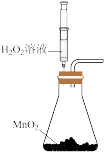 | B.锌被腐蚀、铜片上有气泡产生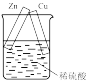 | C.探究不同催化剂对反应速率的影响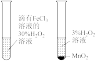 | D.组装原电池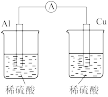 |
您最近一年使用:0次
2018-09-06更新
|
197次组卷
|
2卷引用:2018-2019学年苏教版高中化学必修二:专题综合测评2 化学反应与能量转化
23-24高一下·全国·课前预习
解题方法
2 . 化学能
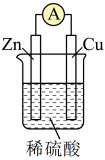
(1)如图所示,请写出锌与稀硫酸反应的化学方程式___________ 。
(2)装置中锌片上发生___________ (“氧化”或“还原”)反应,能证明化学能转化为电能的实验现象为___________ 。装置中锌片表面如何变化___________ ?电流表是否偏转___________ ?
(3)Cu的作用是___________ 。
a.离子导体 b.电子导体

(1)如图所示,请写出锌与稀硫酸反应的化学方程式
(2)装置中锌片上发生
(3)Cu的作用是
a.离子导体 b.电子导体
您最近一年使用:0次
3 . 氧化还原反应可拆分为氧化和还原两个“半反应”,某小组同学从“半反应”的角度探究反应规律。
(1)已知: 的转化在酸性条件下才能发生。
的转化在酸性条件下才能发生。
①该转化的还原半反应是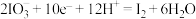 ,则相应的氧化半反应是
,则相应的氧化半反应是___________ 。
②分析上述还原半反应可知:增大 可促进
可促进 得到电子,使其
得到电子,使其___________ 性增强,进而与 发生反应。
发生反应。
(2)探究 与浓盐酸能否发生反应。
与浓盐酸能否发生反应。
①有同学认为 与浓盐酸不能发生反应产生氢气,其依据是
与浓盐酸不能发生反应产生氢气,其依据是___________ 。
用如下装置进行实验【硫酸与浓盐酸中 接近】。
接近】。
②甲实验的目的是___________ 。
③a.丙中气球变鼓是因为生成了___________ 气体(填化学式)。
b.经检测,丙中反应后溶液中存在 。从物质性质角度分析丙中反应能够发生的原因:
。从物质性质角度分析丙中反应能够发生的原因:___________ 。
(3)探究以下原电池的工作原理。
实验结果:产生电流,左侧 电极表面有
电极表面有 析出。
析出。
①该装置中左侧  电极作
电极作___________ (填“正”或“负”)极。
②写出该装置右侧 烧杯中的电极反应式___________ 。
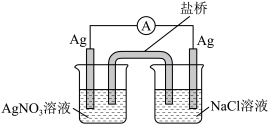
对该原电池的电极反应和总反应的反应类型进行分析,发现两极上分别发生氧化和还原反应,而总反应不一定是氧化还原反应。
③结合上述实验思考,仅由以下实验用品能否设计成原电池__________ 。
 片、
片、 浓溶液、蒸馏水、烧杯、盐桥、导线、电流表(选做下列a或b,若两个都作答,按a计分)
浓溶液、蒸馏水、烧杯、盐桥、导线、电流表(选做下列a或b,若两个都作答,按a计分)
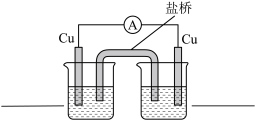
a.若能,在右装置图中填写烧杯中的试剂,并标出电子的移动方向 。
b.若不能,说明原因。
(1)已知:
 的转化在酸性条件下才能发生。
的转化在酸性条件下才能发生。①该转化的还原半反应是
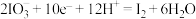 ,则相应的氧化半反应是
,则相应的氧化半反应是②分析上述还原半反应可知:增大
 可促进
可促进 得到电子,使其
得到电子,使其 发生反应。
发生反应。(2)探究
 与浓盐酸能否发生反应。
与浓盐酸能否发生反应。①有同学认为
 与浓盐酸不能发生反应产生氢气,其依据是
与浓盐酸不能发生反应产生氢气,其依据是用如下装置进行实验【硫酸与浓盐酸中
 接近】。
接近】。| 装置 | 序号 | 试管内药品 | 现象 |
 | 甲 | 浓盐酸 | 24小时后仍无明显变化 |
| 乙 |  粉+硫酸 粉+硫酸 | 24小时后仍无明显变化 | |
| 丙 |  粉+浓盐酸 粉+浓盐酸 | 24小时后气球变鼓 |
③a.丙中气球变鼓是因为生成了
b.经检测,丙中反应后溶液中存在
 。从物质性质角度分析丙中反应能够发生的原因:
。从物质性质角度分析丙中反应能够发生的原因:(3)探究以下原电池的工作原理。
实验结果:产生电流,左侧
 电极表面有
电极表面有 析出。
析出。①该装置中
 电极作
电极作②写出该装置

对该原电池的电极反应和总反应的反应类型进行分析,发现两极上分别发生氧化和还原反应,而总反应不一定是氧化还原反应。
③结合上述实验思考,仅由以下实验用品能否设计成原电池
 片、
片、 浓溶液、蒸馏水、烧杯、盐桥、导线、电流表(选做下列a或b,若两个都作答,按a计分)
浓溶液、蒸馏水、烧杯、盐桥、导线、电流表(选做下列a或b,若两个都作答,按a计分)
a.若能,在右装置图中填写烧杯中的试剂,
b.若不能,说明原因。
您最近一年使用:0次
22-23高一上·全国·课时练习
名校
4 . 用选项中的电极、溶液和如图所示装置可组成原电池。下列现象或结论的叙述正确的是
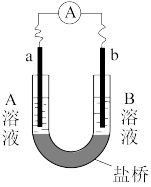

| 选项 | 电极a | 电极b | A溶液 | B溶液 | 现象或结论 |
| A | Cu | Zn | CuSO4 | ZnSO4 | 一段时间后,a增加的质量与b减少的质量相等 |
| B | Cu | Zn | 稀H2SO4 | ZnSO4 | 盐桥中阳离子向b极移动 |
| C | Fe | C | NaCl | FeCl3 | 外电路电子转移方向:b→a |
| D | C | C | FeCl3 | KI、淀粉混合液 | 若开始时只增大FeCl3溶液浓度,b极附近溶液变蓝的速度加快 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2022-12-27更新
|
434次组卷
|
3卷引用:4.1.1 原电池原理-同步学习必备知识
5 . 应用电化学原理,回答下列问题:

(1)上述三个装置中,负极反应物化学性质上的共同特点是___________ 。
(2)甲中电流计指针偏移时,盐桥(装有含琼胶的KCl饱和溶液)中离子移动的方向是___________ 。
(3)乙中正极反应式为___________ ;若将 换成
换成 ,则负极反应式为
,则负极反应式为___________ 。
(4)丙中正极的电极反应式为___________ 。
(5)应用原电池反应可以探究氧化还原反应进行的方向和程度。按下图连接装置并加入药品(盐桥中的物质不参与反应),进行实验:
ⅰ.K闭合时,指针偏移。放置一段时间后,指针偏移减小。
ⅱ.随后向U型管左侧逐渐加入浓 溶液,发现电压表指针的变化依次为:偏移减小→回到零点→逆向偏移。
溶液,发现电压表指针的变化依次为:偏移减小→回到零点→逆向偏移。
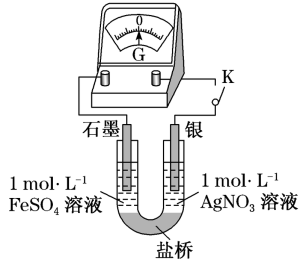
①实验ⅰ中银作___________ 极。
②综合实验ⅰ、ⅱ的现象,得出 和
和 反应的离子方程式是
反应的离子方程式是___________

(1)上述三个装置中,负极反应物化学性质上的共同特点是
(2)甲中电流计指针偏移时,盐桥(装有含琼胶的KCl饱和溶液)中离子移动的方向是
(3)乙中正极反应式为
 换成
换成 ,则负极反应式为
,则负极反应式为(4)丙中正极的电极反应式为
(5)应用原电池反应可以探究氧化还原反应进行的方向和程度。按下图连接装置并加入药品(盐桥中的物质不参与反应),进行实验:
ⅰ.K闭合时,指针偏移。放置一段时间后,指针偏移减小。
ⅱ.随后向U型管左侧逐渐加入浓
 溶液,发现电压表指针的变化依次为:偏移减小→回到零点→逆向偏移。
溶液,发现电压表指针的变化依次为:偏移减小→回到零点→逆向偏移。
①实验ⅰ中银作
②综合实验ⅰ、ⅱ的现象,得出
 和
和 反应的离子方程式是
反应的离子方程式是
您最近一年使用:0次
2022-12-02更新
|
321次组卷
|
2卷引用:北京市第二中学2022-2023学年高二上学期11月月考化学试题
解题方法
6 . 我国多条高压直流电线路的瓷绝缘子出现铁帽腐蚀现象,在铁帽上加锌环能有效防止铁帽的腐蚀。下列说法错误的是
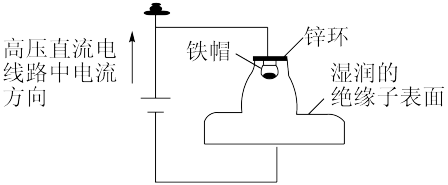

A.断电时,锌环上的电极反应为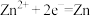 |
| B.断电时,仍能防止铁帽被腐蚀 |
| C.通电时,锌环是阳极,发生氧化反应 |
| D.通电时,该装置为外加电流的阴极保护法 |
您最近一年使用:0次
7 . 化学电源广泛地应用于现代社会的生产和生活。请回答下列问题:
(1)原电池是一种化学能转变为电能的装置,所以原电池的设计原理与某类化学反应有关。你认为下列化学反应,可以设计成原电池的是___________(填字母)。
(2)化学反应均涉及相应的能量变化,为探究这些能量变化,某同学设计了如图两个实验,已知两个实验除了是否有导线连接两个金属棒外,其余均相同。

①该同学设计这两个实验的目的是___________ 。
②有关反应一段时间后的实验现象,下列说法正确的是___________ ( 填字母)。
A.图1中温度计的示数高于图2的示数
B.图1和图2中温度计的示数相等,且均高于室温。
C.图1和图2的气泡均产生于锌棒表面
D.图2中产生气体的速率比1慢
(3)若将用导线相连在一起,总质量为80.00 g的锌片和银片同时浸入稀硫酸中,工作一段时间后,取出金属片,进行洗涤、干燥、称量,得金属片的总质量为63.75 g,则装置工作时锌片上的电极反应式为___________ ,工作时间内装置所产生氢气的体积为 ___________ L(标准状况)。
(1)原电池是一种化学能转变为电能的装置,所以原电池的设计原理与某类化学反应有关。你认为下列化学反应,可以设计成原电池的是___________(填字母)。
| A.CaO+H2O=Ca(OH)2 |
B.C+CO2 2CO 2CO |
| C.NaOH+HCl=NaCl+H2O |
| D.2FeCl3+Cu=2FeCl2+CuCl2 |

①该同学设计这两个实验的目的是
②有关反应一段时间后的实验现象,下列说法正确的是
A.图1中温度计的示数高于图2的示数
B.图1和图2中温度计的示数相等,且均高于室温。
C.图1和图2的气泡均产生于锌棒表面
D.图2中产生气体的速率比1慢
(3)若将用导线相连在一起,总质量为80.00 g的锌片和银片同时浸入稀硫酸中,工作一段时间后,取出金属片,进行洗涤、干燥、称量,得金属片的总质量为63.75 g,则装置工作时锌片上的电极反应式为
您最近一年使用:0次
2022-05-28更新
|
986次组卷
|
5卷引用:山西省运城市2021-2022学年高一下学期5月联考化学试题
山西省运城市2021-2022学年高一下学期5月联考化学试题山东省济宁市曲阜孔子高级中学2022-2023学年高一下学期4月月考化学试题(已下线)化学(人教版2019B卷)-学易金卷:2022-2023学年高一下学期期中考前必刷卷第六章 化学反应与能量(B卷·能力提升练)-【单元测试】2022-2023学年高一化学分层训练AB卷(人教版2019必修第二册)(已下线)第六章 化学反应与能量【单元测试B卷】
解题方法
8 . 实验探究:铜锌原电池的构造与工作原理
(1)实验装置示意图如下:盐桥中装有饱和的KCl、KNO3等溶液和琼胶制成的胶冻。
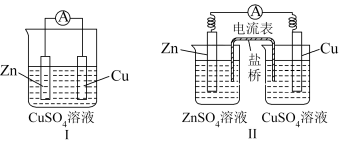
(2)【情境问题思考】
①比较铜锌原电池Ⅰ与铜锌原电池Ⅱ构成上的差异,哪一种原电池化学能转化电能的效率高___________ ?说明理由___________ ?
②铜锌原电池Ⅱ中,盐桥的作用是什么___________ ?
(1)实验装置示意图如下:盐桥中装有饱和的KCl、KNO3等溶液和琼胶制成的胶冻。

| 实验现象 | 锌片 | |
| 溶液颜色 | ||
| 取出右侧装置中的盐桥,电流表指针回到 | ||
| 能量转化 | ||
| 原因解释 | 电极名称 电极反应 | 锌电极为 |
| 铜电极为 | ||
| 电池总反应 | ||
| 电子流向 | 导线(电子导体)中,电子从 | |
| 离子移向 | 硫酸锌溶液中的 | |
| 盐桥(内有KCl)中: | ||
①比较铜锌原电池Ⅰ与铜锌原电池Ⅱ构成上的差异,哪一种原电池化学能转化电能的效率高
②铜锌原电池Ⅱ中,盐桥的作用是什么
您最近一年使用:0次
解题方法
9 . 课题式研究性学习是培养学生创造性思维的良好方法,某研究性学习小组将下列装置如图连接,C、D、E、F、X、Y都是惰性电极。将电源接通后,向乙中滴入酚酞试液,在F极附近显红色。试回答下列问题:
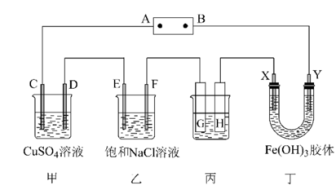
(1)电源A极的名称是___________ 。
(2)甲装置中在两极分别滴加紫色石蕊溶液,有现象的是___________ (填电极符号)。
(3)如果收集乙装置中产生的气体,两种气体的体积比是___________ 。
(4)欲用丙装置给铜镀银,G应该是___________ (填“铜”或“银”),电镀液的主要成分是___________ (填化学式)。
(5)若丙装置的两极产生气体的质量比为1∶8,则丙中的溶液可以为___________ (填化学式)。

(1)电源A极的名称是
(2)甲装置中在两极分别滴加紫色石蕊溶液,有现象的是
(3)如果收集乙装置中产生的气体,两种气体的体积比是
(4)欲用丙装置给铜镀银,G应该是
(5)若丙装置的两极产生气体的质量比为1∶8,则丙中的溶液可以为
您最近一年使用:0次
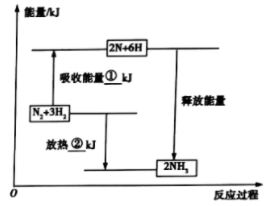
10 . (1)合成氨工业是煤化工产业链中非常重要的一步。已知有一组数据:破坏1mol氮气中的化学键需要吸收946kJ能量;破坏0.5mol氢气中的 键需要吸收218kJ能量;形成氨分子中1mol
键需要吸收218kJ能量;形成氨分子中1mol 键能够释放391kJ能量。图表示合成氨工业过程中能量的变化,请将图中①、②的能量变化的数值填在下边的横线上。
键能够释放391kJ能量。图表示合成氨工业过程中能量的变化,请将图中①、②的能量变化的数值填在下边的横线上。
①______ kJ,②_____ kJ。
(2)由A、B、C、D四种金属按如表所示装置进行实验。
根据实验现象回答下列问题:
①装置甲中负极的电极反应式为_______________ 。
②装置乙中正极的电极反应式为_______________ 。
③装置丙中溶液的pH_________ (填“变大”“变小”或“不变”)
④四种金属的活动性由强到弱的顺序是____________ 。
(3)一定温度下,在体积为2L的恒容密闭容器中充入1mol 和3mol
和3mol ,一定条件下发生反应:
,一定条件下发生反应: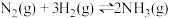 ,测得其中
,测得其中 的物质的量随时间的变化如图所示。
的物质的量随时间的变化如图所示。
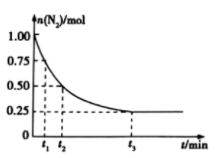
从开始反应到 min,氮气的平均反应速率为
min,氮气的平均反应速率为_________ 。
 键需要吸收218kJ能量;形成氨分子中1mol
键需要吸收218kJ能量;形成氨分子中1mol 键能够释放391kJ能量。图表示合成氨工业过程中能量的变化,请将图中①、②的能量变化的数值填在下边的横线上。
键能够释放391kJ能量。图表示合成氨工业过程中能量的变化,请将图中①、②的能量变化的数值填在下边的横线上。①

(2)由A、B、C、D四种金属按如表所示装置进行实验。
| 装置 | 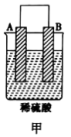 | 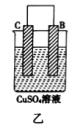 | 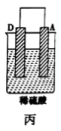 |
| 现象 | 二价金属A不断溶解 | C的质量增加 | A上有气体产生 |
①装置甲中负极的电极反应式为
②装置乙中正极的电极反应式为
③装置丙中溶液的pH
④四种金属的活动性由强到弱的顺序是
(3)一定温度下,在体积为2L的恒容密闭容器中充入1mol
 和3mol
和3mol ,一定条件下发生反应:
,一定条件下发生反应: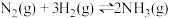 ,测得其中
,测得其中 的物质的量随时间的变化如图所示。
的物质的量随时间的变化如图所示。
从开始反应到
 min,氮气的平均反应速率为
min,氮气的平均反应速率为
您最近一年使用:0次



