名校
解题方法
1 . I.水体酸化也是重要的环境污染问题,会造成水生动植物死亡。NaOH中和法是消除水体酸化的重要方法之一。25℃时,向某厂含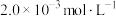 氢氟酸的废水(假设除HF外不含其它溶质)中,加入NaOH固体(忽略体积变化),得到
氢氟酸的废水(假设除HF外不含其它溶质)中,加入NaOH固体(忽略体积变化),得到 、
、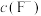 与溶液pH的变化关系,如图所示:
与溶液pH的变化关系,如图所示:
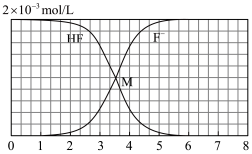
(1)两曲线交点M的纵坐标数值=___________ 。
(2)25℃时,若HF电离平衡常数为Ka,则Ka的负对数pKa=___________ 。
Ⅱ.废液中的重金属离子浓度可以用浓差电池进行测得:工作时,电池的“浓差”会逐渐减小。下图是某浓差电池的示意图:
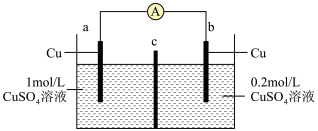
(3)a电极为___________。
(4)c膜为___________ 交换膜。
A.阴离子 B.阳离子 C.质子
(5)若此时图中电流表示数为0.01A,若将右槽中0.2mol/L的 溶液换成含
溶液换成含
 mol/L的工业废水,则此时电流表示数将
mol/L的工业废水,则此时电流表示数将___________ 0.01A。
A.大于 B.小于 C.等于
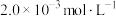 氢氟酸的废水(假设除HF外不含其它溶质)中,加入NaOH固体(忽略体积变化),得到
氢氟酸的废水(假设除HF外不含其它溶质)中,加入NaOH固体(忽略体积变化),得到 、
、 与溶液pH的变化关系,如图所示:
与溶液pH的变化关系,如图所示:
(1)两曲线交点M的纵坐标数值=
(2)25℃时,若HF电离平衡常数为Ka,则Ka的负对数pKa=
Ⅱ.废液中的重金属离子浓度可以用浓差电池进行测得:工作时,电池的“浓差”会逐渐减小。下图是某浓差电池的示意图:

(3)a电极为___________。
| A.正极 | B.负极 | C.阳极 | D.阴极 |
(4)c膜为
A.阴离子 B.阳离子 C.质子
(5)若此时图中电流表示数为0.01A,若将右槽中0.2mol/L的
 溶液换成含
溶液换成含
 mol/L的工业废水,则此时电流表示数将
mol/L的工业废水,则此时电流表示数将A.大于 B.小于 C.等于
您最近一年使用:0次
2 . 广泛使用的消毒剂
Ⅰ.消毒剂可用于餐饮、衣物、环境消毒等,是生产生活中常用物品。常见的“84”消毒液、O3等都有较强的杀菌效果,可杀灭很多常见病毒。
(1)“84”消毒液的主要成分为NaClO,该消毒液___________。(双选)
(2)化学电池应用广泛,某电池企业通过回收废旧电池生产消毒液。
①如图Cu-Zn原电池中,导线中电子流向___________ 片(填 “Zn”或“Cu”)。Cu片上发生___________ 反应(填 “氧化”或“还原”)。
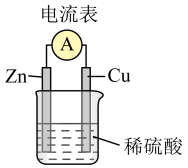
②若将铜片换成铁片,电流方向___________ 改变(填 “会”或“不会”)。
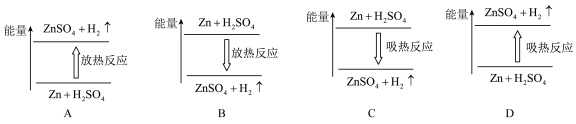
(3)若断开电路,则该反应中能量变化示意图正确的是___________ 。
Ⅱ.O3是一种清洁消毒剂,常温常压下在水溶液中发生的反应如下:2O3 3O2放热反应,下表为一定条件下,O3起始浓度为0.0216 mol•L-1时,O3浓度减少一半所需的时间。
3O2放热反应,下表为一定条件下,O3起始浓度为0.0216 mol•L-1时,O3浓度减少一半所需的时间。
(4)30°C、pH=5.0时,O3的平均反应速率为___________ 。
(5)若反应达平衡后降温,则平衡向___________ 移动,正反应速率___________ (填“增大”“减小”或“不变”)。
(6)大气中臭氧层能吸收和阻挡大部分紫外线进入地球。但氯原子能破坏臭氧层,其破坏过程如图所示,下列说法错误的是___________
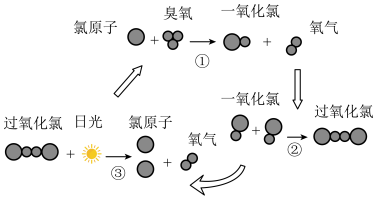
(7)一些含硫物质也能做消毒剂。硫位于元素周期表中第___________ 周期,第___________ 族。用一个化学事实比较Cl和S的非金属性强弱___________ 。
Ⅰ.消毒剂可用于餐饮、衣物、环境消毒等,是生产生活中常用物品。常见的“84”消毒液、O3等都有较强的杀菌效果,可杀灭很多常见病毒。
(1)“84”消毒液的主要成分为NaClO,该消毒液___________。(双选)
| A.电离方程式:NaClO=Na+ + Cl- + O2- |
| B.和稀盐酸反应的产物无漂白性 |
| C.属于强电解质 |
| D.具有强氧化性 |
①如图Cu-Zn原电池中,导线中电子流向

②若将铜片换成铁片,电流方向
(3)若断开电路,则该反应中能量变化示意图正确的是

Ⅱ.O3是一种清洁消毒剂,常温常压下在水溶液中发生的反应如下:2O3
 3O2放热反应,下表为一定条件下,O3起始浓度为0.0216 mol•L-1时,O3浓度减少一半所需的时间。
3O2放热反应,下表为一定条件下,O3起始浓度为0.0216 mol•L-1时,O3浓度减少一半所需的时间。| pH t/min T/℃ | 3.0 | 4.0 | 5.0 |
| 20 | 301 | 231 | 169 |
| 30 | 158 | 108 | 54 |
| 50 | 35 | 26 | 15 |
(5)若反应达平衡后降温,则平衡向
(6)大气中臭氧层能吸收和阻挡大部分紫外线进入地球。但氯原子能破坏臭氧层,其破坏过程如图所示,下列说法错误的是___________

| A.反应中Cl作催化剂 |
| B.过氧化氯的分子式为:Cl2O2 |
| C.过氧化氯的结构式为:O-Cl-Cl-O |
| D.该过程中能量转化形式只有一种 |
您最近一年使用:0次
名校
解题方法
3 . 汽车的启动电源常用铅酸蓄电池,其结构如图所示。放电时的电池反应:PbO2 + Pb + 2H2SO4 = 2PbSO4 + 2H2O。下列说法中,正确的是
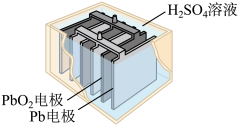
| A.Pb作电池的负极 |
| B.PbO2作电池的负极 |
| C.PbO2得电子,被氧化 |
| D.电池放电时,溶液酸性增强 |
您最近一年使用:0次
2023-04-30更新
|
1485次组卷
|
40卷引用:上海市洋泾中学2022-2023学年高二下学期(等级)期末考试化学试题
上海市洋泾中学2022-2023学年高二下学期(等级)期末考试化学试题黑龙江省佳木斯市实验中学2021-2022学年高二上学期期末考试化学试题黑龙江省佳木斯市三校联考2023-2024学年高二上学期1月期末化学试题课时2 化学电源——A学习区 夯实基础(苏教版必修2)黑龙江省伊春市伊美区第二中学2020-2021学年高二上学期第一次月考化学试题辽宁省辽河油田第二高级中学2020-2021学年高二上学期期中考试化学试题北京市西城区2020-2021学年高一下学期期末联考化学试题重庆市西北狼教育联盟2021-2022学年高二上学期开学质量检测化学试题安徽省蚌埠第三中学2021-2022学年高二上学期10月教学质量检测化学试题(已下线)第5章 金属及其化合物(章末复习)-【帮课堂】2021-2022学年高一化学同步精品讲义(沪科版2020必修第二册)青海省西宁市2021-2022学年高一下学期期末考试化学试题新疆和田地区民丰县2022-2023学年高二上学期11月期中考试化学试题上海市育才中学2023-2024学年高三上学期10月第一次质量调研(等级考)化学试题北京市第二十中学2021-2022学年高一下学期期末考试化学试题新疆喀什地区疏勒县疏勒县实验学校2023-2024学年高二上学期12月月考化学试题2015-2016学年甘肃省天水一中高一下期中文科化学试卷步步为赢 高一化学暑假作业:作业七 化学能与电能6.1.2 化学反应与电能——2020年春高一新人教版第二册化学一课一练2020年春高一化学新人教版第二册课后同步:6.1.2 化学反应与电能吉林省延边市长白山第一高级中学2019-2020学年高一下学期验收考试化学试题湖南省娄底市第一中学2019-2020学年高一下学期第一次月考化学试题甘肃省平凉市庄浪县第一中学2019-2020学年高一下学期期中考试化学试题(人教版2019)必修第二册 第六章 化学反应与能量 第一节 化学反应与能量变化人教版2019必修第二册 第六章 第一节 第3课时 化学电池(已下线)6.1.3 原电池原理的应用与化学电源(练好题)(基础过关)-2020-2021学年高一化学新教材新理念新设计同步课堂(人教2019必修第二册)云南省大关县第一中学2020-2021学年高一下学期6月份考试化学试题福建省福州第四中学2021-2022学年高一下学期3月月考化学试题课中-6.1.3 设计原电池、化学电源-人教2019必修第二册广东省云浮市云安区云安中学2021-2022学年高一下学期第一次统测化学试题新疆乌苏市第一中学2021-2022学年高一下学期期中考试化学试题(平行班)北京市第十四中学2022-2023学年高一下学期期中化学试题北京市第十三中学2022-2023学年高一下学期期中考试化学试题北京市第三中学2022-2023学年高一下学期期中考试化学试题北京市回民学校2022-2023学年高一下学期期中考试化学试题广东省东莞东方明珠学校2021-2022学年高一下学期期中考试化学试题第3课时 化学电源(已下线)第04讲 化学反应与能量变化-【寒假自学课】2024年高一化学寒假提升学与练(人教版2019)(已下线)专题05 化学反应与能量变化(考题猜想)(8大题型)-2023-2024学年高一化学下学期期中考点大串讲(人教版2019必修第二册)(已下线)6.1.2 化学反应与电能6.1.2 化学反应与电能 课堂例题
名校
4 . 海水电池在海洋能源领域应用广泛,各种金属铝、镁、钠、锂都可以作为海水电池的电极材料。下列说法错误的是
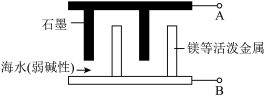

| A.A极为正极,海水中盐分大,可作为电解质溶液 |
B.正极发生的电极反应只有: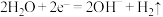 |
| C.采用钠、锂等活泼金属作电极,要注意防止与海水直接接触 |
| D.通常海水电池都属于一次电池 |
您最近一年使用:0次
2023-02-21更新
|
1003次组卷
|
4卷引用:上海市复旦大学附属中学2022-2023学年高二下学期期末等级性考试化学试题
上海市复旦大学附属中学2022-2023学年高二下学期期末等级性考试化学试题山东省2022-2023学年高三高考考向核心卷化学试题(已下线)专题卷14 新型化学电源装置-【小题小卷】冲刺2023年高考化学小题限时集训(新高考专用)(已下线)T12-电化学原理
名校
解题方法
5 . 原电池原理的发现是储能和供能技术的巨大进步,是化学对人类的一项重大贡献。
(1)现有如下两个反应:A.Zn+CuSO4=ZnSO4+Cu B.2NaOH+H2SO4=Na2SO4+2H2O,判断能否设计成原电池A._______ ,B. _______ 。(填“能”或“不能”)
(2)将纯锌片和纯铜片按图方式插入100mL相同浓度的稀硫酸中一段时间。
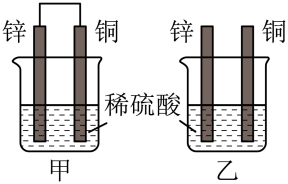
下列说法正确的是_______。
(3)请写出图中构成原电池的正极电极反应式_______ 。
(4)电池工作时,溶液中SO 向
向_______ 极移动(填“锌”或“铜”);电池工作完成后,溶液中SO 浓度
浓度_______ (填“增大”“减小”或“不变”)。
(5)化学能可与热能、电能等相互转化。下列表述错误的是_______。
(1)现有如下两个反应:A.Zn+CuSO4=ZnSO4+Cu B.2NaOH+H2SO4=Na2SO4+2H2O,判断能否设计成原电池A.
(2)将纯锌片和纯铜片按图方式插入100mL相同浓度的稀硫酸中一段时间。

下列说法正确的是_______。
| A.甲、乙装置均实现了化学能转变为电能 |
| B.甲中铜片上有气体产生,铜片发生了氧化反应 |
| C.两烧杯中反应原理相同,稀硫酸起始浓度相同,因而反应速率相同 |
| D.两烧杯溶液中的H+均被消耗,因而H+浓度减小 |
(4)电池工作时,溶液中SO
 向
向 浓度
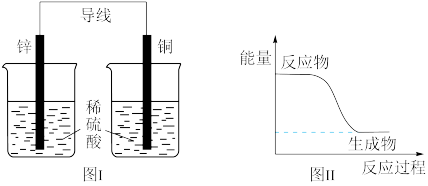
浓度(5)化学能可与热能、电能等相互转化。下列表述错误的是_______。

| A.化学反应中能量变化的主要原因是化学键的断裂与形成 |
| B.酸碱中和反应中,反应物的总能量比生成物的总能量高 |
| C.图I所示的装置能将化学能转变为电能 |
| D.图II所示的反应为放热反应 |
您最近一年使用:0次
2023-01-12更新
|
337次组卷
|
2卷引用:上海市闵行(文绮)中学2022-2023学年高二上学期期末学情调研化学试题
名校
解题方法
6 . 燃料电池可以将燃料的化学能直接转化为电能,能量利用率高。
(1)碱性燃料电池(AFC)是最早进入实用阶段的燃料电池之一,也是最早用于车辆的燃料电池,以KOH、NaOH溶液之类的强碱性溶液为电解质溶液。其优点为性能可靠,具有较高的效率。甲烷碱性燃料电池正极的电极反应式为_______
(2)某燃料电池主要构成要素如图所示
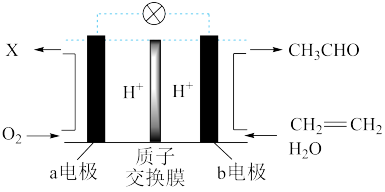
电流方向为__ ;电池工作时,X为___ ; a电极的反应式为___ ; b电极的反应式为____ 。
(1)碱性燃料电池(AFC)是最早进入实用阶段的燃料电池之一,也是最早用于车辆的燃料电池,以KOH、NaOH溶液之类的强碱性溶液为电解质溶液。其优点为性能可靠,具有较高的效率。甲烷碱性燃料电池正极的电极反应式为
(2)某燃料电池主要构成要素如图所示

电流方向为
您最近一年使用:0次
名校
解题方法
7 . 对如图实验现象描述或分析正确的是
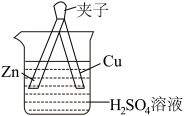

| A.溶液变蓝色 | B. 片上有气泡 片上有气泡 |
C.一段时间后,溶液的 减小 减小 | D. 是氧化剂 是氧化剂 |
您最近一年使用:0次
2023-01-11更新
|
421次组卷
|
2卷引用:上海市华东师范大学第一附属中学2022-2023学年高二上学期1月期末考试化学试题
名校
解题方法
8 . 原电池揭示了氧化还原反应的本质是电子转移,实现了化学能转化成电能,使氧化还原反应在现代生活中获得重大应用,从而改变了人们的生活方式。
某兴趣小组为探究原电池工作原理,利用金属Zn与稀H2SO4反应,通过如图所示装置A、B进行实验,实验过程中装置A内溶液的温度升高,装置B的电流计指针发生偏转。
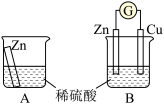
根据所学知识,完成下列各题:
(1)装置B为原电池,则Cu作_______ (填“正”或“负”)极,Zn电极上的电极反应式为_______ ,Cu电极上的现象是_______ 。请简述确定Cu电极没有参与反应的实验依据或方案_______ 。
(2)一般把金属导线称为“电子导体”,把电解质溶液称为“离子导体”。装置B中电池工作时“电子导体”中电子的流动方向可描述为_______ ;“离子导体”中主要离子的移动方向可描述为_______ 。
(3)从能量转化的角度来看,装置A中反应物的总能量_______ (填“高于”、“低于”或“=”)生成物的总能量;从反应速率的角度上看,可以观察到A中反应比B中_______ (填“快”或“慢”)。
(4)装置B中稀H2SO4用足量CuSO4溶液代替,起始时Zn电极和Cu电极的质量相等,当导线中有0.2mol电子转移时,Zn电极和Cu电极的质量差为_______ 。
(5)该小组同学由此得出的结论错误的是_______。(多选)
某兴趣小组为探究原电池工作原理,利用金属Zn与稀H2SO4反应,通过如图所示装置A、B进行实验,实验过程中装置A内溶液的温度升高,装置B的电流计指针发生偏转。

根据所学知识,完成下列各题:
(1)装置B为原电池,则Cu作
(2)一般把金属导线称为“电子导体”,把电解质溶液称为“离子导体”。装置B中电池工作时“电子导体”中电子的流动方向可描述为
(3)从能量转化的角度来看,装置A中反应物的总能量
(4)装置B中稀H2SO4用足量CuSO4溶液代替,起始时Zn电极和Cu电极的质量相等,当导线中有0.2mol电子转移时,Zn电极和Cu电极的质量差为
(5)该小组同学由此得出的结论错误的是_______。(多选)
| A.任何自发进行的氧化还原反应均可以设计成原电池 |
| B.装置B中Cu电极不可用碳棒代替 |
| C.原电池的负极发生还原反应 |
| D.原电池装置中化学能全部转化为电能 |
您最近一年使用:0次
2022-12-11更新
|
808次组卷
|
3卷引用:上海市致远高级中学2022-2023学年高二上学期期末教学评估化学等级考试题
9 . 已知 的氧化性大于
的氧化性大于 。根据如图所示装置可构成原电池(盐桥中装有含琼脂的饱和
。根据如图所示装置可构成原电池(盐桥中装有含琼脂的饱和 溶液),下列叙述错误的是
溶液),下列叙述错误的是
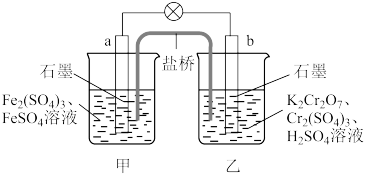
 的氧化性大于
的氧化性大于 。根据如图所示装置可构成原电池(盐桥中装有含琼脂的饱和
。根据如图所示装置可构成原电池(盐桥中装有含琼脂的饱和 溶液),下列叙述错误的是
溶液),下列叙述错误的是
| A.a为原电池的负极,b为原电池的正极 |
B.电池工作时,盐桥中的 移向甲烧杯 移向甲烧杯 |
C.a极的电极反应式为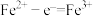 |
D.工作一段时间后,乙烧杯中溶液的 减小(忽略溶液体积变化) 减小(忽略溶液体积变化) |
您最近一年使用:0次
2022-10-27更新
|
359次组卷
|
2卷引用:上海市七宝中学2022-2023学年高二下学期期末考试化学试题
名校
解题方法
10 . 关于如图所示的原电池甲和乙,下列说法正确的是
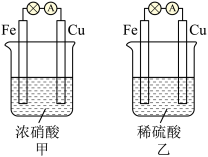

| A.甲、乙中铜片上均发生还原反应 | B.两池中铁片均发生反应:Fe-2e-=Fe2+ |
| C.装置甲中电子由Cu→灯泡→Fe | D.两池所得Fe、Cu金属活泼性相反 |
您最近一年使用:0次
2022-09-06更新
|
447次组卷
|
6卷引用:上海市市西中学2023-2024学年高二上学期期末化学模拟试卷
上海市市西中学2023-2024学年高二上学期期末化学模拟试卷江西省省重点校联盟2022-2023学年高二上学期入学联考化学试题(已下线)4.1.1 原电池的工作原理-2022-2023学年高二化学上学期课后培优分级练(人教版2019选择性必修1)陕西省延安市第一中学2022-2023学年高二上学期第一次月考(B卷)化学试题黑龙江省绥化市庆安县第一中学2022-2023学年高二上学期期中考试化学试题黑龙江省绥化市庆安县第一中学2022-2023学年高二上学期期中考试化学试题



