1 . 微型纽扣电池在现代生活中被广泛应用,有一种银锌电池,其电极分别是Ag2O和Zn,电解质溶液为KOH溶液,总反应为Ag2O+Zn+H2O=Zn(OH)2+2Ag,其中一个电极反应式为Ag2O+H2O+2e-=2Ag+2OH-。
(1)负极材料为_______ ,正极材料为_______ 。
(2)电池工作时,电子由_______ (填“正极”或“负极”,下同)流向_______ ,溶液中的阳离子流向电池的_______ ,阴离子流向电池的_______ 。
(3)甲醇(CH3OH)燃料电池为绿色化学电源,在NaOH溶液为电解质溶液时的负极反应式为_______ ,正极反应式为_______ 。该电池工作时,外电路每流过1×103mole-,消耗标准状况下氧气_______ L。
(1)负极材料为
(2)电池工作时,电子由
(3)甲醇(CH3OH)燃料电池为绿色化学电源,在NaOH溶液为电解质溶液时的负极反应式为
您最近一年使用:0次
名校
解题方法
2 . 请根据所学知识,回答下列问题:
某学习小组用如下图所示装置A、B分别探究金属锌与稀硫酸的反应,实验过程中A烧杯内的溶液温度升高,B烧杯的电流计指针发生偏转,请回答以下问题。
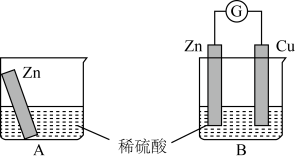
(1)B中Zn板是___________ 极,正极发生的电极反应是___________
(2)该小组同学反思原电池的原理,其中观点正确的是___________;
(3)在B中,当导线中有1 mol电子通过时,理论上的两极变化是___________。
(4)若将反应2Fe3++Cu=Cu2++2Fe2+设计成原电池,写出正极电极反应式___________ ;
(5)写出碱性氢氧燃料电池正极电极反应式___________
(6)写出酸性乙醇(C2H5OH)燃料电池负极电极反应式___________
(7)写出铜片和铝片插入浓硝酸溶液中的正极反应为:___________
某学习小组用如下图所示装置A、B分别探究金属锌与稀硫酸的反应,实验过程中A烧杯内的溶液温度升高,B烧杯的电流计指针发生偏转,请回答以下问题。
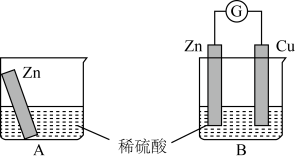
(1)B中Zn板是
(2)该小组同学反思原电池的原理,其中观点正确的是___________;
| A.原电池反应的过程中一定有电子转移 |
| B.电极一定不能参加反应 |
| C.原电池装置中的电子流向:负极→外线路→正极→电解质→负极 |
| D.氧化反应和还原反应可以拆开在两极发生 |
| A.锌片溶解32.5 g | B.锌片增重32.5 g |
| C.铜片上析出2 g H2 | D.铜片上析出1 mol H2 |
(5)写出碱性氢氧燃料电池正极电极反应式
(6)写出酸性乙醇(C2H5OH)燃料电池负极电极反应式
(7)写出铜片和铝片插入浓硝酸溶液中的正极反应为:
您最近一年使用:0次
3 . I.化学反应的快慢和限度对人类生产、生活有重要的影响。800°C时,A、B、C三种气体在恒容密闭容器中反应时的浓度变化如图所示,回答下列问题:
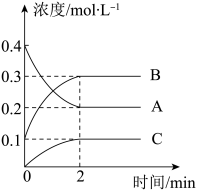
(1)该反应的生成物是_______ 。
(2)2min内,C的反应速率为________ 。
(3)该条件下,为加快反应速率,下列措施不可行的是_______(填选项)。
II.一种微生物电池处理含氮( )废水的装置如图所示:。
)废水的装置如图所示:。
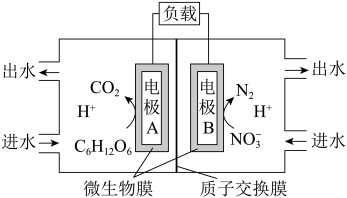
(4)电极A是_______ (填“正”或“负”)极,其电极反应式为_______ ;电极B上发生_______ 反应(填“氧化”或“还原”)。
(5)工作过程中,H+通过质子交换膜向电极_______ (填“A”或“B”)方向移动;电路中每转移2mol电时,产生氮气的体积在标准状况下是_______ L。

(1)该反应的生成物是
(2)2min内,C的反应速率为
(3)该条件下,为加快反应速率,下列措施不可行的是_______(填选项)。
| A.增大A的量 | B.通入稀有气体Ar |
| C.加入合适的催化剂 | D.压缩容器体积 |
II.一种微生物电池处理含氮(
 )废水的装置如图所示:。
)废水的装置如图所示:。
(4)电极A是
(5)工作过程中,H+通过质子交换膜向电极
您最近一年使用:0次
解题方法
4 . 将A、B两个电极,分别用接线柱平行地固定在一块塑料板上,与电流表连结,插入盛有溶液C的小烧杯中。试回答下列问题:
(1)若A、B分别为铜和铝C为浓 ,原电池的负极为
,原电池的负极为_______ (填“铝”或“铜”)极,铝片上的电极反应式为:_______ 。
(2)若A、B分别为镁和铝,C为氢氧化钠溶液,原电池的负极为_______ (填“铝”或“镁”)极铝片上的电极反应式为:_______ 。
(3)若A、B分别为碳和铝,C为氯化钠溶液,原电池正极上的电极反应式为:_______ 。
(1)若A、B分别为铜和铝C为浓
 ,原电池的负极为
,原电池的负极为(2)若A、B分别为镁和铝,C为氢氧化钠溶液,原电池的负极为
(3)若A、B分别为碳和铝,C为氯化钠溶液,原电池正极上的电极反应式为:
您最近一年使用:0次
名校
解题方法
5 . 一种新型的燃料电池可用于制取乙醛(CH3CHO),总反应式为 ,电池的主要构成要素如图所示,请回答下列问题:
,电池的主要构成要素如图所示,请回答下列问题:
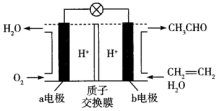
(1)该装置的能量转化形式为_______ 。
(2)a电极为燃料电池的_______ 极,该电极的电极反应式为_______ 。
(3)电池工作时,H+由_______ (填“a电极”或“b电极”,下同)移向_______ 。
(4)生成3.3g乙醛时,需要消耗标准状况下的氧气_______ mL。
 ,电池的主要构成要素如图所示,请回答下列问题:
,电池的主要构成要素如图所示,请回答下列问题:
(1)该装置的能量转化形式为
(2)a电极为燃料电池的
(3)电池工作时,H+由
(4)生成3.3g乙醛时,需要消耗标准状况下的氧气
您最近一年使用:0次
2021-04-24更新
|
241次组卷
|
3卷引用:四川省广安代市中学校2020-2021学年高一下学期第三次月考化学试题
名校
解题方法
6 . 如图为原电池装置示意图:
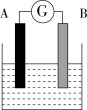
(1)若A为Zn,B为石墨棒,电解质溶液为稀硫酸,则A为________ 极(填正或负),写出电极反应式:正极_______________________ ,负极________________________ .总反应为:____________________ 。
(2)若A为铜片,B为铁片,电解质为FeCl3溶液,则A为________ 极(填正或负),写出电极反应式:正极_____________________________ ,负极________________________ .总反应为:_______________________________ 。
(3)若A、B均为铂片,电解质为KOH溶液,分别从A、B两极通入H2和O2,该电池即为燃料电池,通入氧气的一极为该电池的________ 极(填正或负),该电池的总反应为:____________________

(1)若A为Zn,B为石墨棒,电解质溶液为稀硫酸,则A为
(2)若A为铜片,B为铁片,电解质为FeCl3溶液,则A为
(3)若A、B均为铂片,电解质为KOH溶液,分别从A、B两极通入H2和O2,该电池即为燃料电池,通入氧气的一极为该电池的
您最近一年使用:0次
2020-04-19更新
|
410次组卷
|
2卷引用:四川省遂宁市船山区第二中学校2019-2020学年高一下学期期中考试化学试题
名校
解题方法
7 . 原电池原理的发现是储能和供能技术的巨大进步,是化学对人类的一项重大贡献。
(1)将纯锌片和纯铜片按图方式插入100 mL相同浓度的稀硫酸中一段时间,回答下列问题:
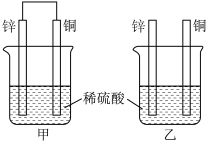
①下列说法正确的是________ 。
A 甲、乙均为化学能转变为电能的装置
B 乙中铜片上没有明显变化
C 甲中铜片质量减少、乙中锌片质量减少
D 两烧杯中溶液的 pH 均增大
②在相同时间内, 两烧杯中产生气泡的速度:甲________ 乙(填“>”“<”或“=”)。
③请写出图中构成原电池的负极电极反应式:________________________________ 。
④当甲中溶液质量增重31.5 g时,电极上转移电子数目为________ 。
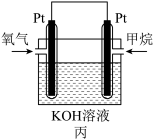
(2)图丙为甲烷氧气燃料电池的构造示意图,电解质溶液的溶质是KOH。通甲烷一极的电极反应方程式为____________________________________________________________ 。
(1)将纯锌片和纯铜片按图方式插入100 mL相同浓度的稀硫酸中一段时间,回答下列问题:


①下列说法正确的是
A 甲、乙均为化学能转变为电能的装置
B 乙中铜片上没有明显变化
C 甲中铜片质量减少、乙中锌片质量减少
D 两烧杯中溶液的 pH 均增大
②在相同时间内, 两烧杯中产生气泡的速度:甲
③请写出图中构成原电池的负极电极反应式:
④当甲中溶液质量增重31.5 g时,电极上转移电子数目为
(2)图丙为甲烷氧气燃料电池的构造示意图,电解质溶液的溶质是KOH。通甲烷一极的电极反应方程式为
您最近一年使用:0次
2018-06-26更新
|
1175次组卷
|
12卷引用:【全国百强校】四川省绵阳市南山中学2017-2018学年高一下学期期末模拟考试(6月)化学试题
【全国百强校】四川省绵阳市南山中学2017-2018学年高一下学期期末模拟考试(6月)化学试题四川省眉山市东坡区多悦高级中学校2019-2020学年高一下学期期中考试化学试题吉林省长春汽车经济开发区第六中学2017-2018学年高一下学期期末考试化学试题云南省文山州马关县二中2018-2019学年 高一下学期6月份考试化学试题2020年春季苏教版高中化学必修2专题二《化学反应与能量转化》测试卷江西省湘东中学2019~2020学年高一下学期期中化学线上能力测试化学试题江西省南丰县第二中学2019-2020学年高一下学期4月线上测试化学试题江西省南昌市新建一学2019-2020学年高一下学期线上期中考试化学试题(已下线)【南昌新东方】2020 新建一中 高一(下) 期中 006山西省古县第一中学2019-2020学年高一下学期期中考试化学试题江西省新余市第一中学2019-2020学年高一下学期5月段考化学试题山西省忻州市2022-2023学年高一下学期4月期中考试化学试题
10-11高一下·黑龙江鹤岗·期中
名校
8 . 铅蓄电池是常用的化学电源,其电极材料是Pb和PbO2,电解液为稀硫酸。工作时该电池总反应式为:PbO2 + Pb + 2H2SO4="=" 2PbSO4+ 2H2O,据此判断:
(1)铅蓄电池的负极材料是________ 。
(2)工作时正极反应为________________________________ 。
(3)工作时,电解质溶液的PH________ (填“增大”、“减小”或“不变”)
(4)工作时,电解质溶液中阴离子移向________ 极;电流方向从________ 极流向________ 极。(填正,负)
(1)铅蓄电池的负极材料是
(2)工作时正极反应为
(3)工作时,电解质溶液的PH
(4)工作时,电解质溶液中阴离子移向
您最近一年使用:0次
真题
名校
9 . Li—SOCl2电池可用于心脏起搏器。该电池的电极材料分别为锂和碳,电解质溶液是LiAlCl4—SOCl2。电池的总反应可表示为4Li+2SOCl2===4LiCl+S+SO2↑。请回答下列问题:
(1)电池的负极材料为________ ,发生的电极反应为__________________ 。
(2)电池正极发生的电极反应为___________________________ 。
(3)SOCl2易挥发,实验室中常用NaOH溶液吸收SOCl2,有Na2SO3和NaCl生成。如果把少量水滴到SOCl2中,实验现象是___________________ ,反应的化学方程式为______ 。
(4)组装该电池必须在无水、无氧的条件下进行,原因是__________________ 。
(1)电池的负极材料为
(2)电池正极发生的电极反应为
(3)SOCl2易挥发,实验室中常用NaOH溶液吸收SOCl2,有Na2SO3和NaCl生成。如果把少量水滴到SOCl2中,实验现象是
(4)组装该电池必须在无水、无氧的条件下进行,原因是
您最近一年使用:0次
2016-12-09更新
|
2943次组卷
|
21卷引用:2012-2013学年四川省成都七中高一下学期期末考试化学试卷
(已下线)2012-2013学年四川省成都七中高一下学期期末考试化学试卷(已下线)2010—2011浙江省嘉兴一中高一下学期期中考试化学试卷江西省南昌市八一中学、洪都中学、麻丘中学等六校2016-2017学年高一5月联考化学试题高中化学人教版 选修四 第四章 电化学基础 第二节 化学电源 化学电源2017-2018学年高一化学人教版必修2:第二章检测题(已下线)2019年3月24日 《每日一题》 必修2 每周一测人教版本必修二高中化学第二章《化学反应与能量》测试卷云南省新平一中2020-2021学年高一下学期期中考试化学试题课后-6.1.3 设计原电池、化学电源-人教2019必修第二册湖北省襄阳市襄州区第二高级中学2021-2022学年高一下学期期中考试化学试题山东省临沂第四中学2022-2023学年高一下学期6月月考化学试题2009年普通高等学校招生统一考试化学试题(海南卷)(已下线)2011-2012学年江苏省南京三中高二下学期期末考试化学选修试卷2015-2016学年河北省文安一中高二上学期第一次月考化学试卷(已下线)同步君 选修4 第4章 第2节 化学电源陕西省西安市长安区第一中学2017-2018学年高二上学期第二次月考化学试题(已下线)2018年11月26日 《每日一题》人教选修4 - 一次电池的工作原理(已下线)2019年11月25日《每日一题》化学人教版(选修4)—— 一次电池的工作原理2020届高考化学二轮复习大题精准训练——高考大题中方程式(电极、氧化还原、热化学)书写专练(已下线)1.2.2 化学电源 练习《新教材同步备课》(鲁科版选择性必修1)(已下线)1.2.2 化学电源(备作业)-【上好课】2021-2022学年高二化学同步备课系列(苏教版2019选择性必修1)
10-11高一下·四川·阶段练习
10 . 按要求完成下列原电池电极反应式或总反应的化学方程式。
(1)负极(Fe)______ ;正极(石墨)______ 电解质溶液(稀硫酸)总反应______
(2)负极(Cu)______ ; 正极(石墨)______ 电解质溶液(FeCl3溶液)总反应______
(3)用Fe和Cu作电极材料,以浓HNO3为电解质溶液构成的原电池,则负极的电极反应式为______ ;总反应为______
(1)负极(Fe)
(2)负极(Cu)
(3)用Fe和Cu作电极材料,以浓HNO3为电解质溶液构成的原电池,则负极的电极反应式为
您最近一年使用:0次



