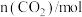I.化学反应的快慢和限度对人类生产、生活有重要的影响。800°C时,A、B、C三种气体在恒容密闭容器中反应时的浓度变化如图所示,回答下列问题:
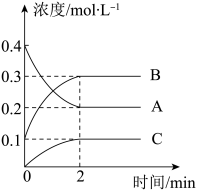
(1)该反应的生成物是_______ 。
(2)2min内,C的反应速率为________ 。
(3)该条件下,为加快反应速率,下列措施不可行的是_______(填选项)。
II.一种微生物电池处理含氮( )废水的装置如图所示:。
)废水的装置如图所示:。
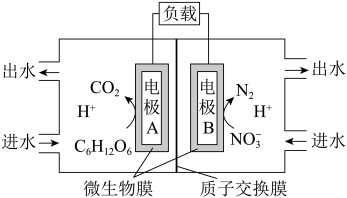
(4)电极A是_______ (填“正”或“负”)极,其电极反应式为_______ ;电极B上发生_______ 反应(填“氧化”或“还原”)。
(5)工作过程中,H+通过质子交换膜向电极_______ (填“A”或“B”)方向移动;电路中每转移2mol电时,产生氮气的体积在标准状况下是_______ L。

(1)该反应的生成物是
(2)2min内,C的反应速率为
(3)该条件下,为加快反应速率,下列措施不可行的是_______(填选项)。
| A.增大A的量 | B.通入稀有气体Ar |
| C.加入合适的催化剂 | D.压缩容器体积 |
II.一种微生物电池处理含氮(
 )废水的装置如图所示:。
)废水的装置如图所示:。
(4)电极A是
(5)工作过程中,H+通过质子交换膜向电极
更新时间:2022-07-10 18:48:03
|
相似题推荐
填空题
|
适中
(0.65)
名校
【推荐1】某化学反应2A⇌B+D在四种不同条件下进行,B、D起始浓度为0.反应物A的浓度(mol·L-1)随反应时间(min)的变化情况如下表:
根据上述数据,完成下列填空:
(1)在实验1,反应在10至20min时间内平均速率为___________ mol·(L·min)-1。
(2)在实验2中A的初始浓度C2=___________ mol·L-1,反应经20min就达到平衡,可推测实验2中还隐含的条件是___________ 。
(3)设实验3的反应速率为v3,实验1的反应速率为v1,则v3___________ v1(填“>”“=”或“<”=,且C3___________ 1.0mol·L-1(填“>”“=”或“<”=)。
(4)比较实验4和实验1,可推测该反应是___________ 反应(选填“吸热”或“放热”),理由是___________ 。
| 实验 序号 | 时间 浓度 温度 | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
| 1 | 800℃ | 1.0 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50 | 0.50 |
| 2 | 800℃ | C2 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 |
| 3 | 800℃ | C3 | 0.92 | 0.75 | 0.63 | 0.60 | 0.60 | 0.60 |
| 4 | 820℃ | 1.0 | 0.40 | 0.25 | 0.20 | 0.20 | 0.20 | 0.20 |
(1)在实验1,反应在10至20min时间内平均速率为
(2)在实验2中A的初始浓度C2=
(3)设实验3的反应速率为v3,实验1的反应速率为v1,则v3
(4)比较实验4和实验1,可推测该反应是
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】Ⅰ.控制变量法是化学实验的一种常用方法。下表是某学习小组研究等物质的量浓度的稀硫酸和锌反应的实验数据,分析以下数据,回答下列问题:
(1)化学反应速率本质上是由________ 决定的,但外界条件也会影响反应速率的大小。本实验中实验2和实验3表明________ 对反应速率有影响。
(2)我们最好选取实验______________ (填3个实验序号)研究锌的形状对反应速率的影响。我们发现在其它条件相同时,反应物间的____________ 反应速率越快。
(3)若采用与实验1完全相同的条件,但向反应容器中滴加少量硫酸铜溶液,发现反应速率明显加快。原因是_______________________________ 。
(4)利用表中数据,可以求得硫酸的物质的量浓度是________ mol/L。
Ⅱ.某温度时,在5L的容器中,X、Y、Z三种气体的物质的量随时间的变化曲线如图所示。请通过计算回答下列问题:

(5)反应开始至2min,Z的平均反应速率_______________ 。
(6)分析有关数据,写出X、Y、Z的反应方程式__________________ 。
| 序号 | 硫酸的体积/mL | 锌的质量/g | 锌的形状 | 温度/℃ | 完全溶于酸的时间/s | 生成硫酸锌的质量/g |
| 1 | 50.0 | 2.0 | 薄片 | 25 | 100 | m1 |
| 2 | 50.0 | 2.0 | 颗粒 | 25 | 70 | m2 |
| 3 | 50.0 | 2.0 | 颗粒 | 35 | 35 | m3 |
| 4 | 50.0 | 2.0 | 粉末 | 25 | 45 | 5.0 |
| 5 | 50.0 | 6.0 | 粉末 | 35 | 30 | m5 |
| 6 | 50.0 | 8.0 | 粉末 | 25 | t6 | 16.1 |
| 7 | 50.0 | 10.0 | 粉末 | 25 | t7 | 16.1 |
(1)化学反应速率本质上是由
(2)我们最好选取实验
(3)若采用与实验1完全相同的条件,但向反应容器中滴加少量硫酸铜溶液,发现反应速率明显加快。原因是
(4)利用表中数据,可以求得硫酸的物质的量浓度是
Ⅱ.某温度时,在5L的容器中,X、Y、Z三种气体的物质的量随时间的变化曲线如图所示。请通过计算回答下列问题:

(5)反应开始至2min,Z的平均反应速率
(6)分析有关数据,写出X、Y、Z的反应方程式
您最近一年使用:0次
【推荐3】在容积为2L的恒温容器中,充入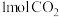 和
和 ,一定条件下发生反应
,一定条件下发生反应 ,测得
,测得 和
和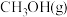 的物质的量随时间的变化情况如下表。
的物质的量随时间的变化情况如下表。
(1)下列说法正确的是______ (填标号)。
a.反应达到平衡后,反应不再进行
b.使用催化剂可以增大反应速率,提高生产效率
c.当容器内混合气体的平均相对分子质量不变时,说明反应达到了化学平衡状态
d.通过调控反应条件,可以提高该反应进行的程度,使 可以100%地转化为
可以100%地转化为
(2)3~6min内,
______  .
.
(3)12min末时,混合气体中 的体积分数为
的体积分数为______ 。
(4)第3min时
______ (填“>”“<”或“=”)第9min时 。
。
(5)一定温度条件下,能够说明该反应到达平衡的标志是____________ 。
①若恒压容器中,混合气体的密度保持不变;②单位时间内生成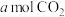 ,同时消耗
,同时消耗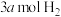 ;③
;③ 与
与 的总浓度等于
的总浓度等于 与
与 的总浓度;④
的总浓度;④ 的物质的量不再变化;⑤恒容容器中,混合气体的总压强不再变化;
的物质的量不再变化;⑤恒容容器中,混合气体的总压强不再变化;
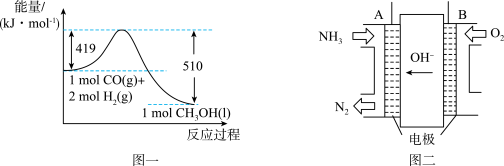
(6) 还可以直接由CO和
还可以直接由CO和 制得,根据如图一所示的转化关系判断,生成
制得,根据如图一所示的转化关系判断,生成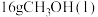 放出
放出______ kJ能量。
(7) 和
和 可以形成碱性燃料电池,结构如图二所示。
可以形成碱性燃料电池,结构如图二所示。
①电极A反应式为__________ 。
②若反应生成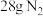 ,则该燃料电池理论上消耗的
,则该燃料电池理论上消耗的 的体积(在标准状况下)为
的体积(在标准状况下)为______ L。
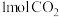 和
和 ,一定条件下发生反应
,一定条件下发生反应 ,测得
,测得 和
和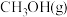 的物质的量随时间的变化情况如下表。
的物质的量随时间的变化情况如下表。时间 | 0min | 3min | 6min | 9min | 12min |
| 0 | 0.50 | 0.65 | 0.75 | 0.75 |
| 1 | 0.50 | 0.35 | x | 0.25 |
(1)下列说法正确的是
a.反应达到平衡后,反应不再进行
b.使用催化剂可以增大反应速率,提高生产效率
c.当容器内混合气体的平均相对分子质量不变时,说明反应达到了化学平衡状态
d.通过调控反应条件,可以提高该反应进行的程度,使
 可以100%地转化为
可以100%地转化为
(2)3~6min内,

 .
.(3)12min末时,混合气体中
 的体积分数为
的体积分数为(4)第3min时

 。
。(5)一定温度条件下,能够说明该反应到达平衡的标志是
①若恒压容器中,混合气体的密度保持不变;②单位时间内生成
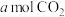 ,同时消耗
,同时消耗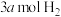 ;③
;③ 与
与 的总浓度等于
的总浓度等于 与
与 的总浓度;④
的总浓度;④ 的物质的量不再变化;⑤恒容容器中,混合气体的总压强不再变化;
的物质的量不再变化;⑤恒容容器中,混合气体的总压强不再变化;(6)
 还可以直接由CO和
还可以直接由CO和 制得,根据如图一所示的转化关系判断,生成
制得,根据如图一所示的转化关系判断,生成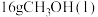 放出
放出(7)
 和
和 可以形成碱性燃料电池,结构如图二所示。
可以形成碱性燃料电池,结构如图二所示。
①电极A反应式为
②若反应生成
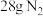 ,则该燃料电池理论上消耗的
,则该燃料电池理论上消耗的 的体积(在标准状况下)为
的体积(在标准状况下)为
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐1】I.一定温度下,某容器中加入足量的碳酸钙发生反应: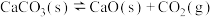 △H>0;一段时间后达到平衡。
△H>0;一段时间后达到平衡。
(1)该反应的化学平衡常数表达式为K=___________ ,为了提高CO2的生成率,可采取的措施___________ 。
A.减压 B.升温 C.增加碳酸钙的量 D.转移出CO2
(2)对于该反应,下列说法正确的是___________ 。
A.将体积缩小为原来的一半,当体系再次达到平衡时,CO2的浓度不变
B.将容器缩小为原来的一半,平衡不移动
C.将容器扩大为原来的两倍,平衡发生移动,再次平衡后,气体密度不变
D.增大压强,平衡逆向移动,K值减小
E.将体积增大为原来的2倍,再次达到平衡时,体系内压强不变
F.保持容器体积不变,充入He,平衡不移动
Ⅱ.
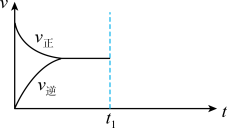
(3)在恒温恒压密闭容器中通入CO和H2O各1 发生反应
发生反应 ,当反应达到平衡后,维持温度与压强不变,
,当反应达到平衡后,维持温度与压强不变, 时再通入各1
时再通入各1 的CO和H2O的混合气体,请在下图中画出正反应和逆反应速率在
的CO和H2O的混合气体,请在下图中画出正反应和逆反应速率在 后随时间t变化的曲线图
后随时间t变化的曲线图___________ 。
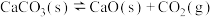 △H>0;一段时间后达到平衡。
△H>0;一段时间后达到平衡。(1)该反应的化学平衡常数表达式为K=
A.减压 B.升温 C.增加碳酸钙的量 D.转移出CO2
(2)对于该反应,下列说法正确的是
A.将体积缩小为原来的一半,当体系再次达到平衡时,CO2的浓度不变
B.将容器缩小为原来的一半,平衡不移动
C.将容器扩大为原来的两倍,平衡发生移动,再次平衡后,气体密度不变
D.增大压强,平衡逆向移动,K值减小
E.将体积增大为原来的2倍,再次达到平衡时,体系内压强不变
F.保持容器体积不变,充入He,平衡不移动
Ⅱ.
(3)在恒温恒压密闭容器中通入CO和H2O各1
 发生反应
发生反应 ,当反应达到平衡后,维持温度与压强不变,
,当反应达到平衡后,维持温度与压强不变, 时再通入各1
时再通入各1 的CO和H2O的混合气体,请在下图中画出正反应和逆反应速率在
的CO和H2O的混合气体,请在下图中画出正反应和逆反应速率在 后随时间t变化的曲线图
后随时间t变化的曲线图
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐2】对于反应:2SO2+O2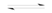 2SO3,当其他条件不变时,只改变一个条件,将生成SO3的反应速率的变化填入下表格里(填“增大”、“ 减小”或“不变”)。
2SO3,当其他条件不变时,只改变一个条件,将生成SO3的反应速率的变化填入下表格里(填“增大”、“ 减小”或“不变”)。
 2SO3,当其他条件不变时,只改变一个条件,将生成SO3的反应速率的变化填入下表格里(填“增大”、“ 减小”或“不变”)。
2SO3,当其他条件不变时,只改变一个条件,将生成SO3的反应速率的变化填入下表格里(填“增大”、“ 减小”或“不变”)。| 编号 | 改变的条件 | 生成的SO3的速率 |
| ① | 降低温度 | |
| ② | 升高温度 | |
| ③ | 增大O2的浓度 | |
| ④ | 恒容下充入Ne | |
| ⑤ | 压缩体积 | |
| ⑥ | 使用催化剂 |
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐3】某可逆反应:2A(g)⇌B(g)+D(g)在密闭固定容积的容器中4种不同条件下进行,B和D的起始浓度均为0,反应物A的浓度随反应时间的变化情况如下表:

(1)实验1中,在10~20min内,以物质A表示的平均反应速率为_____ 。
(2)0~20min内,实验2比实验1的反应速率(“快”或“慢”)_____ ,其原因可能是_____ 。
(3)实验3比实验1的反应速率(填“快”或“慢”)_____ ,其原因可能是_____ 。
(4)从表中可以看出,t_____ 900(填“>”、“<”、“=”)。
(5)实验3中40分钟时υ(正)_____ υ(逆)(填“>”、“<”、“=”)。
(6)实验4中50分钟时B的浓度为_____ 。

(1)实验1中,在10~20min内,以物质A表示的平均反应速率为
(2)0~20min内,实验2比实验1的反应速率(“快”或“慢”)
(3)实验3比实验1的反应速率(填“快”或“慢”)
(4)从表中可以看出,t
(5)实验3中40分钟时υ(正)
(6)实验4中50分钟时B的浓度为
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐1】气态可逆反应:mA(g)+nB(g) pC(g)+qD(g),有如图关系,试用“>”或“<”填(1)~(3)题。
pC(g)+qD(g),有如图关系,试用“>”或“<”填(1)~(3)题。

(1)温度T1_________ T2 。
(2)压强p1_________ p2 。
(3)m+n_________ p+q。
(4)正反应为_____ 反应(填“放热”或“吸热”)。
 pC(g)+qD(g),有如图关系,试用“>”或“<”填(1)~(3)题。
pC(g)+qD(g),有如图关系,试用“>”或“<”填(1)~(3)题。
(1)温度T1
(2)压强p1
(3)m+n
(4)正反应为
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】如图所示为800℃时A、B、C三种气体物质的浓度随时间变化的情况。试回答下列问题:
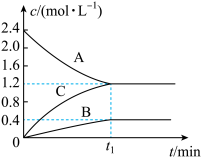
(1)该反应的反应物是__________ 。
(2)该反应的化学方程式为________ 。
(3)若 ,则A物质的平均反应速率为
,则A物质的平均反应速率为_________ 。

(1)该反应的反应物是
(2)该反应的化学方程式为
(3)若
 ,则A物质的平均反应速率为
,则A物质的平均反应速率为
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐3】探究一定条件下反应物浓度对硫代硫酸钠(Na2S2O3)与硫酸反应速率的影响。
【查阅资料】
a.Na2S2O3易溶于水,能与硫酸发生反应:Na2S2O3+H2SO4=Na2SO4+S↓+SO2↑+H2O
b.浊度计用于测量浑浊度的变化。产生的沉淀越多,浑浊度(单位为NTU)值越大。
【实验过程】


用如图所示装置进行如表所示的 5 个实验,分别测量混合后溶液达到相同浑浊度的过程中, 浑浊度随时间的变化。实验①~⑤所得数据如图曲线①~⑤所示:
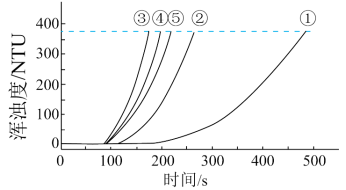
实验数据:
【分析与解释】
(1)实验序号①中,溶液混合后Na2S2O3溶液的初始浓度______ mol/L。
(2)实验③中,x =______ 。
(3)实验①、②、③的目的是______ 。
(4)通过比较①、②、③与③、④、⑤两组实验,可推断:反应物浓度的改变对Na2S2O3与硫酸反应的化学反应速率的影响,Na2S2O3溶液浓度的改变影响更大。该推断的证据是______ 。
【查阅资料】
a.Na2S2O3易溶于水,能与硫酸发生反应:Na2S2O3+H2SO4=Na2SO4+S↓+SO2↑+H2O
b.浊度计用于测量浑浊度的变化。产生的沉淀越多,浑浊度(单位为NTU)值越大。
【实验过程】


用如图所示装置进行如表所示的 5 个实验,分别测量混合后溶液达到相同浑浊度的过程中, 浑浊度随时间的变化。实验①~⑤所得数据如图曲线①~⑤所示:

实验数据:
| 实验编号 | Na2S2O3溶液 | H2SO4溶液 | 蒸馏水 | ||
| c / (mol·L-1) | V / mL | c / (mol·L-1) | V / mL | V / mL | |
| ① | 0.1 | 1.5 | 0.1 | 3.5 | 10 |
| ② | 0.1 | 2.5 | 0.1 | 3.5 | 9 |
| ③ | 0.1 | 3.5 | 0.1 | 3.5 | x |
| ④ | 0.1 | 3.5 | 0.1 | 2.5 | 9 |
| ⑤ | 0.1 | 3.5 | 0.1 | 1.5 | 10 |
【分析与解释】
(1)实验序号①中,溶液混合后Na2S2O3溶液的初始浓度
(2)实验③中,x =
(3)实验①、②、③的目的是
(4)通过比较①、②、③与③、④、⑤两组实验,可推断:反应物浓度的改变对Na2S2O3与硫酸反应的化学反应速率的影响,Na2S2O3溶液浓度的改变影响更大。该推断的证据是
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐1】电能是现代社会应用最广泛的能源之一、
(1)某原电池装置如图所示。其中,Zn电极为原电池的_______ 极(填“正”或“负”)。

(2)Zn电极的电极反应式是_______ 。
(3)Cu电极上发生的反应属于_______ (填“氧化”或“还原”)反应。
(1)某原电池装置如图所示。其中,Zn电极为原电池的

(2)Zn电极的电极反应式是
(3)Cu电极上发生的反应属于
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐2】原电池原理的发现是储能和供能技术的巨大进步,是化学对人类的一项重大贡献。
(1)将纯锌片和纯铜片按图方式插入100 mL相同浓度的稀硫酸中一段时间,回答下列问题:
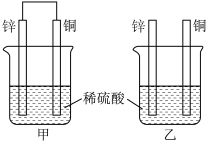
①下列说法正确的是________ 。
A 甲、乙均为化学能转变为电能的装置
B 乙中铜片上没有明显变化
C 甲中铜片质量减少、乙中锌片质量减少
D 两烧杯中溶液的 pH 均增大
②在相同时间内, 两烧杯中产生气泡的速度:甲________ 乙(填“>”“<”或“=”)。
③请写出图中构成原电池的负极电极反应式:________________________________ 。
④当甲中溶液质量增重31.5 g时,电极上转移电子数目为________ 。
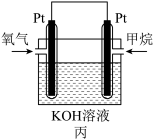
(2)图丙为甲烷氧气燃料电池的构造示意图,电解质溶液的溶质是KOH。通甲烷一极的电极反应方程式为____________________________________________________________ 。
(1)将纯锌片和纯铜片按图方式插入100 mL相同浓度的稀硫酸中一段时间,回答下列问题:


①下列说法正确的是
A 甲、乙均为化学能转变为电能的装置
B 乙中铜片上没有明显变化
C 甲中铜片质量减少、乙中锌片质量减少
D 两烧杯中溶液的 pH 均增大
②在相同时间内, 两烧杯中产生气泡的速度:甲
③请写出图中构成原电池的负极电极反应式:
④当甲中溶液质量增重31.5 g时,电极上转移电子数目为
(2)图丙为甲烷氧气燃料电池的构造示意图,电解质溶液的溶质是KOH。通甲烷一极的电极反应方程式为
您最近一年使用:0次