解题方法
1 . 对化学反应原理的研究能让我们更加深刻地认识化学反应,也是化学中最有魅力和挑战性的领域,依据所学的化学反应原理知识和题干信息回答下列问题:
I.面对气候变化,我国承诺二氧化碳排放力争2030年前达到峰值,力争2060年前实现碳中和。“碳达峰、碳中和”目标下,必须加强对二氧化碳资源开发利用的研究。
(1)往容积为2L的恒容密闭容器中通入2mol 和6mol
和6mol ,一定温度下发生反应:
,一定温度下发生反应: ,20min时达到化学平衡状态,测得水蒸气的物质的量为2mol,前20min内,用
,20min时达到化学平衡状态,测得水蒸气的物质的量为2mol,前20min内,用 表示该反应的平均反应速率为
表示该反应的平均反应速率为___________  ,
, 的平衡转化率
的平衡转化率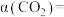
___________ %(保留一位小数)。[注:转化率等于反应物消耗的物质的量与反应物初始的物质的量之比。]
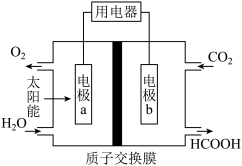
(2)一种 电化学制甲酸的装置如图所示,电极a为
电化学制甲酸的装置如图所示,电极a为___________ 极(填“正”或“负”),写出电极b的电极反应式___________ 。
II.催化剂的研究是化学反应原理中一个重要领域,催化剂往往是化学工业过程和技术改造更新的关键。化学反应中的活化能会显著影响化学反应速率,活化能越低,化学反应速率越快。催化剂能加快化学反应速率是因为它能改变反应的路径,降低反应的活化能。
(3) 与
与 经催化重整,制得合成气:
经催化重整,制得合成气: 。反应中催化剂活性会因积碳反应而降低,同时存在的消碳反应则使积碳量减少。相关数据如下表:
。反应中催化剂活性会因积碳反应而降低,同时存在的消碳反应则使积碳量减少。相关数据如下表:
由上表判断,催化剂X______ Y(填“优于”或“劣于”),理由是_____ 。
(4)催化剂的存在会显著地加快 的分解,某兴趣小组研究
的分解,某兴趣小组研究 催化分解
催化分解 历程如下:
历程如下:
第一步: (慢反应)
(慢反应)
第二步:______(快反应)
反应的活化能较大的为第___________ 步(填“一”或“二”),第二步反应的离子方程式为___________ 。
I.面对气候变化,我国承诺二氧化碳排放力争2030年前达到峰值,力争2060年前实现碳中和。“碳达峰、碳中和”目标下,必须加强对二氧化碳资源开发利用的研究。
(1)往容积为2L的恒容密闭容器中通入2mol
 和6mol
和6mol ,一定温度下发生反应:
,一定温度下发生反应: ,20min时达到化学平衡状态,测得水蒸气的物质的量为2mol,前20min内,用
,20min时达到化学平衡状态,测得水蒸气的物质的量为2mol,前20min内,用 表示该反应的平均反应速率为
表示该反应的平均反应速率为 ,
, 的平衡转化率
的平衡转化率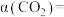
(2)一种
 电化学制甲酸的装置如图所示,电极a为
电化学制甲酸的装置如图所示,电极a为
II.催化剂的研究是化学反应原理中一个重要领域,催化剂往往是化学工业过程和技术改造更新的关键。化学反应中的活化能会显著影响化学反应速率,活化能越低,化学反应速率越快。催化剂能加快化学反应速率是因为它能改变反应的路径,降低反应的活化能。
(3)
 与
与 经催化重整,制得合成气:
经催化重整,制得合成气: 。反应中催化剂活性会因积碳反应而降低,同时存在的消碳反应则使积碳量减少。相关数据如下表:
。反应中催化剂活性会因积碳反应而降低,同时存在的消碳反应则使积碳量减少。相关数据如下表:积碳反应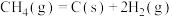 | 消碳反应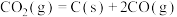 | ||
活性能/ | 催化剂X | 33 | 91 |
| 催化剂Y | 43 | 72 | |
(4)催化剂的存在会显著地加快
 的分解,某兴趣小组研究
的分解,某兴趣小组研究 催化分解
催化分解 历程如下:
历程如下:第一步:
 (慢反应)
(慢反应)第二步:______(快反应)
反应的活化能较大的为第
您最近一年使用:0次
2022-07-12更新
|
376次组卷
|
2卷引用:四川省雅安市2021-2022学年高一下学期期末检测化学试题
解题方法
2 . CH4、CH3OH(甲醇)既是重要的化工原料,又是未来重要的能源物质。
(1)CH4可用作燃料,CH4的燃烧反应属于_______  填“放热,,或“吸热”
填“放热,,或“吸热” 反应,CH4和O2还可以构成燃料电池,通入CH4的一极是
反应,CH4和O2还可以构成燃料电池,通入CH4的一极是_______  填“正”或“负”
填“正”或“负” 极。
极。
(2)将1.0 molCH4和2.0 molH2O(g)通入容积为V L的恒容反应室,在一定条件下发生反应 。测得在5 min时达到平衡,CH4的物质的量为0.6 mol,CO的物质的量浓度为0.04 mol/L。
。测得在5 min时达到平衡,CH4的物质的量为0.6 mol,CO的物质的量浓度为0.04 mol/L。 内,用H2表示该反应的平均反应速率v(H2)=
内,用H2表示该反应的平均反应速率v(H2)=_______ ,V=_______ 。
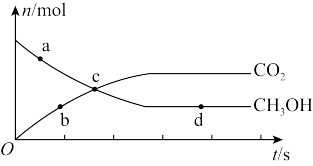
(3)在恒容条件下进行反应 、CO2、CH3OH的物质的量随时间变化关系如图,该反应达到平衡的点是
、CO2、CH3OH的物质的量随时间变化关系如图,该反应达到平衡的点是_______ 。
(1)CH4可用作燃料,CH4的燃烧反应属于
 填“放热,,或“吸热”
填“放热,,或“吸热” 反应,CH4和O2还可以构成燃料电池,通入CH4的一极是
反应,CH4和O2还可以构成燃料电池,通入CH4的一极是 填“正”或“负”
填“正”或“负” 极。
极。(2)将1.0 molCH4和2.0 molH2O(g)通入容积为V L的恒容反应室,在一定条件下发生反应
 。测得在5 min时达到平衡,CH4的物质的量为0.6 mol,CO的物质的量浓度为0.04 mol/L。
。测得在5 min时达到平衡,CH4的物质的量为0.6 mol,CO的物质的量浓度为0.04 mol/L。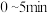 内,用H2表示该反应的平均反应速率v(H2)=
内,用H2表示该反应的平均反应速率v(H2)=(3)在恒容条件下进行反应
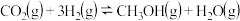 、CO2、CH3OH的物质的量随时间变化关系如图,该反应达到平衡的点是
、CO2、CH3OH的物质的量随时间变化关系如图,该反应达到平衡的点是
您最近一年使用:0次
2022-05-06更新
|
27次组卷
|
2卷引用:四川省广安市育才学校2022-2023学年高一上学期9月月考化学试题
名校
3 . 氨、硫酸都是重要的工业原料,根据题意完成下列各题。
(1)工业上常用过量氨水吸收二氧化硫,该反应的化学方程式为_______ 。
(2)氨氧化法是工业生产中合成硝酸的主要途径。合成的第一步是将氨和空气的混合气通过灼热的铂铑合金网,在合金网的催化下,氨被氧化成一氧化氮,该反应的化学方程式为_______ 。
(3)将硫酸工业尾气中的SO2转化成硫酸,同时获得电能。装置如图所示(电极均为惰性材料):
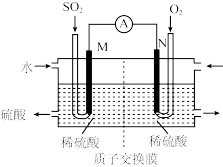
①原电池的负极为_______ 。(填“M”或“N”)
②M极发生的电极反应式为_______ 。
(1)工业上常用过量氨水吸收二氧化硫,该反应的化学方程式为
(2)氨氧化法是工业生产中合成硝酸的主要途径。合成的第一步是将氨和空气的混合气通过灼热的铂铑合金网,在合金网的催化下,氨被氧化成一氧化氮,该反应的化学方程式为
(3)将硫酸工业尾气中的SO2转化成硫酸,同时获得电能。装置如图所示(电极均为惰性材料):

①原电池的负极为
②M极发生的电极反应式为
您最近一年使用:0次
名校
4 . 按要求回答问题:
(1)以Fe和Cu为电极,稀H2SO4为电解质溶液形成的原电池中:
①SO 向
向_______ 极移动(填“正”或“负”)。
②电子流动方向由_______ 极流向_______ 极(填“正”或“负”)。
③若有1mole-流过导线,则理论上正极析出标准状态下的气体_______ L。
④若将稀硫酸换成浓硝酸,一段时间后,正极电极方程式为_______ 。
(2)丙烷(C3H8)燃料电池是一种高效无污染的清洁电池,它用KOH做电解质。则负极反应方程式是_______ 。
(3)一定温度下,在容积为2L的密闭容器中进行反应:aN(g)⇌bM(g)+cP(g),M、N、P的物质的量随时间变化的曲线如图所示:
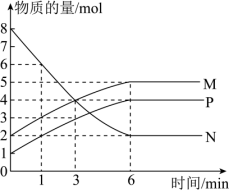
①反应化学方程式中各物质的系数比为a︰b︰c=_______ 。
②1min到3min这段时刻,以M的浓度变化表示的平均反应速率为_______ 。
(1)以Fe和Cu为电极,稀H2SO4为电解质溶液形成的原电池中:
①SO
 向
向②电子流动方向由
③若有1mole-流过导线,则理论上正极析出标准状态下的气体
④若将稀硫酸换成浓硝酸,一段时间后,正极电极方程式为
(2)丙烷(C3H8)燃料电池是一种高效无污染的清洁电池,它用KOH做电解质。则负极反应方程式是
(3)一定温度下,在容积为2L的密闭容器中进行反应:aN(g)⇌bM(g)+cP(g),M、N、P的物质的量随时间变化的曲线如图所示:

①反应化学方程式中各物质的系数比为a︰b︰c=
②1min到3min这段时刻,以M的浓度变化表示的平均反应速率为
您最近一年使用:0次
名校
解题方法
5 . 如图为原电池装置示意图:
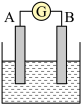
(1)若A为Zn,B为石墨棒,电解质溶液为稀硫酸,则A为_______ 极(填正或负),写出电极反应式:正极_______ ,负极_______ .总反应离子方程式为:_______ 。
(2)若A为铜片,B为铁片,电解质为FeCl3溶液,则A为_______ 极(填正或负),写出电极反应式:正极_______ ,负极_______ .总反应离子方程式为:_______ 。
(3)若A、B均为铂片,电解质为KOH溶液,分别从A、B两极通入H2和O2,该电池即为燃料电池,通入氧气的一极为该电池的_______ 极(填正或负),写出电极反应式:正极______________ ,负极______ .总反应方程式为:______ 。

(1)若A为Zn,B为石墨棒,电解质溶液为稀硫酸,则A为
(2)若A为铜片,B为铁片,电解质为FeCl3溶液,则A为
(3)若A、B均为铂片,电解质为KOH溶液,分别从A、B两极通入H2和O2,该电池即为燃料电池,通入氧气的一极为该电池的
您最近一年使用:0次
6 . NO2和N2O4之间发生反应:N2O4 2NO2,一定温度下,体积为2L的密闭容器中,各物质的物质的量随时间变化的关系如图所示。请回答下列问题:
2NO2,一定温度下,体积为2L的密闭容器中,各物质的物质的量随时间变化的关系如图所示。请回答下列问题:
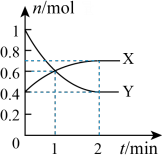
(1)曲线____________ (填“X”或“Y”)表示NO2的物质的量随时间的变化曲线。在0到1min中内用X表示该反应的速率是________________ ,该反应达最大限度时Y的转化率_______ 。
(2)若上述反应在甲、乙两个相同容器内同时进行,分别测得甲中 v(NO2)=0.3 mol·L-1·min-1,乙中y(N2O4)=0.2 mol·L-1·min-1,则__________ 中反应更快。
(3)下列描述能表示反应达平衡状态的是______________________ 。
A.容器中X与Y的物质的量相等
B.容器内气体的颜色不再改变
C.2v(X)=v(Y)
D.容器内气体的平均相对分子质量不再改变
E.容器内气体的密度不再发生变化
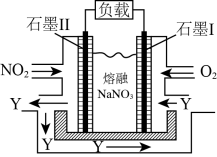
(4)NO2、O2和熔融NaNO3可制作燃料电池,其原理如右图,该电池在使用过程中石墨Ⅱ电极上生成氧化物Y(N2O5),则石墨I电极是______________ (填“正极”或“负极”),石墨Ⅱ的电极反应式为_________________________________ 。
 2NO2,一定温度下,体积为2L的密闭容器中,各物质的物质的量随时间变化的关系如图所示。请回答下列问题:
2NO2,一定温度下,体积为2L的密闭容器中,各物质的物质的量随时间变化的关系如图所示。请回答下列问题: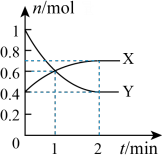
(1)曲线
(2)若上述反应在甲、乙两个相同容器内同时进行,分别测得甲中 v(NO2)=0.3 mol·L-1·min-1,乙中y(N2O4)=0.2 mol·L-1·min-1,则
(3)下列描述能表示反应达平衡状态的是
A.容器中X与Y的物质的量相等
B.容器内气体的颜色不再改变
C.2v(X)=v(Y)
D.容器内气体的平均相对分子质量不再改变
E.容器内气体的密度不再发生变化
(4)NO2、O2和熔融NaNO3可制作燃料电池,其原理如右图,该电池在使用过程中石墨Ⅱ电极上生成氧化物Y(N2O5),则石墨I电极是

您最近一年使用:0次
解题方法
7 . 下图A、B、C三个烧杯中分别盛有相同物质的量浓度的稀硫酸。

(1)A中反应的离子方程式是_____ 。
(2)B中Cu极属于原电池中的_____ 极;Fe极附近溶液呈_____ 色。
(3)C中被腐蚀的金属是_____ (填化学式),A、B、C中铁被腐蚀的速率,由快到慢的顺序是_____ (用“>”表示)。

(1)A中反应的离子方程式是
(2)B中Cu极属于原电池中的
(3)C中被腐蚀的金属是
您最近一年使用:0次



