名校
解题方法
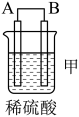
1 . 电池在生产生活中的应用越来越广泛。某小组设计实验,探究Al片和Cu片为电极,浓硝酸为电解液的原电池原理:
(1)浓硝酸浓度的测定:准确量取4.000 mL浓硝酸,稀释至500 mL,得到溶液X。移取20.00 mL溶液X,用0.1250 mol/LNaOH溶液滴定,重复三次,平均每次消耗NaOH溶液19.20 mL。
①上述操作没有用到的仪器有_________ (填正确答案的编号)。_________  。
。
用此浓硝酸完成(2)和(3)中实验。
(2)将Cu片置于浓硝酸中,Cu片逐渐溶解,产生大量红棕色气泡,反应的离子方程式为__________ 。
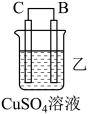
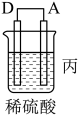
(3)探究以Al片、Cu片为电极,浓硝酸为电解液形成原电池的机理,示意图和实验记录如下:
__________ 。
②7s左右电流表指针由左向右偏转的原因是__________ 。
③实验过程中均有气体产生,31 min前和31min后产生的气体不同,请结合题目信息和步骤Ⅰ气体的现象描述,分析31 min以后产生的气体是什么,并描述相关现象__________ 。
(1)浓硝酸浓度的测定:准确量取4.000 mL浓硝酸,稀释至500 mL,得到溶液X。移取20.00 mL溶液X,用0.1250 mol/LNaOH溶液滴定,重复三次,平均每次消耗NaOH溶液19.20 mL。
①上述操作没有用到的仪器有
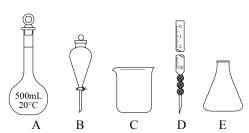
 。
。用此浓硝酸完成(2)和(3)中实验。
(2)将Cu片置于浓硝酸中,Cu片逐渐溶解,产生大量红棕色气泡,反应的离子方程式为
(3)探究以Al片、Cu片为电极,浓硝酸为电解液形成原电池的机理,示意图和实验记录如下:
| 步骤 | 操作及记录 |
| Ⅰ | 图a装置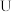 型管内盛有浓硝酸,插入新打磨的Al片和Cu片,电流表指针迅速向左偏转(如图b),Cu片周围产生红棕色气体 型管内盛有浓硝酸,插入新打磨的Al片和Cu片,电流表指针迅速向左偏转(如图b),Cu片周围产生红棕色气体 |
| Ⅱ | 一段时间后,电流表读数逐渐变小,7 s时电流表读数减小为0 |
| Ⅲ | 电流表指针又向右偏转,读数迅速变大后稳定 |
| Ⅳ | 稳定一段时间后电流表读数逐渐变小,31 min时电流表读数为0 |
| Ⅴ | 电流表指针又向左偏转,读数逐渐变大后趋于稳定 |
②7s左右电流表指针由左向右偏转的原因是
③实验过程中均有气体产生,31 min前和31min后产生的气体不同,请结合题目信息和步骤Ⅰ气体的现象描述,分析31 min以后产生的气体是什么,并描述相关现象
您最近一年使用:0次
解题方法
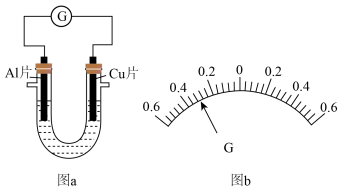
2 . 电能是现代社会应用最广泛的能源之一,四种原电池装置如图所示,请回答下列问题:___________ (写化学式) ,正极上可观察到的现象为___________ 。
(2)图2装置中:
①若M、N均为金属,观察到N极溶解,则金属的活动性:M___________ (填“> ”或“< ”)N。
②若M极为铜,N极为石墨,N极的电极反应式为___________ 。
(3)图3为锌锰干电池,属于___________ (填“一次”或“二次”)电池,发生还原反应的物质是___________ (写化学式),电子的移动方向为___________ 。
(4)图4为铅酸蓄电池,该电池放电时发生的总反应的化学方程式为Pb+PbO2+2H2SO4=2PbSO4+2H2O,放电时电解液中H+移向___________ (填“Pb”或“PbO2”)电极,一段时间后,电路中转移了0.3 mol电子,负极的质量增加了___________ g。
(2)图2装置中:
①若M、N均为金属,观察到N极溶解,则金属的活动性:M
②若M极为铜,N极为石墨,N极的电极反应式为
(3)图3为锌锰干电池,属于
(4)图4为铅酸蓄电池,该电池放电时发生的总反应的化学方程式为Pb+PbO2+2H2SO4=2PbSO4+2H2O,放电时电解液中H+移向
您最近一年使用:0次
2024-08-01更新
|
38次组卷
|
4卷引用:山西省晋中市平遥县2023-2024学年高一下学期4月期中考试化学试题
名校
3 . I.某化学兴趣小组为了探索铝电极在原电池中的作用,设计并逬行了以下一系列实验,实验结果记录如下:
根据上表中记录的实验现象,回答下列问题。
(1)实验1、2中铝电极作用是否相同?___________ (填“是”或“否”)。
(2)实验3中铝为___________ 极。
(3)实验4中铝电极反应式为___________ ;电池总反应式为___________ 。
(4)根据以上实验结果,在原电池中相对活泼的金属作正扱还是作负极受到哪些因素的影响?___________
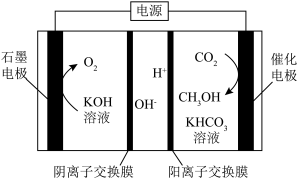
Ⅱ.电解还原法将CO2转化为甲醇的装置如图。 和选择性S的定义:
和选择性S的定义: (B)=
(B)= 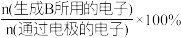 ;S(B)=
;S(B)= 。
。
(5)①电解过程中生成CH3OH的电极反应式:___________ 。
②当CO2完全消耗时,测得η(CH3OH)=33.3%,S(CH3OH)=25%。推测η(CH3OH)=33.3%的原因:
i.阴极有H2O放电。
ⅱ.阴极有CO生成。
ⅲ.……
a.通过检验电解产物判断推测i是否成立,需要检验的物质是___________ 。(填气体的化学式)
b.假设放电的CO2一部分生成CH3OH,其余的CO2全部在阴极放电生成CO,则η(CO)=___________ 。
③研究CH3OH中的C来自于CO2还是KHCO3,方法如下:
方法I.其他条件不变,用N2代替CO2电解,无CH3OH产生。
方法Ⅱ.其他条件不变,用14CO2代替CO2电解,有___________ 产生。
综上,证实CH3OH中的C来自于CO2。
| 编号 | 电极材料 | 电解质溶液 | 电流表指针偏转方向 |
| 1 | Mg、Al | 稀盐酸 | 偏向Al |
| 2 | Al、Cu | 稀盐酸 | 偏向Cu |
| 3 | Al、石墨 | 稀盐酸 | 偏向石墨 |
| 4 | Mg、Al | NaOH溶液 | 偏向Mg |
(1)实验1、2中铝电极作用是否相同?
(2)实验3中铝为
(3)实验4中铝电极反应式为
(4)根据以上实验结果,在原电池中相对活泼的金属作正扱还是作负极受到哪些因素的影响?
Ⅱ.电解还原法将CO2转化为甲醇的装置如图。
 和选择性S的定义:
和选择性S的定义: (B)=
(B)= 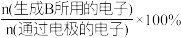 ;S(B)=
;S(B)= 。
。(5)①电解过程中生成CH3OH的电极反应式:
②当CO2完全消耗时,测得η(CH3OH)=33.3%,S(CH3OH)=25%。推测η(CH3OH)=33.3%的原因:
i.阴极有H2O放电。
ⅱ.阴极有CO生成。
ⅲ.……
a.通过检验电解产物判断推测i是否成立,需要检验的物质是
b.假设放电的CO2一部分生成CH3OH,其余的CO2全部在阴极放电生成CO,则η(CO)=
③研究CH3OH中的C来自于CO2还是KHCO3,方法如下:
方法I.其他条件不变,用N2代替CO2电解,无CH3OH产生。
方法Ⅱ.其他条件不变,用14CO2代替CO2电解,有
综上,证实CH3OH中的C来自于CO2。
您最近一年使用:0次
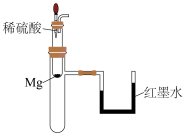
4 . 小明同学在学习了化学反应与能量变化后,想探究化学反应中能量的变化,邀请你和他一起完成下面的探究。
(1)小明利用如图所示装置进行实验,发现U形管中红墨水液面左低右高。___________ 能,能表示该反应过程能量变化的是___________ (填“a”或“b”)。 反应的化学能转化为电能,下列装置可以实现的是
反应的化学能转化为电能,下列装置可以实现的是___________ (填字母)。___________ (填“氧化”或“还原”)反应,正极上的现象为___________ 。
②装置D中, 做
做___________ 极,放电时铁电极上的反应式为___________ 。
(3)小明拟用定量的方法测量 与酸反应的快慢,设计了如图所示的装置。
与酸反应的快慢,设计了如图所示的装置。___________ 。
②实验过程中,若生成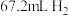 (标准状况),则消耗盐酸的物质的量
(标准状况),则消耗盐酸的物质的量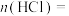
___________ 。
(1)小明利用如图所示装置进行实验,发现U形管中红墨水液面左低右高。
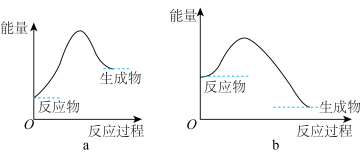
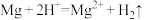 反应的化学能转化为电能,下列装置可以实现的是
反应的化学能转化为电能,下列装置可以实现的是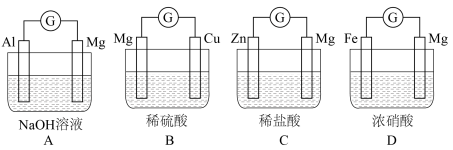
②装置D中,
 做
做(3)小明拟用定量的方法测量
 与酸反应的快慢,设计了如图所示的装置。
与酸反应的快慢,设计了如图所示的装置。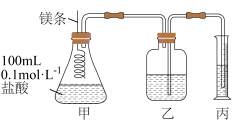
②实验过程中,若生成
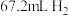 (标准状况),则消耗盐酸的物质的量
(标准状况),则消耗盐酸的物质的量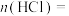
您最近一年使用:0次
2024-05-22更新
|
71次组卷
|
2卷引用:江西省兴国平川中学等多校联考2023-2024学年高一下学期期中调研测试化学试题
名校
解题方法
5 . 化学能还可以转化为电能,由A、B、C、D四种金属按表中装置图进行实验。
根据实验现象回答下列问题:
(1)装置甲中作正极的是_______ (填“A”或“B”)。
(2)外电路中电流由_______ (填“C极向B极移动”或“B极向C极移动”)。
(3)装置丙中金属A上电极反应属于_______ (填“氧化反应”或“还原反应”)。
(4)四种金属活动性由强到弱的顺序是_______ 。
| 装置 |
|
|
|
| 现象 | 二价金属A不断溶解 | C的质量增加 | A上有气体产生 |
(1)装置甲中作正极的是
(2)外电路中电流由
(3)装置丙中金属A上电极反应属于
(4)四种金属活动性由强到弱的顺序是
您最近一年使用:0次
2024-04-20更新
|
0次组卷
|
2卷引用:上海市青浦高级中学2023-2024学年高一下学期期中考试化学试题
名校
解题方法
6 . 由A、B、C、D四种金属按下表中装置进行实验。
根据实验现象回答下列问题:
(1)装置甲中正极的电极反应式是__________________ 。
(2)装置乙中正极的电极反应式是__________________ 。
(3)装置丙中负极的电极反应是__________________ 。
(4)四种金属活泼性的强弱顺序是__________________ 。
(5)2019年诺贝尔化学奖授予对锂离子电池研究做出突出贡献的科学家。某锂离子电池的工作原理如下。下列说法正确的是____ (填序号)。
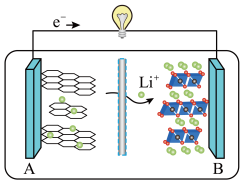
①A为电池的正极
②该装置实现了化学能转化为电能
③电池工作时,电池内部的锂离子定向移动
(6) 是一种大气污染物。工业尾气中含有
是一种大气污染物。工业尾气中含有 ,会造成严重的环境污染;未脱除
,会造成严重的环境污染;未脱除 的煤气,运输过程中还会腐蚀管道。干法氧化铁脱硫是目前除去煤气中
的煤气,运输过程中还会腐蚀管道。干法氧化铁脱硫是目前除去煤气中 的常用方法,其原理如图所示。
的常用方法,其原理如图所示。
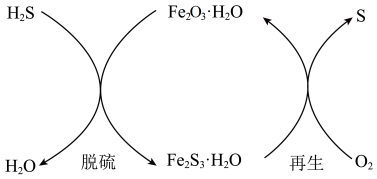
脱硫反应___________ 。再生过程中反应___________________ 。
| 装置 |  |  |  |
| 现象 | A上有气体产生 | B的质量增加 | 二价金属A不断溶解 |
(1)装置甲中正极的电极反应式是
(2)装置乙中正极的电极反应式是
(3)装置丙中负极的电极反应是
(4)四种金属活泼性的强弱顺序是
(5)2019年诺贝尔化学奖授予对锂离子电池研究做出突出贡献的科学家。某锂离子电池的工作原理如下。下列说法正确的是

①A为电池的正极
②该装置实现了化学能转化为电能
③电池工作时,电池内部的锂离子定向移动
(6)
 是一种大气污染物。工业尾气中含有
是一种大气污染物。工业尾气中含有 ,会造成严重的环境污染;未脱除
,会造成严重的环境污染;未脱除 的煤气,运输过程中还会腐蚀管道。干法氧化铁脱硫是目前除去煤气中
的煤气,运输过程中还会腐蚀管道。干法氧化铁脱硫是目前除去煤气中 的常用方法,其原理如图所示。
的常用方法,其原理如图所示。
脱硫反应
您最近一年使用:0次
7 . 氧化还原反应可拆分为氧化和还原两个“半反应”,某小组同学从“半反应”的角度探究反应规律。
(1)已知: 的转化在酸性条件下才能发生。
的转化在酸性条件下才能发生。
①该转化的还原半反应是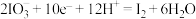 ,则相应的氧化半反应是
,则相应的氧化半反应是___________ 。
②分析上述还原半反应可知:增大 可促进
可促进 得到电子,使其
得到电子,使其___________ 性增强,进而与 发生反应。
发生反应。
(2)探究 与浓盐酸能否发生反应。
与浓盐酸能否发生反应。
①有同学认为 与浓盐酸不能发生反应产生氢气,其依据是
与浓盐酸不能发生反应产生氢气,其依据是___________ 。
用如下装置进行实验【硫酸与浓盐酸中 接近】。
接近】。
②甲实验的目的是___________ 。
③a.丙中气球变鼓是因为生成了___________ 气体(填化学式)。
b.经检测,丙中反应后溶液中存在 。从物质性质角度分析丙中反应能够发生的原因:
。从物质性质角度分析丙中反应能够发生的原因:___________ 。
(3)探究以下原电池的工作原理。
实验结果:产生电流,左侧 电极表面有
电极表面有 析出。
析出。
①该装置中左侧  电极作
电极作___________ (填“正”或“负”)极。
②写出该装置右侧 烧杯中的电极反应式___________ 。
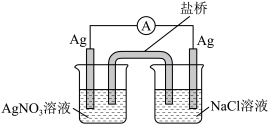
对该原电池的电极反应和总反应的反应类型进行分析,发现两极上分别发生氧化和还原反应,而总反应不一定是氧化还原反应。
③结合上述实验思考,仅由以下实验用品能否设计成原电池__________ 。
 片、
片、 浓溶液、蒸馏水、烧杯、盐桥、导线、电流表(选做下列a或b,若两个都作答,按a计分)
浓溶液、蒸馏水、烧杯、盐桥、导线、电流表(选做下列a或b,若两个都作答,按a计分)
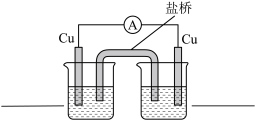
a.若能,在右装置图中填写烧杯中的试剂,并标出电子的移动方向 。
b.若不能,说明原因。
(1)已知:
 的转化在酸性条件下才能发生。
的转化在酸性条件下才能发生。①该转化的还原半反应是
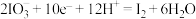 ,则相应的氧化半反应是
,则相应的氧化半反应是②分析上述还原半反应可知:增大
 可促进
可促进 得到电子,使其
得到电子,使其 发生反应。
发生反应。(2)探究
 与浓盐酸能否发生反应。
与浓盐酸能否发生反应。①有同学认为
 与浓盐酸不能发生反应产生氢气,其依据是
与浓盐酸不能发生反应产生氢气,其依据是用如下装置进行实验【硫酸与浓盐酸中
 接近】。
接近】。| 装置 | 序号 | 试管内药品 | 现象 |
 | 甲 | 浓盐酸 | 24小时后仍无明显变化 |
| 乙 |  粉+硫酸 粉+硫酸 | 24小时后仍无明显变化 | |
| 丙 |  粉+浓盐酸 粉+浓盐酸 | 24小时后气球变鼓 |
③a.丙中气球变鼓是因为生成了
b.经检测,丙中反应后溶液中存在
 。从物质性质角度分析丙中反应能够发生的原因:
。从物质性质角度分析丙中反应能够发生的原因:(3)探究以下原电池的工作原理。
实验结果:产生电流,左侧
 电极表面有
电极表面有 析出。
析出。①该装置中
 电极作
电极作②写出该装置

对该原电池的电极反应和总反应的反应类型进行分析,发现两极上分别发生氧化和还原反应,而总反应不一定是氧化还原反应。
③结合上述实验思考,仅由以下实验用品能否设计成原电池
 片、
片、 浓溶液、蒸馏水、烧杯、盐桥、导线、电流表(选做下列a或b,若两个都作答,按a计分)
浓溶液、蒸馏水、烧杯、盐桥、导线、电流表(选做下列a或b,若两个都作答,按a计分)
a.若能,在右装置图中填写烧杯中的试剂,
b.若不能,说明原因。
您最近一年使用:0次
解题方法
8 . Ⅰ.某实验小组同学进行如图1实验,以检验化学反应中的能量变化。请回答下列问题:
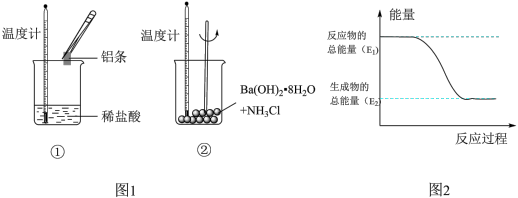
(1)实验中发现,反应后①中的温度升高;②中的温度降低。由此判断铝条与盐酸的反应是________ 热反应。反应过程________ (填“①”或“②”)的能量变化可用图2表示。
Ⅱ.A、B、C、D四种金属按下表中装置进行实验。
(2)根据实验现象回答下列问题:
①装置甲中溶液中的阴离子移向________ 极(填“A”或“B”)。
②装置乙中正极的电极反应式为________ 。
③装置丙中溶液的pH________ (填“变大”“变小”或“不变”)。
④四种金属活动性由强到弱的顺序是________ 。
⑤实验后同学们经过充分讨论,观察原电池反应特点,认真符合某些要求的化学反应都可以通过原电池来实现。下列化学反应在理论上可以设计成原电池的是________ 。
A.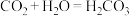 B.
B.
C. D.
D.

(1)实验中发现,反应后①中的温度升高;②中的温度降低。由此判断铝条与盐酸的反应是
Ⅱ.A、B、C、D四种金属按下表中装置进行实验。
| 装置 |  |  |  |
| 现象 | 二价金属A不断溶解 | C的质量增加 | A上有气体产生 |
①装置甲中溶液中的阴离子移向
②装置乙中正极的电极反应式为
③装置丙中溶液的pH
④四种金属活动性由强到弱的顺序是
⑤实验后同学们经过充分讨论,观察原电池反应特点,认真符合某些要求的化学反应都可以通过原电池来实现。下列化学反应在理论上可以设计成原电池的是
A.
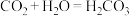 B.
B.
C.
 D.
D.
您最近一年使用:0次
名校
解题方法
9 . 某小组同学实验验证“Ag++Fe2+ Fe3++Ag↓”为可逆反应。
Fe3++Ag↓”为可逆反应。
(1)实验验证
实验I:将0.0100mol/LAg2SO4溶液与0.0400mo/LFeSO4溶液(pH=1)等体积混合,产生灰黑色沉淀,溶液呈黄色。
实验Ⅱ:向少量Ag粉中加入0.0100mol/LFe2(SO4)3溶液(pH=1),固体完全溶解。
①取I中沉淀,加入浓硝酸,证实灰黑色沉淀为Ag。请写出该反应的离子方程式:_______ 。
②Ⅱ中溶液选用Fe2(SO4)3,不选用Fe(NO3)3的原因为_______ 。
综合上述实验,证实“Ag++Fe2+ Fe3++Ag↓”为可逆反应。
Fe3++Ag↓”为可逆反应。
(2)采用电化学装置进行验证。
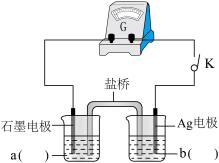
小组同学设计如上图电化学装置进行实验:
i.按照上图的装置图,组装好仪器后,分别在两烧杯中加入一定浓度的a、b两电解质溶液,闭合开关K,观察到的现象为:Ag电极上有灰黑色固体析出,指针向右偏转,一段时间后指针归零,说明此时反应达到平衡。则a为_______ 溶液;b为_______ 溶液;(写a、b化学式)
ii.再向左侧烧杯中滴加较浓的_______ 溶液,产生的现象为_______ 。表明“Ag++Fe2+ Fe3++Ag↓”为可逆反应。
Fe3++Ag↓”为可逆反应。
 Fe3++Ag↓”为可逆反应。
Fe3++Ag↓”为可逆反应。(1)实验验证
实验I:将0.0100mol/LAg2SO4溶液与0.0400mo/LFeSO4溶液(pH=1)等体积混合,产生灰黑色沉淀,溶液呈黄色。
实验Ⅱ:向少量Ag粉中加入0.0100mol/LFe2(SO4)3溶液(pH=1),固体完全溶解。
①取I中沉淀,加入浓硝酸,证实灰黑色沉淀为Ag。请写出该反应的离子方程式:
②Ⅱ中溶液选用Fe2(SO4)3,不选用Fe(NO3)3的原因为
综合上述实验,证实“Ag++Fe2+
 Fe3++Ag↓”为可逆反应。
Fe3++Ag↓”为可逆反应。(2)采用电化学装置进行验证。

小组同学设计如上图电化学装置进行实验:
i.按照上图的装置图,组装好仪器后,分别在两烧杯中加入一定浓度的a、b两电解质溶液,闭合开关K,观察到的现象为:Ag电极上有灰黑色固体析出,指针向右偏转,一段时间后指针归零,说明此时反应达到平衡。则a为
ii.再向左侧烧杯中滴加较浓的
 Fe3++Ag↓”为可逆反应。
Fe3++Ag↓”为可逆反应。
您最近一年使用:0次
2023-08-20更新
|
219次组卷
|
2卷引用:福建省福州市八县(市)一中2022-2023学年高二上学期11月期中联考化学试题
解题方法
10 . 为了探究原电池的工作原理,某研究性学习小组进行了如下实验。
(1)分别按图1中甲、乙所示装置进行实验,甲中两个烧杯中的溶液为同浓度的稀硫酸。
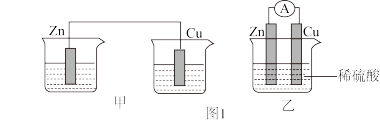
①以下叙述中正确的是___________ (填字母)。
A.甲中锌片是负极,乙中铜片是正极
B.两装置中铜片表面均有气泡产生
C.乙的外电路中电流方向Cu→Zn
D.如果将装置乙中锌片换成铁片,则电路中的电流方向不变
②在乙实验中,某同学发现不仅在铜片上有气泡产生,而且在锌片上也产生了气体,分析原因可能是___________ 。
③在乙实验中,如果把硫酸换成硫酸铜溶液,可观察到正极___________ (填实验现象),其对应的电极反应式为___________ 。
(2)某氢氧燃料电池装置如图2所示,a、b均为惰性电极。
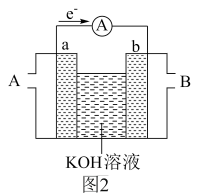
①电池工作时,空气从___________ (填“A”或“B”)口通入。
②正极上的电极反应式为___________
(3)根据构成原电池的本质判断,下列化学(或离子)方程式正确且能设计成原电池的是________。
(1)分别按图1中甲、乙所示装置进行实验,甲中两个烧杯中的溶液为同浓度的稀硫酸。

①以下叙述中正确的是
A.甲中锌片是负极,乙中铜片是正极
B.两装置中铜片表面均有气泡产生
C.乙的外电路中电流方向Cu→Zn
D.如果将装置乙中锌片换成铁片,则电路中的电流方向不变
②在乙实验中,某同学发现不仅在铜片上有气泡产生,而且在锌片上也产生了气体,分析原因可能是
③在乙实验中,如果把硫酸换成硫酸铜溶液,可观察到正极
(2)某氢氧燃料电池装置如图2所示,a、b均为惰性电极。

①电池工作时,空气从
②正极上的电极反应式为
(3)根据构成原电池的本质判断,下列化学(或离子)方程式正确且能设计成原电池的是________。
| A.KOH+HCl=KCl+H2O | B.Cu+2Fe3+=2Fe2++Cu2+ |
| C.Na2CO3+2HCl=2NaCl+H2O+CO2↑ | D.Mg3N2+6H2O=3Mg(OH)2+2NH3↑ |
您最近一年使用:0次