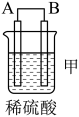
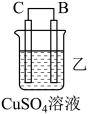
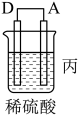
名校
1 . 阅读题目,回答问题:
(1)FeCl3常用于腐蚀印刷电路铜板,反应过程的离子方程式为____ ,若将此反应设计成原电池,请写出该原电池负极电极反应为____ ,正极电极反应为____ 。
(2)为探究FeCl3在H2O2制取O2反应中的作用,某兴趣小组进行下列实验:向试管中加入5mL11mol·L-1H2O2溶液,静置几分钟,无明显现象;滴加2滴1mol·L-1FeCl3溶液,立即产生大量气泡。(已知H2O2不与Cl-反应)
①加FeCl3溶液反应20min后,H2O2的浓度变为10.5mol·L-1,则20min内H2O2的平均反应速率为_____ 。
②反应结束后,滴加KSCN溶液,试管中溶液呈红色。经测定,溶液中Fe3+的量没有变化。综合以实验,可推断出:在H2O2制O2反应中,FeCl3作____ 剂。
(3)H2O2是实验室常见的强氧化剂,在医疗上可用作消毒剂等。某兴趣小组为探究外界条件对H2O2分解反应速率的影响,设计如表所示实验。
填写表中空白内容:II____ ,III____ ,IV____ 。
(4)如图装置可以把氢气中蕴含的化学能转化为电能,被称为氢氧燃料电池。

①该电池的正极是电极____ (填“a”或“b”),负极发生反应的方程式为____ 。
②电池工作时,溶液中的K+会向____ 区移动(填“正极”或“负极”),当外电路中转移1mol电子时,消耗的O2在标准状况下体积为____ 。
(1)FeCl3常用于腐蚀印刷电路铜板,反应过程的离子方程式为
(2)为探究FeCl3在H2O2制取O2反应中的作用,某兴趣小组进行下列实验:向试管中加入5mL11mol·L-1H2O2溶液,静置几分钟,无明显现象;滴加2滴1mol·L-1FeCl3溶液,立即产生大量气泡。(已知H2O2不与Cl-反应)
①加FeCl3溶液反应20min后,H2O2的浓度变为10.5mol·L-1,则20min内H2O2的平均反应速率为
②反应结束后,滴加KSCN溶液,试管中溶液呈红色。经测定,溶液中Fe3+的量没有变化。综合以实验,可推断出:在H2O2制O2反应中,FeCl3作
(3)H2O2是实验室常见的强氧化剂,在医疗上可用作消毒剂等。某兴趣小组为探究外界条件对H2O2分解反应速率的影响,设计如表所示实验。
| 试管编号 | 实验目的 | H2O2溶液 | 温度 | 水的体积/mL | FeCl3溶液体积/mL | |
| 质量分数 | 体积/mL | |||||
| I | 为编号II实验的参照 | 12% | 5.0 | 常温 | 0 | 0 |
| II | 温度对反应速率的影响 | —— | 5.0 | 60℃ | 0 | 0 |
| III | 为编号IV实验的参照 | 4.0% | 5.0 | 常温 | —— | 0 |
| IV | —— | 4.0% | 5.0 | 常温 | 0 | 1.0 |
填写表中空白内容:II
(4)如图装置可以把氢气中蕴含的化学能转化为电能,被称为氢氧燃料电池。

①该电池的正极是电极
②电池工作时,溶液中的K+会向
您最近一年使用:0次
2 . 某研究性学习小组用如图所示的装置进行实验,探究原电池、电解池和电解精炼钴的工作原理。一段时间后装置甲的两极均有气体产生,且X极处溶液逐渐变成紫红色;停止实验观察到铁电极明显变细,电解液仍然澄清。请根据实验现象及所查资料,回答下列问题:
查阅资料:高铁酸根( )在溶液中呈紫红色。
)在溶液中呈紫红色。
(2)装置丙中,若外电路中有0.2 mol电子转移,则有___________ mol  透过隔膜,隔膜右侧溶液质量如何变化:
透过隔膜,隔膜右侧溶液质量如何变化:___________ 。
(3)反应过程中,X极处发生的电极反应为 和
和___________ 。
(4)一段时间后,若X极质量减小1.12 g,Y极收集到2.24 L气体,则在X极收集到的气体为___________ mL(均已折算为标准状况时的气体体积)。
(5)乙池是电解制备金属钴的装置图,理论上Ⅰ室中
___________ (填“变大”“变小”或“不变”),该电解池总反应的化学方程式是___________ 。
(6)若撤掉装置乙中的阳离子交换膜,石墨电极上产生的气体除O2外,还可能有___________ 。
查阅资料:高铁酸根(
 )在溶液中呈紫红色。
)在溶液中呈紫红色。
| A.X(Fe) | B.Y(C) | C.Co | D.Zn |
(2)装置丙中,若外电路中有0.2 mol电子转移,则有
 透过隔膜,隔膜右侧溶液质量如何变化:
透过隔膜,隔膜右侧溶液质量如何变化:(3)反应过程中,X极处发生的电极反应为
 和
和(4)一段时间后,若X极质量减小1.12 g,Y极收集到2.24 L气体,则在X极收集到的气体为
(5)乙池是电解制备金属钴的装置图,理论上Ⅰ室中

(6)若撤掉装置乙中的阳离子交换膜,石墨电极上产生的气体除O2外,还可能有
您最近一年使用:0次
3 . 实验室探究NaHSO3溶液与Cu2+的反应。
I.如图所示制备(经检验装置气密性良好)。
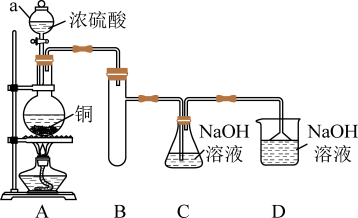
(1)仪器a的名称是___________ ,装置D的作用为___________ 。
(2)写出C中制备NaHSO3的离子方程式___________ 。
Ⅱ.探究NaHSO3溶液与Cu2+的反应,过程如图所示:
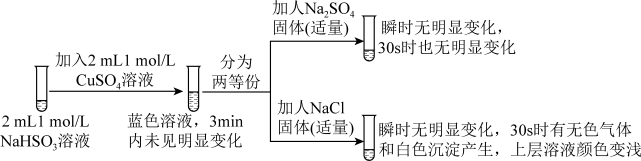
已知:硫酸亚铜易溶于水。回答下列问题:
(3)加入NaCl固体后产生的无色气体和白色沉淀经检验分别是SO2和CuCl,说明发生了氧化还原反应。加入NaCl固体发生反应的原因:
a.Cl-改变了 的还原性 b.Cl-改变了Cu2+的氧化性
的还原性 b.Cl-改变了Cu2+的氧化性
用原电池原理进行试验,探究上述现象可能的原因。
①由实验1、2可知原因a不合理,依据是___________ 。
②实验3:用如图所示装置实验,B中有白色沉淀生成,证明原因b合理。
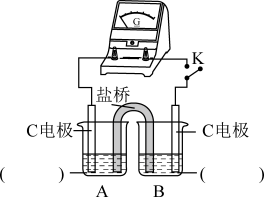
i.补全电化学装置示意图A________________ 、B_____________________ 。
ii.写出B中的电极反应方程式___________ 。
iii.请从反应原理的角度解释原因:Cl-与Cu2+的还原产物Cu+形成沉淀,___________ ,使 与Cu2+的反应能够反应完全。
与Cu2+的反应能够反应完全。
I.如图所示制备(经检验装置气密性良好)。

(1)仪器a的名称是
(2)写出C中制备NaHSO3的离子方程式
Ⅱ.探究NaHSO3溶液与Cu2+的反应,过程如图所示:

已知:硫酸亚铜易溶于水。回答下列问题:
(3)加入NaCl固体后产生的无色气体和白色沉淀经检验分别是SO2和CuCl,说明发生了氧化还原反应。加入NaCl固体发生反应的原因:
a.Cl-改变了
 的还原性 b.Cl-改变了Cu2+的氧化性
的还原性 b.Cl-改变了Cu2+的氧化性用原电池原理进行试验,探究上述现象可能的原因。
| 编号 | 实验1 | 实验2 |
| 实验 | 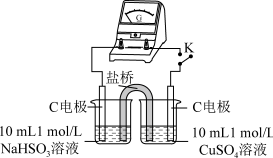 |  |
| 现象 | 闭合开关K,电流计指针发生微小偏 转,烧杯中未见明显现象 | 闭合开关K,电流计指针发生微小偏 转,烧杯中未见明显现象 |
②实验3:用如图所示装置实验,B中有白色沉淀生成,证明原因b合理。

i.补全电化学装置示意图A
ii.写出B中的电极反应方程式
iii.请从反应原理的角度解释原因:Cl-与Cu2+的还原产物Cu+形成沉淀,
 与Cu2+的反应能够反应完全。
与Cu2+的反应能够反应完全。
您最近一年使用:0次
名校
解题方法
4 . 二氯化钒(VCl2)有强还原性和吸湿性,熔点为425°C、沸点为900°C,是制备多种医药、催化剂、含钒化合物的中间体。学习小组在实验室制备VCl2并进行相关探究。回答下列问题:
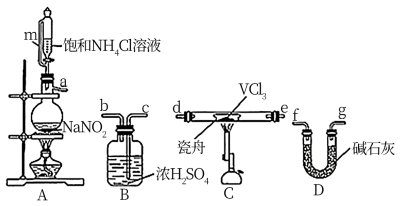
(1)小组同学通过VCl3分解制备VCl2。
①按气流方向,图中装置合理的连接顺序为_______ (用小写字母填空)。
②A中盛放NaNO2的仪器名称为_______ , 其中发生反应的离子方程式为_______ 。
③实验前需通入N2,其作用为_______ 。
(2)测定产品纯度:实验后产品中混有少量VCl3杂质。称量2.795g样品,溶于水充分水解,调pH后滴加Na2CrO4作指示剂,用0.5000mol/LAgNO3标准溶液滴定Cl-,达到滴定终点时消耗标准液体积为100.00mL(Ag2CrO4为砖红色沉淀,杂质不参加反应)。
①滴定终点的现象为_______ 。
②产品中VCl3与VCl2的物质的量之比为_______ 。
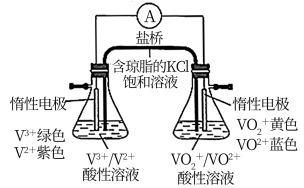
(3)小组同学进一步用如图所示装置比较含钒离子的还原性。接通电路后,观察到右侧锥形瓶中溶液蓝色逐渐变深,发生的电极反应式为_______ ,则VO2+、V2+的还原性较强的是_______ 。

(1)小组同学通过VCl3分解制备VCl2。
①按气流方向,图中装置合理的连接顺序为
②A中盛放NaNO2的仪器名称为
③实验前需通入N2,其作用为
(2)测定产品纯度:实验后产品中混有少量VCl3杂质。称量2.795g样品,溶于水充分水解,调pH后滴加Na2CrO4作指示剂,用0.5000mol/LAgNO3标准溶液滴定Cl-,达到滴定终点时消耗标准液体积为100.00mL(Ag2CrO4为砖红色沉淀,杂质不参加反应)。
①滴定终点的现象为
②产品中VCl3与VCl2的物质的量之比为
(3)小组同学进一步用如图所示装置比较含钒离子的还原性。接通电路后,观察到右侧锥形瓶中溶液蓝色逐渐变深,发生的电极反应式为

您最近一年使用:0次
2021-05-02更新
|
820次组卷
|
2卷引用:黑龙江省哈尔滨市第六中学2021届高三下学期第二次模拟考试理科综合化学试题
名校
解题方法
5 . 化学反应在发生物质变化的同时伴随有能量的变化,是人类获取能量的重要途径,而许多能量的利用与化学反应中的能量变化密切相关。
I.完成下列问题
(1)H2(g) +Cl2(g)=2HCl(g)的反应过程如图所示:
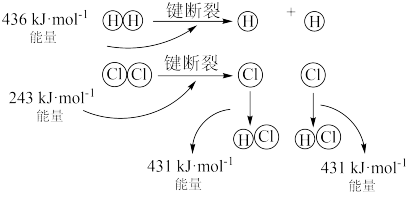
该反应为_______ (填“放热”或“吸热”)反应,其吸收或放出的热量为_______ 。
(2)下列变化中属于吸热反应的是_______ (填序号)。
①液态水汽化
②将胆矾加热变为白色粉末
③浓硫酸稀释
④生石灰与水反应生成熟石灰
⑤CO2 +C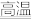 2CO
2CO
⑥Ba(OH)2·8H2O与固体NH4Cl混合
⑦C+ H2O(g) CO+ H2
CO+ H2
⑧Al与盐酸反应
(3)某化学反应中,设反应物的总能量为E1,生成物的总能量为E2。
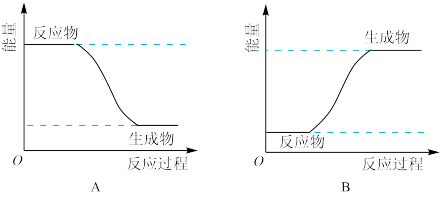
若E1>E2,则该反应可用图_______ (填“A”或“B")表示。
Ⅱ.回答下列问题
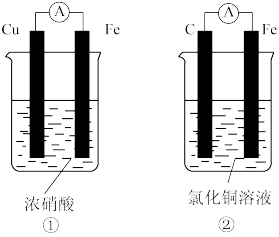
(4)为了验证Fe2+与Cu2+的氧化性强弱,如图装置能达到实验目的的是_______ (填装置序号),其正极的电极反应式为_______ ;若构建该原电池时两个电极的质量相等,当导线中通过0.4mol电子时,两个电极的质量差为_______ g。
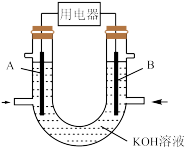
将CH4设计成燃料电池,其利用率更高,装置如图所示(A、B为多孔碳棒)。实验测得OH-定向移向A电极,则_______ (填“A”或“B”)处电极入口通CH4,其电极反应式为_______ 。
I.完成下列问题
(1)H2(g) +Cl2(g)=2HCl(g)的反应过程如图所示:

该反应为
(2)下列变化中属于吸热反应的是
①液态水汽化
②将胆矾加热变为白色粉末
③浓硫酸稀释
④生石灰与水反应生成熟石灰
⑤CO2 +C
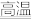 2CO
2CO⑥Ba(OH)2·8H2O与固体NH4Cl混合
⑦C+ H2O(g)
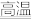 CO+ H2
CO+ H2⑧Al与盐酸反应
(3)某化学反应中,设反应物的总能量为E1,生成物的总能量为E2。

若E1>E2,则该反应可用图
Ⅱ.回答下列问题
(4)为了验证Fe2+与Cu2+的氧化性强弱,如图装置能达到实验目的的是

将CH4设计成燃料电池,其利用率更高,装置如图所示(A、B为多孔碳棒)。实验测得OH-定向移向A电极,则

您最近一年使用:0次
名校
解题方法
6 . 化学能还可以转化为电能,由A、B、C、D四种金属按表中装置图进行实验。
根据实验现象回答下列问题:
(1)装置甲中作正极的是_______ (填“A”或“B”)。
(2)外电路中电流由_______ (填“C极向B极移动”或“B极向C极移动”)。
(3)装置丙中金属A上电极反应属于_______ (填“氧化反应”或“还原反应”)。
(4)四种金属活动性由强到弱的顺序是_______ 。
| 装置 |
|
|
|
| 现象 | 二价金属A不断溶解 | C的质量增加 | A上有气体产生 |
(1)装置甲中作正极的是
(2)外电路中电流由
(3)装置丙中金属A上电极反应属于
(4)四种金属活动性由强到弱的顺序是
您最近一年使用:0次
名校
解题方法
7 . 由A、B、C、D四种金属按下表中装置进行实验。
根据实验现象回答下列问题:
(1)装置甲中正极的电极反应式是__________________ 。
(2)装置乙中正极的电极反应式是__________________ 。
(3)装置丙中负极的电极反应是__________________ 。
(4)四种金属活泼性的强弱顺序是__________________ 。
(5)2019年诺贝尔化学奖授予对锂离子电池研究做出突出贡献的科学家。某锂离子电池的工作原理如下。下列说法正确的是____ (填序号)。
①A为电池的正极
②该装置实现了化学能转化为电能
③电池工作时,电池内部的锂离子定向移动
(6) 是一种大气污染物。工业尾气中含有
是一种大气污染物。工业尾气中含有 ,会造成严重的环境污染;未脱除
,会造成严重的环境污染;未脱除 的煤气,运输过程中还会腐蚀管道。干法氧化铁脱硫是目前除去煤气中
的煤气,运输过程中还会腐蚀管道。干法氧化铁脱硫是目前除去煤气中 的常用方法,其原理如图所示。
的常用方法,其原理如图所示。
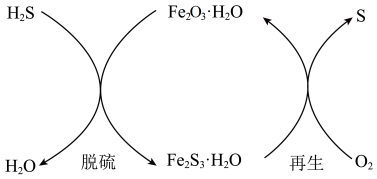
脱硫反应___________ 。再生过程中反应___________________ 。
| 装置 | 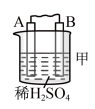 |  |  |
| 现象 | A上有气体产生 | B的质量增加 | 二价金属A不断溶解 |
(1)装置甲中正极的电极反应式是
(2)装置乙中正极的电极反应式是
(3)装置丙中负极的电极反应是
(4)四种金属活泼性的强弱顺序是
(5)2019年诺贝尔化学奖授予对锂离子电池研究做出突出贡献的科学家。某锂离子电池的工作原理如下。下列说法正确的是

①A为电池的正极
②该装置实现了化学能转化为电能
③电池工作时,电池内部的锂离子定向移动
(6)
 是一种大气污染物。工业尾气中含有
是一种大气污染物。工业尾气中含有 ,会造成严重的环境污染;未脱除
,会造成严重的环境污染;未脱除 的煤气,运输过程中还会腐蚀管道。干法氧化铁脱硫是目前除去煤气中
的煤气,运输过程中还会腐蚀管道。干法氧化铁脱硫是目前除去煤气中 的常用方法,其原理如图所示。
的常用方法,其原理如图所示。
脱硫反应
您最近一年使用:0次
8 . 氧化还原反应可拆分为氧化和还原两个“半反应”,某小组同学从“半反应”的角度探究反应规律。
(1)已知: 的转化在酸性条件下才能发生。
的转化在酸性条件下才能发生。
①该转化的还原半反应是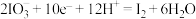 ,则相应的氧化半反应是
,则相应的氧化半反应是___________ 。
②分析上述还原半反应可知:增大 可促进
可促进 得到电子,使其
得到电子,使其___________ 性增强,进而与 发生反应。
发生反应。
(2)探究 与浓盐酸能否发生反应。
与浓盐酸能否发生反应。
①有同学认为 与浓盐酸不能发生反应产生氢气,其依据是
与浓盐酸不能发生反应产生氢气,其依据是___________ 。
用如下装置进行实验【硫酸与浓盐酸中 接近】。
接近】。
②甲实验的目的是___________ 。
③a.丙中气球变鼓是因为生成了___________ 气体(填化学式)。
b.经检测,丙中反应后溶液中存在 。从物质性质角度分析丙中反应能够发生的原因:
。从物质性质角度分析丙中反应能够发生的原因:___________ 。
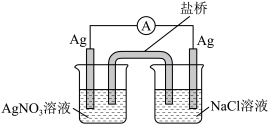
(3)探究以下原电池的工作原理。
实验结果:产生电流,左侧 电极表面有
电极表面有 析出。
析出。
①该装置中左侧  电极作
电极作___________ (填“正”或“负”)极。
②写出该装置右侧 烧杯中的电极反应式___________ 。
对该原电池的电极反应和总反应的反应类型进行分析,发现两极上分别发生氧化和还原反应,而总反应不一定是氧化还原反应。
③结合上述实验思考,仅由以下实验用品能否设计成原电池__________ 。
 片、
片、 浓溶液、蒸馏水、烧杯、盐桥、导线、电流表(选做下列a或b,若两个都作答,按a计分)
浓溶液、蒸馏水、烧杯、盐桥、导线、电流表(选做下列a或b,若两个都作答,按a计分)
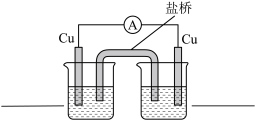
a.若能,在右装置图中填写烧杯中的试剂,并标出电子的移动方向 。
b.若不能,说明原因。
(1)已知:
 的转化在酸性条件下才能发生。
的转化在酸性条件下才能发生。①该转化的还原半反应是
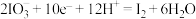 ,则相应的氧化半反应是
,则相应的氧化半反应是②分析上述还原半反应可知:增大
 可促进
可促进 得到电子,使其
得到电子,使其 发生反应。
发生反应。(2)探究
 与浓盐酸能否发生反应。
与浓盐酸能否发生反应。①有同学认为
 与浓盐酸不能发生反应产生氢气,其依据是
与浓盐酸不能发生反应产生氢气,其依据是用如下装置进行实验【硫酸与浓盐酸中
 接近】。
接近】。| 装置 | 序号 | 试管内药品 | 现象 |
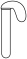 | 甲 | 浓盐酸 | 24小时后仍无明显变化 |
| 乙 |  粉+硫酸 粉+硫酸 | 24小时后仍无明显变化 | |
| 丙 |  粉+浓盐酸 粉+浓盐酸 | 24小时后气球变鼓 |
③a.丙中气球变鼓是因为生成了
b.经检测,丙中反应后溶液中存在
 。从物质性质角度分析丙中反应能够发生的原因:
。从物质性质角度分析丙中反应能够发生的原因:(3)探究以下原电池的工作原理。
实验结果:产生电流,左侧
 电极表面有
电极表面有 析出。
析出。①该装置中
 电极作
电极作②写出该装置

对该原电池的电极反应和总反应的反应类型进行分析,发现两极上分别发生氧化和还原反应,而总反应不一定是氧化还原反应。
③结合上述实验思考,仅由以下实验用品能否设计成原电池
 片、
片、 浓溶液、蒸馏水、烧杯、盐桥、导线、电流表(选做下列a或b,若两个都作答,按a计分)
浓溶液、蒸馏水、烧杯、盐桥、导线、电流表(选做下列a或b,若两个都作答,按a计分)
a.若能,在右装置图中填写烧杯中的试剂,
b.若不能,说明原因。
您最近一年使用:0次
解题方法
9 . Ⅰ.某实验小组同学进行如图1实验,以检验化学反应中的能量变化。请回答下列问题:
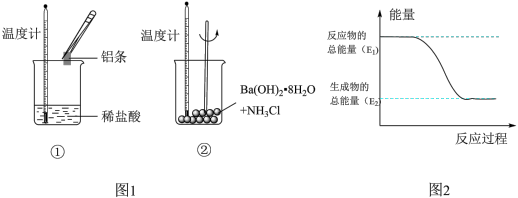
(1)实验中发现,反应后①中的温度升高;②中的温度降低。由此判断铝条与盐酸的反应是________ 热反应。反应过程________ (填“①”或“②”)的能量变化可用图2表示。
Ⅱ.A、B、C、D四种金属按下表中装置进行实验。
(2)根据实验现象回答下列问题:
①装置甲中溶液中的阴离子移向________ 极(填“A”或“B”)。
②装置乙中正极的电极反应式为________ 。
③装置丙中溶液的pH________ (填“变大”“变小”或“不变”)。
④四种金属活动性由强到弱的顺序是________ 。
⑤实验后同学们经过充分讨论,观察原电池反应特点,认真符合某些要求的化学反应都可以通过原电池来实现。下列化学反应在理论上可以设计成原电池的是________ 。
A.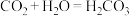 B.
B.
C.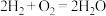 D.
D.

(1)实验中发现,反应后①中的温度升高;②中的温度降低。由此判断铝条与盐酸的反应是
Ⅱ.A、B、C、D四种金属按下表中装置进行实验。
| 装置 | 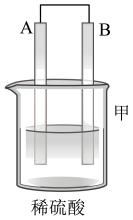 | 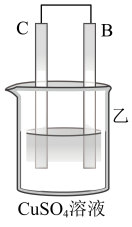 |  |
| 现象 | 二价金属A不断溶解 | C的质量增加 | A上有气体产生 |
①装置甲中溶液中的阴离子移向
②装置乙中正极的电极反应式为
③装置丙中溶液的pH
④四种金属活动性由强到弱的顺序是
⑤实验后同学们经过充分讨论,观察原电池反应特点,认真符合某些要求的化学反应都可以通过原电池来实现。下列化学反应在理论上可以设计成原电池的是
A.
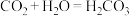 B.
B.
C.
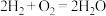 D.
D.
您最近一年使用:0次
解题方法
10 . 为了探究原电池的工作原理,某研究性学习小组进行了如下实验。
(1)分别按图1中甲、乙所示装置进行实验,甲中两个烧杯中的溶液为同浓度的稀硫酸。
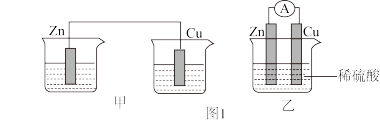
①以下叙述中正确的是___________ (填字母)。
A.甲中锌片是负极,乙中铜片是正极
B.两装置中铜片表面均有气泡产生
C.乙的外电路中电流方向Cu→Zn
D.如果将装置乙中锌片换成铁片,则电路中的电流方向不变
②在乙实验中,某同学发现不仅在铜片上有气泡产生,而且在锌片上也产生了气体,分析原因可能是___________ 。
③在乙实验中,如果把硫酸换成硫酸铜溶液,可观察到正极___________ (填实验现象),其对应的电极反应式为___________ 。
(2)某氢氧燃料电池装置如图2所示,a、b均为惰性电极。
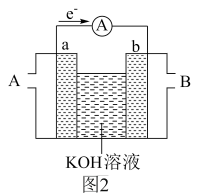
①电池工作时,空气从___________ (填“A”或“B”)口通入。
②正极上的电极反应式为___________
(3)根据构成原电池的本质判断,下列化学(或离子)方程式正确且能设计成原电池的是________。
(1)分别按图1中甲、乙所示装置进行实验,甲中两个烧杯中的溶液为同浓度的稀硫酸。

①以下叙述中正确的是
A.甲中锌片是负极,乙中铜片是正极
B.两装置中铜片表面均有气泡产生
C.乙的外电路中电流方向Cu→Zn
D.如果将装置乙中锌片换成铁片,则电路中的电流方向不变
②在乙实验中,某同学发现不仅在铜片上有气泡产生,而且在锌片上也产生了气体,分析原因可能是
③在乙实验中,如果把硫酸换成硫酸铜溶液,可观察到正极
(2)某氢氧燃料电池装置如图2所示,a、b均为惰性电极。

①电池工作时,空气从
②正极上的电极反应式为
(3)根据构成原电池的本质判断,下列化学(或离子)方程式正确且能设计成原电池的是________。
| A.KOH+HCl=KCl+H2O | B.Cu+2Fe3+=2Fe2++Cu2+ |
| C.Na2CO3+2HCl=2NaCl+H2O+CO2↑ | D.Mg3N2+6H2O=3Mg(OH)2+2NH3↑ |
您最近一年使用:0次