解题方法
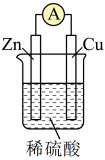
1 . 原电池原理的发现是储能和供能技术的巨大进步,是化学对人类的一项重大贡献。某课外实验小组欲探究铝和铜的金属性(原子失电子能力)强弱,同学们提出了如下实验方案:
A.比较铝和铜的硬度和熔点
B.比较二者在稀硫酸中的反应现象
C.将铝片放入硫酸铜溶液,观察铝片上是否有红色物质
D.将铝片、铜片用导线连接后共同投入氢氧化钠溶液中接入电流计,观察电流方向
(1)上述方案中能达到实验目的的是_______ (填字母)。
(2)上述方案D中负极为_______ ,电极反应为_______ 。
(3)将纯锌片和纯铜片按如图所示方式插入500mL相同浓度的稀硫酸一段时间,两烧杯中均产生气泡,有同学认为产生气泡的位置相同,你赞同吗?请写出理由_______ 。

(4)当甲中产生2.24L(标准状况)气体时,将锌、铜片取出(设反应前后溶液体积不变),再将烧杯中的溶液稀释至1L,测得溶液中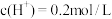 。试确定原稀硫酸的物质的量浓度为
。试确定原稀硫酸的物质的量浓度为_______ mol/L。
(5)镍铁电池放电时也可产生FeO(OH),其工作原理如图所示。
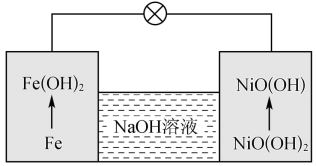
Fe放电生成 后,继续放电时,电极上的
后,继续放电时,电极上的 可转化为
可转化为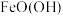 ,写出该过程的电极反应式:
,写出该过程的电极反应式:_______ 。
A.比较铝和铜的硬度和熔点
B.比较二者在稀硫酸中的反应现象
C.将铝片放入硫酸铜溶液,观察铝片上是否有红色物质
D.将铝片、铜片用导线连接后共同投入氢氧化钠溶液中接入电流计,观察电流方向
(1)上述方案中能达到实验目的的是
(2)上述方案D中负极为
(3)将纯锌片和纯铜片按如图所示方式插入500mL相同浓度的稀硫酸一段时间,两烧杯中均产生气泡,有同学认为产生气泡的位置相同,你赞同吗?请写出理由

(4)当甲中产生2.24L(标准状况)气体时,将锌、铜片取出(设反应前后溶液体积不变),再将烧杯中的溶液稀释至1L,测得溶液中
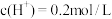 。试确定原稀硫酸的物质的量浓度为
。试确定原稀硫酸的物质的量浓度为(5)镍铁电池放电时也可产生FeO(OH),其工作原理如图所示。

Fe放电生成
 后,继续放电时,电极上的
后,继续放电时,电极上的 可转化为
可转化为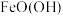 ,写出该过程的电极反应式:
,写出该过程的电极反应式:
您最近一年使用:0次
解题方法
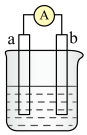
2 . 如图是某化学兴趣小组探究不同条件下化学能转变为电能的装置。请回答下列问题:___________ 。若初始时两电极质量相等,当电路中有2mole﹣通过时,两极的质量差为___________ g。
(2)当电极a为Al,电极b为Mg,电解质溶液为NaOH溶液时,该电池的负极反应式为___________ ,当反应中收集到标准状况下336mL气体时,消耗负极的物质的量为___________ mol。
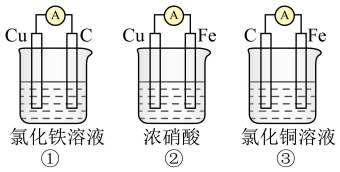
(3)为了验证Fe2+与Cu2+氧化性强弱,下列装置能达到实验目的的是___________ ,写出正极的电极反应式___________ 。___________ (填“正”或“负”)极。
②该电池负极的电极反应式为___________ 。
③工作一段时间后,当3.2g甲醇完全反应生成CO2时,外电路中通过的电子数目为___________ 。(用含NA的式子表示)
(2)当电极a为Al,电极b为Mg,电解质溶液为NaOH溶液时,该电池的负极反应式为
(3)为了验证Fe2+与Cu2+氧化性强弱,下列装置能达到实验目的的是
②该电池负极的电极反应式为
③工作一段时间后,当3.2g甲醇完全反应生成CO2时,外电路中通过的电子数目为
您最近一年使用:0次
名校
解题方法
3 . 请回答下列问题:
(1)铅酸蓄电池是一种可充电电池,其总反应式为Pb+PbO2+2H2SO4 2PbSO4+2H2O,原电池负极的电极反应式为
2PbSO4+2H2O,原电池负极的电极反应式为_______ ,正极附近溶液的pH_______ (填“增大”、“不变”或“减小”)。
(2)为了验证Fe2+与Cu2+氧化性强弱,下列装置能达到实验目的的是_______ ,写出正极的电极反应式_______ 。若开始时两极质量相等,当导线中通过0.2mol电子时,两个电极的质量差为_______ 。
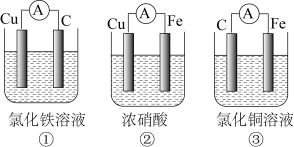
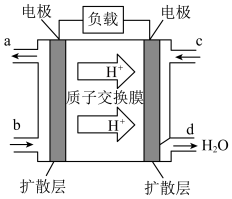
(3)乙醇燃料电池技术方面获得新突破,乙醇(CH3CH2OH)燃料电池的工作原理如图所示。
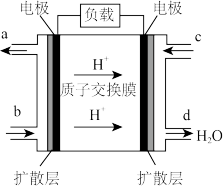
①该电池工作时,c入口处对应的电极为_______ (填“正”或“负”)极,b处入口的物质为_______
②工作一段时间后,当2.3 g乙醇完全反应生成CO2时,外电路中通过的电子数目为_______ 。
(1)铅酸蓄电池是一种可充电电池,其总反应式为Pb+PbO2+2H2SO4
 2PbSO4+2H2O,原电池负极的电极反应式为
2PbSO4+2H2O,原电池负极的电极反应式为(2)为了验证Fe2+与Cu2+氧化性强弱,下列装置能达到实验目的的是
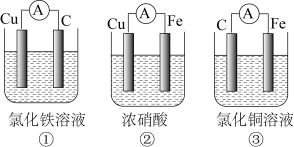
(3)乙醇燃料电池技术方面获得新突破,乙醇(CH3CH2OH)燃料电池的工作原理如图所示。

①该电池工作时,c入口处对应的电极为
②工作一段时间后,当2.3 g乙醇完全反应生成CO2时,外电路中通过的电子数目为
您最近一年使用:0次
2022-11-02更新
|
537次组卷
|
2卷引用:重庆市璧山来凤中学2022-2023学年高二上学期期中考试化学试题
名校
4 . I.为了探究原电池的工作原理,某研究性学习小组进行了如下实验。
(1)按下图中甲、乙所示装置进行实验,甲中两个烧杯中的溶液为同浓度的稀硫酸。_______ (填字母)。
A.甲中锌片是原电池的负极,乙中铜片是原电池的正极
B.两装置中铜片表面均有气泡产生
C.乙的外电路中电流方向
D.如果将装置乙中锌片换成铁片,则电路中的电流方向不变
②在乙实验中,如果把硫酸换成硫酸铜溶液,可观察到正极_______ (填实验现象),其对应的电极反应式为_______ 。
(2)根据构成原电池的本质判断,下列化学(或离子)方程式正确且能设计成原电池的是_______。
Ⅱ.化学反应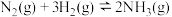 的能量变化如图所示。
的能量变化如图所示。_______ (填“能”或“不能”)将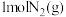 和
和 全部转化为
全部转化为 。
。
(4)该反应属于_______ (填“吸热”或“放热”)反应。
(5)一定量的 和
和 充分反应生成
充分反应生成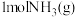 时,释放
时,释放_______  能量。
能量。
(1)按下图中甲、乙所示装置进行实验,甲中两个烧杯中的溶液为同浓度的稀硫酸。

A.甲中锌片是原电池的负极,乙中铜片是原电池的正极
B.两装置中铜片表面均有气泡产生
C.乙的外电路中电流方向

D.如果将装置乙中锌片换成铁片,则电路中的电流方向不变
②在乙实验中,如果把硫酸换成硫酸铜溶液,可观察到正极
(2)根据构成原电池的本质判断,下列化学(或离子)方程式正确且能设计成原电池的是_______。
A.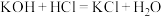 |
B.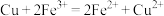 |
C. |
D.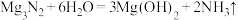 |
Ⅱ.化学反应
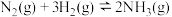 的能量变化如图所示。
的能量变化如图所示。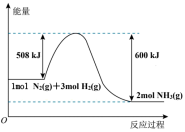
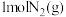 和
和 全部转化为
全部转化为 。
。(4)该反应属于
(5)一定量的
 和
和 充分反应生成
充分反应生成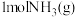 时,释放
时,释放 能量。
能量。
您最近一年使用:0次
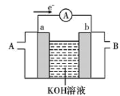
5 . 电解工作原理的实际应用非常广泛。
(1)电解精炼银时,粗银作___________ ,阴极反应为___________ 。
(2)工业上为了处理含有Cr2O 的酸性工业废水,采用下面的处理方法:往工业废水中加入适量NaCl,以铁为电极进行电解,经过一段时间,有Cr(OH)3和Fe(OH)3沉淀生成,工业废水中铬元素的含量可低于排放标准。关于上述方法,下列说法错误的是___________(填字母)。
的酸性工业废水,采用下面的处理方法:往工业废水中加入适量NaCl,以铁为电极进行电解,经过一段时间,有Cr(OH)3和Fe(OH)3沉淀生成,工业废水中铬元素的含量可低于排放标准。关于上述方法,下列说法错误的是___________(填字母)。
(3)某同学设计了如图装置进行以下电化学实验。
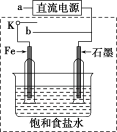
①当开关K与a连接时,两极均有气泡产生,则阴极为___________ 电极。
②一段时间后,使开关K与a断开,与b连接时,虚线框内的装置可称为___________ 。请写出此时Fe电极上的电极反应___________ 。
(4)1 L某溶液中含有的离子如下表:
用惰性电极电解该溶液,当电路中有3 mol e-通过时(忽略电解时溶液体积变化及电极产物可能存在的溶解现象),下列说法正确的是___________(填字母)。
(1)电解精炼银时,粗银作
(2)工业上为了处理含有Cr2O
 的酸性工业废水,采用下面的处理方法:往工业废水中加入适量NaCl,以铁为电极进行电解,经过一段时间,有Cr(OH)3和Fe(OH)3沉淀生成,工业废水中铬元素的含量可低于排放标准。关于上述方法,下列说法错误的是___________(填字母)。
的酸性工业废水,采用下面的处理方法:往工业废水中加入适量NaCl,以铁为电极进行电解,经过一段时间,有Cr(OH)3和Fe(OH)3沉淀生成,工业废水中铬元素的含量可低于排放标准。关于上述方法,下列说法错误的是___________(填字母)。| A.阳极反应:Fe-2e-=Fe2+ | B.阴极反应:2H++2e-=H2↑ |
| C.在电解过程中工业废水由酸性变为碱性 | D.可以将铁电极改为石墨电极 |

①当开关K与a连接时,两极均有气泡产生,则阴极为
②一段时间后,使开关K与a断开,与b连接时,虚线框内的装置可称为
(4)1 L某溶液中含有的离子如下表:
| 离子 | Cu2+ | Al3+ | NO | Cl- |
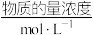 | 1 | 1 | a | 1 |
| A.电解后溶液呈酸性 | B.a=3 |
| C.阳极生成1.5 mol Cl2 | D.阴极析出的金属是铜与铝 |
您最近一年使用:0次
名校
解题方法
6 . 人们应用原电池原理制作了多种电池以满足不同的需要。在现代生活、生产和科学技术发展中,电池发挥着越来越重要的作用。请根据题中提供的信息,回答下列问题:
(1)直接提供电能的反应一般是放热反应,下列反应能设计成原电池的是_______(填字母,下同)。
(2)为了探究原电池的工作原理,某研究性学习小组进行了如下实验。分别按图1中甲、乙所示装置进行实验,甲中两个烧杯中的溶液为同浓度的稀硫酸。_______ (填字母)。
A.甲中锌片是负极,乙中铜片是正极
B.两装置中铜片表面均有气泡产生
C.乙的外电路中电流方向Cu→Zn
D.如果将装置乙中锌片换成铁片,则电路中的电流方向不变
②在乙实验中,某同学发现不仅在铜片上有气泡产生,而且在锌片上也产生了气体,分析原因可能是_______ 。
③在乙实验中,如果把硫酸换成硫酸铜溶液,可观察到正极_______ (填实验现象),其对应的电极反应式为_______ 。
(3)某氢氧燃料电池装置如图所示,a、b均为惰性电极。_______ (填“A”或“B”)口通入。
②负极上的电极反应式为_______ ,当电路中转移 电子时,理论上负极通入的气体在标准状况下的体积为
电子时,理论上负极通入的气体在标准状况下的体积为_______ L。
(1)直接提供电能的反应一般是放热反应,下列反应能设计成原电池的是_______(填字母,下同)。
A.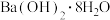 与 与 反应 反应 | B.氢氧化钠与稀盐酸反应 |
C.灼热的炭与 反应 反应 | D. 与 与 燃烧反应 燃烧反应 |
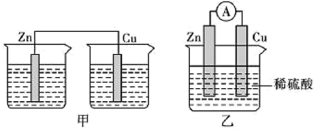
A.甲中锌片是负极,乙中铜片是正极
B.两装置中铜片表面均有气泡产生
C.乙的外电路中电流方向Cu→Zn
D.如果将装置乙中锌片换成铁片,则电路中的电流方向不变
②在乙实验中,某同学发现不仅在铜片上有气泡产生,而且在锌片上也产生了气体,分析原因可能是
③在乙实验中,如果把硫酸换成硫酸铜溶液,可观察到正极
(3)某氢氧燃料电池装置如图所示,a、b均为惰性电极。
②负极上的电极反应式为
 电子时,理论上负极通入的气体在标准状况下的体积为
电子时,理论上负极通入的气体在标准状况下的体积为
您最近一年使用:0次
名校
7 . 完成下列问题。
(1)下列反应中,属于放热反应的是___________ (填字母,下同),属于吸热反应的是___________ 。
a.盐酸与烧碱溶液反应 b.Ba(OH)2·8H2O+2NH4Cl=BaCl2+10H2O+2NH3↑
c.氢气在氧气中燃烧生成水 d.高温煅烧石灰石使其分解
e.铝和盐酸反应 f.葡萄糖在人体内氧化分解
(2)为了研究化学反应A+B=C+D的能量变化情况,某同学设计了如图所示装置。当向盛有A的试管中滴加试剂B时,看到U形管中甲处液面下降乙处液面上升。
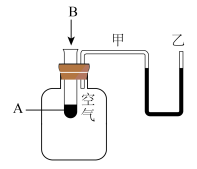
试回答下列问题:
①该反应为___________ 反应(填“放热”或“吸热”)。
②该反应的反应物化学键断裂吸收的能量________ (填“高”或“低”)于生成物化学键形成放出的能量。
(3) A、B、C、D四种金属按下表中装置进行实验。
根据实验现象回答下列问题:
①装置甲溶液中的阴离子移向________ (填“A”或“B”)极。
②装置乙中正极的电极反应式为________ 。
③四种金属活动性由强到弱的顺序是________ 。
(4)甲烷可直接应用于燃料电池,该电池采用KOH溶液为电解质,其工作原理如下图所示:
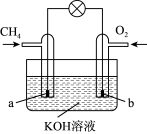
①外电路电子移动方向:___________ (填“a极到b极”或“b极到a极”)。
②a电极的电极方程式为___________ 。
(1)下列反应中,属于放热反应的是
a.盐酸与烧碱溶液反应 b.Ba(OH)2·8H2O+2NH4Cl=BaCl2+10H2O+2NH3↑
c.氢气在氧气中燃烧生成水 d.高温煅烧石灰石使其分解
e.铝和盐酸反应 f.葡萄糖在人体内氧化分解
(2)为了研究化学反应A+B=C+D的能量变化情况,某同学设计了如图所示装置。当向盛有A的试管中滴加试剂B时,看到U形管中甲处液面下降乙处液面上升。

试回答下列问题:
①该反应为
②该反应的反应物化学键断裂吸收的能量
(3) A、B、C、D四种金属按下表中装置进行实验。
| 装置 | 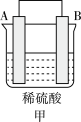 |  |  |
| 现象 | 金属A不断溶解 | C的质量增加 | A上有气体产生 |
①装置甲溶液中的阴离子移向
②装置乙中正极的电极反应式为
③四种金属活动性由强到弱的顺序是
(4)甲烷可直接应用于燃料电池,该电池采用KOH溶液为电解质,其工作原理如下图所示:

①外电路电子移动方向:
②a电极的电极方程式为
您最近一年使用:0次
23-24高一下·全国·课前预习
解题方法
8 . 化学能
(1)如图所示,请写出锌与稀硫酸反应的化学方程式___________ 。
(2)装置中锌片上发生___________ (“氧化”或“还原”)反应,能证明化学能转化为电能的实验现象为___________ 。装置中锌片表面如何变化___________ ?电流表是否偏转___________ ?
(3)Cu的作用是___________ 。
a.离子导体 b.电子导体

(1)如图所示,请写出锌与稀硫酸反应的化学方程式
(2)装置中锌片上发生
(3)Cu的作用是
a.离子导体 b.电子导体
您最近一年使用:0次
9 . 应用电化学原理,回答下列问题:
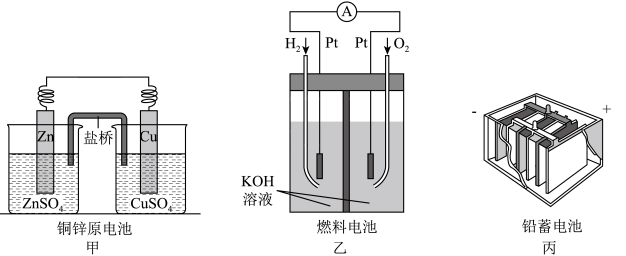
(1)上述三个装置中,负极反应的共同特点是_____________________ 。
(2)甲电池工作时,盐桥(装有含琼胶的KCl饱和溶液)中离子移动的方向是________________ 。
(3)乙中正极反应式为____________________ ;若将H2换成CH4,则负极反应式为______________________ 。
(4)丙中铅蓄电池放电一段时间后,进行充电时,要将外接电源的负极与铅蓄电池______ 极相连接。
(5)应用原电池反应可以探究氧化还原反应进行的方向和程度。按右图连接装置并加入药品(盐桥中的物质不参与反应),进行实验:
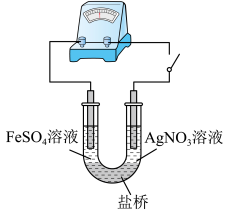
a.K闭合时,指针偏移。放置一段时间后,指针偏移减小。
b.随后向U型管左侧逐渐加入浓Fe2(SO4)3溶液,发现电流计指针的变化依次为:偏移减小→回到零点→逆向偏移。
① 实验a中银作_________ 极。
② 综合实验a和b的现象,得出Ag+和Fe2+反应的离子方程式是_____________________ 。

(1)上述三个装置中,负极反应的共同特点是
(2)甲电池工作时,盐桥(装有含琼胶的KCl饱和溶液)中离子移动的方向是
(3)乙中正极反应式为
(4)丙中铅蓄电池放电一段时间后,进行充电时,要将外接电源的负极与铅蓄电池
(5)应用原电池反应可以探究氧化还原反应进行的方向和程度。按右图连接装置并加入药品(盐桥中的物质不参与反应),进行实验:

a.K闭合时,指针偏移。放置一段时间后,指针偏移减小。
b.随后向U型管左侧逐渐加入浓Fe2(SO4)3溶液,发现电流计指针的变化依次为:偏移减小→回到零点→逆向偏移。
① 实验a中银作
② 综合实验a和b的现象,得出Ag+和Fe2+反应的离子方程式是
您最近一年使用:0次
解题方法
10 . 利用所学电化学反应原理,解决以下问题:
Ⅰ.如图所示,A为电源,B为浸透饱和食盐水和酚酞溶液的滤纸,滤纸中央滴有一滴KMnO4溶液,C、D为电解槽,其电极材料及电解质溶液如图所示。
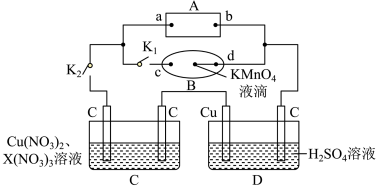
(1)闭合K1,断开K2,通电后,d端显红色,则电源b端为___________ 极,若c、d为惰性电极,检验c端产物的方法为___________ 。滤纸中央KMnO4溶液处发生的现象为___________ 。
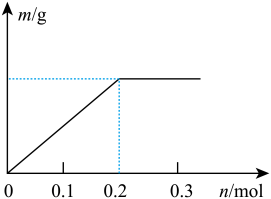
(2)已知C装置中溶液的溶质为Cu(NO3)2和X(NO3)3,且均为0.1mol,打开K1,关闭K2, 通电一段时间后,阴极析出固体质量m(g)与通过电子的物质的量n(mol)关系如图所示,则Cu2+、X3+、H+氧化能力由大到小的顺序是___________ 。
(3)D装置中溶液是H2SO4溶液,则电极C端从开始至一段时间后的实验现象是___________ 。
Ⅱ.电化学技术是有效解决 CO、SO2、NOx 等大气污染的重要方法,某兴趣小组以SO2为原料,采用电化学方法制取硫酸,装置如下 :
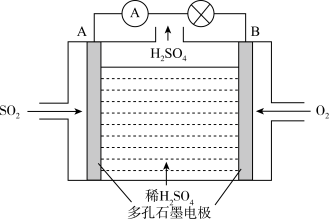
(4)电解质溶液中 离子向
离子向___________ (填“A极”或“B极” )移动。
(5)请写出负极电极反应式___________ 。
(6)用该原电池做电源,石墨做电极电解2L AgNO3和KNO3混合溶液,通电一段时间,两极均产生2.24 L(标准状况)气体,假设电解前后溶液体积不变,则电解后溶液中H+的浓度为___________ 。
Ⅰ.如图所示,A为电源,B为浸透饱和食盐水和酚酞溶液的滤纸,滤纸中央滴有一滴KMnO4溶液,C、D为电解槽,其电极材料及电解质溶液如图所示。

(1)闭合K1,断开K2,通电后,d端显红色,则电源b端为
(2)已知C装置中溶液的溶质为Cu(NO3)2和X(NO3)3,且均为0.1mol,打开K1,关闭K2, 通电一段时间后,阴极析出固体质量m(g)与通过电子的物质的量n(mol)关系如图所示,则Cu2+、X3+、H+氧化能力由大到小的顺序是

(3)D装置中溶液是H2SO4溶液,则电极C端从开始至一段时间后的实验现象是
Ⅱ.电化学技术是有效解决 CO、SO2、NOx 等大气污染的重要方法,某兴趣小组以SO2为原料,采用电化学方法制取硫酸,装置如下 :

(4)电解质溶液中
 离子向
离子向(5)请写出负极电极反应式
(6)用该原电池做电源,石墨做电极电解2L AgNO3和KNO3混合溶液,通电一段时间,两极均产生2.24 L(标准状况)气体,假设电解前后溶液体积不变,则电解后溶液中H+的浓度为
您最近一年使用:0次
2023-07-25更新
|
89次组卷
|
2卷引用:甘肃省平凉市2022-2023学年高三上学期11月期中化学试题



