名校
解题方法
1 . 碳酸钠和碳酸氢钠都是厨房中常用的化学药品。某同学为了鉴别碳酸钠和碳酸氢钠两种白色固体,用不同的方法做了以下实验,如图Ⅰ~Ⅳ所示。
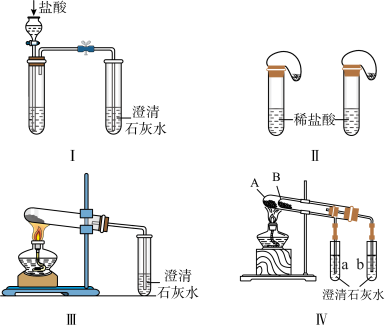
(1)实验Ⅰ、Ⅱ(盐酸足量且固体质量相同)中能够达到实验目的的是___________ 。
(2)实验Ⅲ、Ⅳ均能鉴别这两种物质。与实验Ⅲ相比,实验Ⅳ的优点是___________。
(3)若用实验Ⅳ验证碳酸钠和碳酸氢钠的稳定性,则试管B中装入的固体最好是___________ 。
(4)除了上述检验方法,再写出一种鉴别碳酸钠和碳酸氢钠的方案。要求方案中包括实验试剂、现象、结论。你的方案:___________ 。

(1)实验Ⅰ、Ⅱ(盐酸足量且固体质量相同)中能够达到实验目的的是
(2)实验Ⅲ、Ⅳ均能鉴别这两种物质。与实验Ⅲ相比,实验Ⅳ的优点是___________。
| A.Ⅳ比Ⅲ复杂 | B.Ⅳ比Ⅲ安全 |
| C.Ⅳ比Ⅲ操作简单 | D.Ⅳ可以做到用一套装置同时进行两个对比实验,而Ⅲ不行 |
(3)若用实验Ⅳ验证碳酸钠和碳酸氢钠的稳定性,则试管B中装入的固体最好是
(4)除了上述检验方法,再写出一种鉴别碳酸钠和碳酸氢钠的方案。要求方案中包括实验试剂、现象、结论。你的方案:
您最近一年使用:0次
名校
解题方法
2 . 化学反应中伴随着能量变化,请按要求回答下面的问题。
(1)下列反应中,生成物总能量大于反应物总能量的是______ (填序号)
①酸与碱的中和反应 ②碳酸氢钠和盐酸反应 ③镁和盐酸反应 ④碳与二氧化碳反应 ⑤ 晶体与
晶体与 混合搅拌
混合搅拌
(2)汽车发动机工作时会引发 和
和 反应,生成
反应,生成 等污染大气,如图是
等污染大气,如图是 和
和 反应生成
反应生成 的能量变化,则图中三种分子最稳定的是
的能量变化,则图中三种分子最稳定的是______ (写分子式)。若反应生成 气体,则
气体,则______ (填“吸收”或“放出”)______  的热量。
的热量。
根据实验现象回答:四种金属活泼性由强到弱的顺序是______ 。
(4)根据原电池原理可以制造化学电池。如:电动汽车上用的铅蓄电池,放电时的电池总反应为
该铅蓄电池负极材料是______ ,写出放电时正极的电极反应式______ 。
(5)为了验泟 与
与 氧化性强弱,下列装置能达到实验目的的是
氧化性强弱,下列装置能达到实验目的的是______ (写序号),写出其正极的电极反应式______ 。若开始时两极质量相等,当导线中通过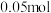 电子时,两个电极的质量差为
电子时,两个电极的质量差为______ 克。
(1)下列反应中,生成物总能量大于反应物总能量的是
①酸与碱的中和反应 ②碳酸氢钠和盐酸反应 ③镁和盐酸反应 ④碳与二氧化碳反应 ⑤
 晶体与
晶体与 混合搅拌
混合搅拌(2)汽车发动机工作时会引发
 和
和 反应,生成
反应,生成 等污染大气,如图是
等污染大气,如图是 和
和 反应生成
反应生成 的能量变化,则图中三种分子最稳定的是
的能量变化,则图中三种分子最稳定的是 气体,则
气体,则 的热量。
的热量。
| 装置 |
|
|
|
| 现象 | 二价金属A不断溶解 | C的质量增加 | A上有气体产生 |
(4)根据原电池原理可以制造化学电池。如:电动汽车上用的铅蓄电池,放电时的电池总反应为

该铅蓄电池负极材料是
(5)为了验泟
 与
与 氧化性强弱,下列装置能达到实验目的的是
氧化性强弱,下列装置能达到实验目的的是 电子时,两个电极的质量差为
电子时,两个电极的质量差为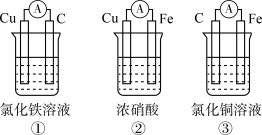
您最近一年使用:0次
解题方法
3 . I.原电池可将化学能转化为电能。由A、B、C、D四种金属按下表中装置进行实验:
(1)装置甲中 向
向___________ 极移动(填“A”或“B”);
(2)四种金属活动性由强到弱的顺序是___________ ;
(3)若装置丙中的电极为质量相等的铁棒和铜棒,电池工作一段时间后,取出洗净、干燥、称量,两电极质量差为6g.则导线中通过电子的物质的量为___________ mol。
II.化学电池在通讯、交通及日常生活中有着广泛的应用。
(1)下图为甲烷燃料电池的构造示意图,由此判断

Y极为电池的___________ 极,X极的电极反应方程式为___________ ,电路中每转移0.2mol电子,标准状况下正极上消耗气体的体积是___________ L。
(2)为了验证Fe3+与Cu2+氧化性强弱,设计一个装置,下列装置既能产生电流又能达到实验目的的是___________ 。
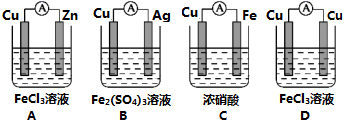
(3)铅蓄电池是常见的化学电源之一,其充电、放电的总反应是:2PbSO4+2H2O Pb +PbO2+2H2SO4.铅蓄电池放电时正极是
Pb +PbO2+2H2SO4.铅蓄电池放电时正极是___________ (填物质化学式),该电极质量___________ (填“增加”或“减少)。若电解液体积为2L(反应过程溶液体积变化忽略不计),放电过程中外电路中转移3mol电子,则硫酸浓度由5mol/L下降到___________ mol/L。
| 装置 | 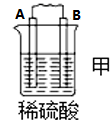 | 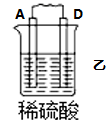 | 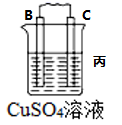 |
| 现象 | B上有气体产生 | D不断溶解 | C质量增加 |
(1)装置甲中
 向
向(2)四种金属活动性由强到弱的顺序是
(3)若装置丙中的电极为质量相等的铁棒和铜棒,电池工作一段时间后,取出洗净、干燥、称量,两电极质量差为6g.则导线中通过电子的物质的量为
II.化学电池在通讯、交通及日常生活中有着广泛的应用。
(1)下图为甲烷燃料电池的构造示意图,由此判断

Y极为电池的
(2)为了验证Fe3+与Cu2+氧化性强弱,设计一个装置,下列装置既能产生电流又能达到实验目的的是

(3)铅蓄电池是常见的化学电源之一,其充电、放电的总反应是:2PbSO4+2H2O
 Pb +PbO2+2H2SO4.铅蓄电池放电时正极是
Pb +PbO2+2H2SO4.铅蓄电池放电时正极是
您最近一年使用:0次
名校
4 . 回答下列问题
(1)甲醇是一种可再生能源,由 制备甲醇可能涉及的反应如下:
制备甲醇可能涉及的反应如下:
反应Ⅰ: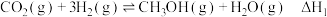
反应Ⅱ: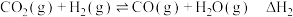
反应Ⅲ: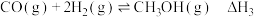
反应Ⅰ、Ⅱ、Ⅲ平衡常数分别为 ,则
,则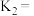
___________ (用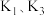 表示)。
表示)。
(2)某探究小组用 与大理石反应过程中质量减小的方法,研究影响反应速率的因素。所用
与大理石反应过程中质量减小的方法,研究影响反应速率的因素。所用 浓度为
浓度为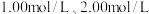 ,大理石有细颗粒和粗颗粒两种规格,实验温度为
,大理石有细颗粒和粗颗粒两种规格,实验温度为 、
、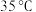 ,每次实验
,每次实验 的用量为
的用量为 ,大理石用量为
,大理石用量为 。
。
请完成实验设计表,其中a为___________ ,e为___________ 。
(3)①氯气是制备系列含氯化合物的主要原料,可采用如图A所示的装置来制取氯气。装置中的离子膜只允许___________ (填“ ”或“
”或“ ”)通过,氯气的逸出口是
”)通过,氯气的逸出口是___________ (填标号“ ”或“b”)。
”或“b”)。

② 和
和 都是比较稳定的分子,科学家利用电化学装置实现两种分子的耦合转化,其原理如图B所示:阴极上的反应式为
都是比较稳定的分子,科学家利用电化学装置实现两种分子的耦合转化,其原理如图B所示:阴极上的反应式为___________ 。

(1)甲醇是一种可再生能源,由
 制备甲醇可能涉及的反应如下:
制备甲醇可能涉及的反应如下:反应Ⅰ:
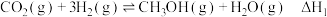
反应Ⅱ:
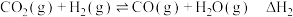
反应Ⅲ:
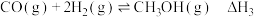
反应Ⅰ、Ⅱ、Ⅲ平衡常数分别为
 ,则
,则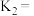
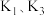 表示)。
表示)。(2)某探究小组用
 与大理石反应过程中质量减小的方法,研究影响反应速率的因素。所用
与大理石反应过程中质量减小的方法,研究影响反应速率的因素。所用 浓度为
浓度为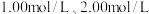 ,大理石有细颗粒和粗颗粒两种规格,实验温度为
,大理石有细颗粒和粗颗粒两种规格,实验温度为 、
、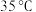 ,每次实验
,每次实验 的用量为
的用量为 ,大理石用量为
,大理石用量为 。
。| 实验编号 | 温度( ) ) | 大理石规格 |  (浓度) (浓度)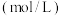 | 实验目的 |
| ① | 25 | 粗颗粒 | 2.00 | (Ⅰ)实验①和②探究浓度对反应速率的影响; (Ⅱ)实验①和③探究温度对反应速率的影响; (Ⅲ)实验①和④探究e___________对反应速率的影响 |
| ② | 25 | 粗颗粒 | a___________ | |
| ③ | b___________ | 粗颗粒 | 2.00 | |
| ④ | c___________ | 细颗粒 | d___________ |
(3)①氯气是制备系列含氯化合物的主要原料,可采用如图A所示的装置来制取氯气。装置中的离子膜只允许
 ”或“
”或“ ”)通过,氯气的逸出口是
”)通过,氯气的逸出口是 ”或“b”)。
”或“b”)。
②
 和
和 都是比较稳定的分子,科学家利用电化学装置实现两种分子的耦合转化,其原理如图B所示:阴极上的反应式为
都是比较稳定的分子,科学家利用电化学装置实现两种分子的耦合转化,其原理如图B所示:阴极上的反应式为
您最近一年使用:0次
5 . 在呼吸面具或潜水艇中可用过氧化钠作为供氧剂。请选用适当的化学试剂和实验用品,用图中的实验装置进行实验,证明过氧化钠可作供氧剂。

(1)填写表中空格:
已知A中放有碳酸钙,分液漏斗装稀盐酸:
(2)为了达到实验目的,____________ (填“需要”或“不需要”)在B装置之后增加一个吸收水蒸气的装置。
(3)写出C中发生反应的化学方程式:_____ (任写一个),从氧化剂和还原剂的角度分析,在上述反应中过氧化钠的作用是__________ 。
(4)试管F中收集满气体后,检验气体的实验操作是__________ 。
(5)判断过氧化钠是否发生反应,除了从试管F中收集满气体外,还可以从C装置中______ 的实验现象来判断。

(1)填写表中空格:
已知A中放有碳酸钙,分液漏斗装稀盐酸:
| 仪器 | 加入试剂 | 加入该试剂的目的 |
| B | 饱和 | 除出CO2气体中混人的HCI |
| C | 石棉绒与过氧化钠 | 与CO2反应,产生O2 |
| D | NaOH溶液 |
(3)写出C中发生反应的化学方程式:
(4)试管F中收集满气体后,检验气体的实验操作是
(5)判断过氧化钠是否发生反应,除了从试管F中收集满气体外,还可以从C装置中
您最近一年使用:0次
6 . 化学为疫情防控提供了强有力的支撑。许多含氯物质既是重要化工原料,又是高效、广谱的灭菌消毒剂。
(1)舍勒用软锰矿(主要成分为二氧化锰)为原料得到氯气,反应的化学方程式为_______ 。
(2)应用以上原理制备、净化、收集氯气并进行性质检验和尾气处理,下列装置(“→”表示气流方向)不能达到实验目的的是_______ 。
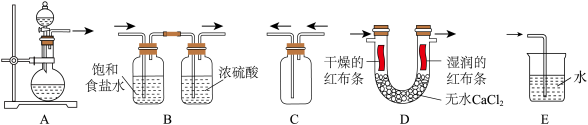
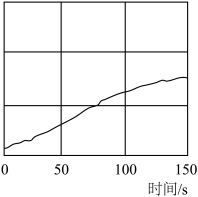
(3)为验证氯水中HClO分解的产物,现用强光照射氯水,并用氯离子浓度传感器、氧气传感器(测体积分数)、pH传感器等仪器进行数据采集,获得相关变化曲线如图。图中纵坐标可表示的物理量是_______ (任写两个)。
(4)下列物质常用于杀菌消毒,其中消毒原理与HClO相同的是_______
(5)84消毒液的主要成分为NaClO和NaCl,不能与酸性清洁剂混合使用,其原因是_______ 。
(6)二氧化氯( )是常用消毒剂,但其稳定性差,通常把它通入
)是常用消毒剂,但其稳定性差,通常把它通入 和NaOH的混合溶液中,使之转化成
和NaOH的混合溶液中,使之转化成 ,便于运输储存。写出对应的离子方程式
,便于运输储存。写出对应的离子方程式_______ 。
(7)“有效氯含量”可用来衡量含氯消毒剂的消毒能力,是指每克含氯消毒剂的氧化能力相当于多少克 的氧化能力,NaClO、
的氧化能力,NaClO、 、
、 作为消毒剂,还原产物相同,这三种消毒剂的有效氯含量由大到小的顺序为
作为消毒剂,还原产物相同,这三种消毒剂的有效氯含量由大到小的顺序为_______ 。
(1)舍勒用软锰矿(主要成分为二氧化锰)为原料得到氯气,反应的化学方程式为
(2)应用以上原理制备、净化、收集氯气并进行性质检验和尾气处理,下列装置(“→”表示气流方向)不能达到实验目的的是

(3)为验证氯水中HClO分解的产物,现用强光照射氯水,并用氯离子浓度传感器、氧气传感器(测体积分数)、pH传感器等仪器进行数据采集,获得相关变化曲线如图。图中纵坐标可表示的物理量是

(4)下列物质常用于杀菌消毒,其中消毒原理与HClO相同的是_______
A. | B.酒精 | C.熟石灰 | D. |
(6)二氧化氯(
 )是常用消毒剂,但其稳定性差,通常把它通入
)是常用消毒剂,但其稳定性差,通常把它通入 和NaOH的混合溶液中,使之转化成
和NaOH的混合溶液中,使之转化成 ,便于运输储存。写出对应的离子方程式
,便于运输储存。写出对应的离子方程式(7)“有效氯含量”可用来衡量含氯消毒剂的消毒能力,是指每克含氯消毒剂的氧化能力相当于多少克
 的氧化能力,NaClO、
的氧化能力,NaClO、 、
、 作为消毒剂,还原产物相同,这三种消毒剂的有效氯含量由大到小的顺序为
作为消毒剂,还原产物相同,这三种消毒剂的有效氯含量由大到小的顺序为
您最近一年使用:0次
7 . 氧化还原反应在工农业生产、日常生活中具有广泛的用途。
(1)工业干法制备高铁酸钾的第一步反应为: 。该反应中氧化产物为
。该反应中氧化产物为_______ 。
(2)已知下列三个氧化还原反应:①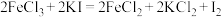 ;②
;②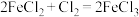 ;③
;③ 。若溶质中
。若溶质中 与
与 共存,为了氧化
共存,为了氧化 而
而 不被氧化,除单质外,还可用反应中的
不被氧化,除单质外,还可用反应中的_______ (从下列三个反应中选择)作氧化剂。
(3)无水情况下, 可以和
可以和 发生如下反应:_______
发生如下反应:_______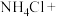 _______
_______ _______
_______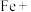 _______
_______ _______
_______ _______
_______ 。配平上述反应方程式,单线桥法标出电子转移的方向和数目
。配平上述反应方程式,单线桥法标出电子转移的方向和数目_______ ;
(4)向含有 、
、 的溶液中通入一定量的氯气,再向反应后的溶液中滴加少量的KSCN溶液,结果溶液变为红色。已知:①还原性
的溶液中通入一定量的氯气,再向反应后的溶液中滴加少量的KSCN溶液,结果溶液变为红色。已知:①还原性 ;②KSCN溶液可用于检验
;②KSCN溶液可用于检验 的存在,溶液呈红色。则下列叙述中正确的是
的存在,溶液呈红色。则下列叙述中正确的是_______ 。
①氧化性: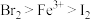
②原溶液中 一定被氧化
一定被氧化
③通入氯气后,原溶液中的 一定被氧化
一定被氧化
④不能确定通入氯气后的溶液中是否还存在
(5)下列转化中,需要加入还原剂才能实现的是_______。
(6)2020年8月初,某海外港口因硝酸铵分解引发剧烈爆炸,已知: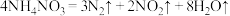 ,则该反应中被还原和被氧化的N原子数之比为
,则该反应中被还原和被氧化的N原子数之比为_______ 。
(7)用如图装置可验证 是否具有漂白性。为达到实验目的,c、d、e三处依次放入的物质为
是否具有漂白性。为达到实验目的,c、d、e三处依次放入的物质为_______ (填序号)。
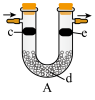
①干燥的有色布条 ②湿润的有色布条 ③浓硫酸 ④碱石灰 ⑤无水
(1)工业干法制备高铁酸钾的第一步反应为:
 。该反应中氧化产物为
。该反应中氧化产物为(2)已知下列三个氧化还原反应:①
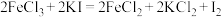 ;②
;②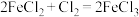 ;③
;③ 。若溶质中
。若溶质中 与
与 共存,为了氧化
共存,为了氧化 而
而 不被氧化,除单质外,还可用反应中的
不被氧化,除单质外,还可用反应中的(3)无水情况下,
 可以和
可以和 发生如下反应:_______
发生如下反应:_______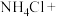 _______
_______ _______
_______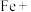 _______
_______ _______
_______ _______
_______ 。配平上述反应方程式,单线桥法标出电子转移的方向和数目
。配平上述反应方程式,单线桥法标出电子转移的方向和数目(4)向含有
 、
、 的溶液中通入一定量的氯气,再向反应后的溶液中滴加少量的KSCN溶液,结果溶液变为红色。已知:①还原性
的溶液中通入一定量的氯气,再向反应后的溶液中滴加少量的KSCN溶液,结果溶液变为红色。已知:①还原性 ;②KSCN溶液可用于检验
;②KSCN溶液可用于检验 的存在,溶液呈红色。则下列叙述中正确的是
的存在,溶液呈红色。则下列叙述中正确的是①氧化性:
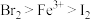
②原溶液中
 一定被氧化
一定被氧化③通入氯气后,原溶液中的
 一定被氧化
一定被氧化④不能确定通入氯气后的溶液中是否还存在

(5)下列转化中,需要加入还原剂才能实现的是_______。
A. | B. |
C. | D. |
(6)2020年8月初,某海外港口因硝酸铵分解引发剧烈爆炸,已知:
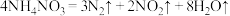 ,则该反应中被还原和被氧化的N原子数之比为
,则该反应中被还原和被氧化的N原子数之比为(7)用如图装置可验证
 是否具有漂白性。为达到实验目的,c、d、e三处依次放入的物质为
是否具有漂白性。为达到实验目的,c、d、e三处依次放入的物质为
①干燥的有色布条 ②湿润的有色布条 ③浓硫酸 ④碱石灰 ⑤无水

您最近一年使用:0次
8 . 实验室制取氯气的反应原理为: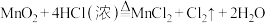 ,据此回答下列问题:
,据此回答下列问题:
(1)氧化剂与还原剂的个数之比_______ 。
(2)实验室制取氯气时,下列装置能达到相应实验目的的是_______ 。
(3)有一种“地康法”制取氯气的反应原理如下图所示:
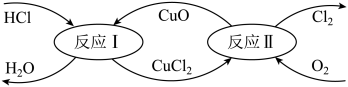
①写出反应Ⅰ的化学方程式_______ 。
②反应Ⅱ属于_______ 反应(填基本反应类型)。
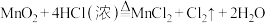 ,据此回答下列问题:
,据此回答下列问题:(1)氧化剂与还原剂的个数之比
(2)实验室制取氯气时,下列装置能达到相应实验目的的是
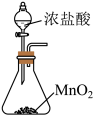 |  |  | 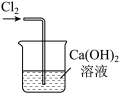 |
A.制备 | B.除去 中的HCl 中的HCl | C.收集 | D.尾气处理 |
(3)有一种“地康法”制取氯气的反应原理如下图所示:

①写出反应Ⅰ的化学方程式
②反应Ⅱ属于
您最近一年使用:0次
名校
9 . 化学实验 化学是一门以实验为基础的学科。请回答以下问题:
(1)对下列事实的解释正确的是
(2)将盛有 12 mLNO2和O2混合气体的量筒倒立于水槽中,充分反应后,还剩余2mL无色气体,则原混合气体中O2的体积是
(3)CuBr 是一种白色晶体,见光或潮湿时受热易分解。实验室制备CuBr的反应原理为SO2+2CuSO4+2NaBr+2H2O=2CuBr+2H2SO4+Na2SO4,用下列装置进行实验,不能达到实验目的的是

(4)实验室中要制取少量蒸馏水,其装置如下图所示:
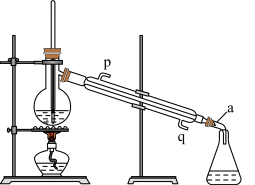
①仪器 a 的名称为_______ ,冷凝水应从_______ (选填“p”或“q”)口进入冷凝管。
②请指出图中装置的一处明显错误:_______ 。
③现需480 mL 0.1 mol/L 的CuSO4溶液,所需的玻璃仪器有烧杯、胶头滴管、_____ 、_____ ; 在配制过程中,需要用电子天平称取胆矾的质量为_______ g。
(5)某校为了改进碳与浓硝酸反应的实验,设计了如图所示的装置。实验步骤:先预热盛有无水氯化钙的烧瓶,然后投入几小块红热的炭块,再缓缓向炭块上滴加浓硝酸,反应即可连续发生。请完成下列空白。
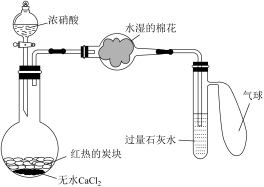
①烧瓶中反应的化学方程式为_______ ,烧瓶中的现象是_______ 。
②水湿棉花的作用是_______ ,气球的作用是_______ 。
(1)对下列事实的解释正确的是
| A.蘸有浓硫酸和蘸有浓氨水的玻璃棒靠近没有白烟,说明硫酸与氨气不反应 |
| B.医疗上可用硫酸钡作 X 射线透视肠胃的内服药,是因为硫酸钡不溶于酸 |
| C.向 50 mL 18 mol·L-1的H2SO4溶液中加入足量的铜片加热充分反应后,被还原的H2SO4的物质的量为0.45 mol |
| D.常温下,浓H2SO4可以用铝制容器贮存,说明铝与浓硫酸不反应 |
| A.1.2mL | B.2.4 mL | C.3.6mL | D.4mL |

| A.用装置甲制取 SO2 | B.用装置乙制取 CuBr |
| C.用装置丙避光将 CuBr 与母液分离 | D.用装置丁干燥 CuBr |

①仪器 a 的名称为
②请指出图中装置的一处明显错误:
③现需480 mL 0.1 mol/L 的CuSO4溶液,所需的玻璃仪器有烧杯、胶头滴管、
(5)某校为了改进碳与浓硝酸反应的实验,设计了如图所示的装置。实验步骤:先预热盛有无水氯化钙的烧瓶,然后投入几小块红热的炭块,再缓缓向炭块上滴加浓硝酸,反应即可连续发生。请完成下列空白。

①烧瓶中反应的化学方程式为
②水湿棉花的作用是
您最近一年使用:0次
名校
解题方法
10 . 钠、碳及它们的化合物在生产、生活中有着重要的用途。
(1)某汽车安全气囊的产气药剂主要含有NaN3、Fe2O3、KClO4、NaHCO3等物质。当汽车发生碰撞时,NaN3迅速分解产生N2和Na,同时放出大量的热。N2使气囊迅速膨胀,从而起到保护作用。
① KClO4的名称是___________ ,具有___________ (填“还原性”或“氧化性”)。
② Fe2O3可处理产生的Na,反应为6Na+Fe2O3 =3Na2O+2Fe,反应中Na作___________ (填“还原剂”或“氧化剂”)。
反应过程中氧化产物与还原产物的个数比为:___________ 。
(2)Na2O2可用于呼吸面具或潜水艇中氧气的来源。某实验小组利用下图装置探究Na2O2与CO2的反应。请回答下列问题:

①根据实验目的,虚线框中的装置所用的试剂为___________ 。
②装置C中观察到的现象是___________ ,反应的化学方程式是___________ 。
③装置A的作用是制备CO2,写出A中发生反应的化学方程式是___________ 。
(1)某汽车安全气囊的产气药剂主要含有NaN3、Fe2O3、KClO4、NaHCO3等物质。当汽车发生碰撞时,NaN3迅速分解产生N2和Na,同时放出大量的热。N2使气囊迅速膨胀,从而起到保护作用。
① KClO4的名称是
② Fe2O3可处理产生的Na,反应为6Na+Fe2O3 =3Na2O+2Fe,反应中Na作
反应过程中氧化产物与还原产物的个数比为:
(2)Na2O2可用于呼吸面具或潜水艇中氧气的来源。某实验小组利用下图装置探究Na2O2与CO2的反应。请回答下列问题:

①根据实验目的,虚线框中的装置所用的试剂为
②装置C中观察到的现象是
③装置A的作用是制备CO2,写出A中发生反应的化学方程式是
您最近一年使用:0次
2021-03-21更新
|
588次组卷
|
4卷引用:重庆市南坪中学2020-2021学年高一上学期期中考试化学试题
重庆市南坪中学2020-2021学年高一上学期期中考试化学试题黑龙江省龙西北地区八校2020-2021学年高一下学期3月联考化学试题(已下线)专题卷三 钠及其化合物(B卷)-2021-2022学年高一化学优选好题单元专题双测卷(人教版2019必修第一册)广东省顺德市李兆基中学2021-2022学年高一上学期期中考试化学试题