名校
解题方法
1 . 实验小组探究铝片做电极材料时的原电池反应,设计下表中装置进行实验并记录。
【实验1】
(1)实验1中,电解质溶液为盐酸,镁条做原电池的___________ 极。
【实验2】将实验1中的电解质溶液换为NaOH溶液进行实验2。
(2)该小组同学认为,此时原电池的总反应为 ,据此推测应该出现的实验现象为
,据此推测应该出现的实验现象为___________ 。
实验2实际获得的现象如下:
(3)ⅰ中铝条表面放电的物质是溶解在溶液中的O2,则该电极反应式为___________ 。
(4)ⅱ中“电流计指针逐渐向零刻度恢复”的原因是___________ 。
【实验3和实验4】
为了排除Mg条的干扰,同学们重新设计装置并进行实验3和实验4,获得的实验现象如下:
(5)根据实验3和实验4可获得的正确推论是___________(填字母序号)。
(6)由实验1~实验4可推知,铝片做电极材料时的原电池反应与___________ 等因素有关。
【实验1】
| 装置 | 实验现象 |
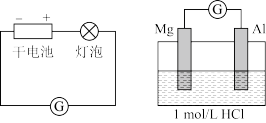 | 左侧装置电流计指针向右偏转,灯泡亮 右侧装置电流计指针向右偏转,镁条、铝条表面产生无色气泡 |
【实验2】将实验1中的电解质溶液换为NaOH溶液进行实验2。
(2)该小组同学认为,此时原电池的总反应为
 ,据此推测应该出现的实验现象为
,据此推测应该出现的实验现象为实验2实际获得的现象如下:
| 装置 | 实验现象 |
 | ⅰ.电流计指针迅速向右偏转,镁条表面无气泡,铝条表面有气泡 ⅱ.电流计指针逐渐向零刻度恢复,经零刻度后继续向左偏转。镁条表面开始时无明显现象,一段时间后有少量气泡逸出,铝条表面持续有气泡逸出 |
(4)ⅱ中“电流计指针逐渐向零刻度恢复”的原因是
【实验3和实验4】
为了排除Mg条的干扰,同学们重新设计装置并进行实验3和实验4,获得的实验现象如下:
| 编号 | 装置 | 实验现象 |
| 实验3 | 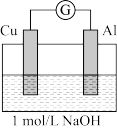 | 电流计指针向左偏转。铝条表面有气泡逸出,铜片没有明显现象;约10分钟后,铜片表面有少量气泡产生,铝条表面气泡略有减少。 |
| 实验4 | 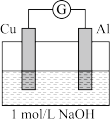 煮沸冷却后的溶液 | 电流计指针向左偏转。铝条表面有气泡逸出,铜片没有明显现象:约3分钟后,铜片表面有少量气泡产生,铝条表面气泡略有减少。 |
| A.上述两装置中,开始时铜片表面得电子的物质是O2 |
| B.铜片表面开始产生气泡的时间长短与溶液中溶解氧的多少有关 |
| C.铜片表面产生的气泡为H2 |
| D.由“铝条表面气泡略有减少”能推测H+在铜片表面得电子 |
您最近一年使用:0次
2023-10-24更新
|
221次组卷
|
3卷引用:北京市清华大学附属中学2023-2024学年高二上学期(G22级)统练二化学试题
解题方法
2 . 将1 g琼脂加入250 mL烧杯中,再向其中加入50 mL饱和食盐水和150 mL水。搅拌、加热、煮沸,使琼脂溶解。稍冷后,趁热把琼脂溶液分别倒入两个培养皿中,各滴入5~6滴酚酞溶液和铁氰化钾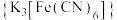 溶液,混合均匀。取两个2~3cm长的铁钉,用砂纸擦光,除去表面氧化物。将裹有锌皮的铁钉放入上述培养皿中,如图1;将缠有铜丝的铁钉放入上述另一个培养皿中,如图2。
溶液,混合均匀。取两个2~3cm长的铁钉,用砂纸擦光,除去表面氧化物。将裹有锌皮的铁钉放入上述培养皿中,如图1;将缠有铜丝的铁钉放入上述另一个培养皿中,如图2。
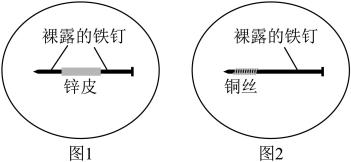
(1)图1中裸露的铁钉作___________ 极,该电极的电极反应式为___________ ,其附近可观察到的颜色变化为___________ 。
(2)图2中,在裸露的铁钉附近看到的颜色变化为___________ ,分析出现该颜色的原因:___________ ,靠近铜丝一端可观察到的颜色变化为___________ 。
(3)另一个同学也进行了上述实验操作,在图1装置中没有看到上述实验现象,其原因可能是___________ (填一条)。
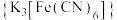 溶液,混合均匀。取两个2~3cm长的铁钉,用砂纸擦光,除去表面氧化物。将裹有锌皮的铁钉放入上述培养皿中,如图1;将缠有铜丝的铁钉放入上述另一个培养皿中,如图2。
溶液,混合均匀。取两个2~3cm长的铁钉,用砂纸擦光,除去表面氧化物。将裹有锌皮的铁钉放入上述培养皿中,如图1;将缠有铜丝的铁钉放入上述另一个培养皿中,如图2。
(1)图1中裸露的铁钉作
(2)图2中,在裸露的铁钉附近看到的颜色变化为
(3)另一个同学也进行了上述实验操作,在图1装置中没有看到上述实验现象,其原因可能是
您最近一年使用:0次
名校
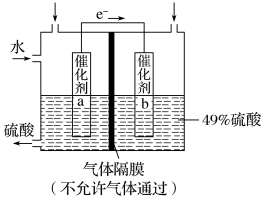
3 . I.如图是利用电化学装置将SO2转化为重要的化工原料H2SO4的原理示意图。
请回答下列问题:
(1)该装置将_______ 能转化为______ 能。
(2)催化剂b表面O2发生_______ 反应,其附近溶液酸性______ (填“增强”、“不变”或“减弱”)。
(3)催化剂a表面的电极反应式:_______ 。
II.某废料铁泥主要成分是Fe2O3、FeO和Fe,其他杂质不与硫酸反应。实验室用该废料提取Fe2O3,设计实验流程如图:

(4)步骤(I)充分反应后进行的实验操作名称是______ 。
(5)步骤(II)中加入H2O2溶液后需要适当加热但温度不能过高,原因是______ 。
(6)为了检验溶液B中是否有亚铁离子剩余,有同学提出只需要取少量溶液B于试管中并向其中滴加氢氧化钠溶液,然后观察现象即可证明。请你判断该同学的方法是否可行并说出理由______ 。
(7)步骤(III)中将NaOH溶液换成氨气也可以得到Fe(OH)3沉淀,反应的离子方程式为______ 。

请回答下列问题:
(1)该装置将
(2)催化剂b表面O2发生
(3)催化剂a表面的电极反应式:
II.某废料铁泥主要成分是Fe2O3、FeO和Fe,其他杂质不与硫酸反应。实验室用该废料提取Fe2O3,设计实验流程如图:

(4)步骤(I)充分反应后进行的实验操作名称是
(5)步骤(II)中加入H2O2溶液后需要适当加热但温度不能过高,原因是
(6)为了检验溶液B中是否有亚铁离子剩余,有同学提出只需要取少量溶液B于试管中并向其中滴加氢氧化钠溶液,然后观察现象即可证明。请你判断该同学的方法是否可行并说出理由
(7)步骤(III)中将NaOH溶液换成氨气也可以得到Fe(OH)3沉淀,反应的离子方程式为
您最近一年使用:0次
2023-05-19更新
|
714次组卷
|
2卷引用:贵州省遵义市仁怀市高中教育联盟2022-2023学年高一下学期5月期中考试化学试题
4 . 能源是现代文明的原动力,电池与我们的生活和生产密切相关。
(1)事实证明,能设计成原电池的反应通常是放热反应,下列化学反应在理论上可以设计成原电池的_____(填字母)。
(2)下图为原电池装置示意图:
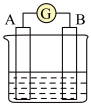
①若A为 片,B为石墨棒,电解质溶液为稀硫酸,写出负极的电极反应式:
片,B为石墨棒,电解质溶液为稀硫酸,写出负极的电极反应式:_____ ,反应过程中溶液的酸性_____ (填“增强”、“减弱”或“不变”)。一段时间后,当电池中放出2.24L(标准状况)气体时,电路中有_____ 个电子通过了导线(用 表示阿伏加德罗常数的值)。
表示阿伏加德罗常数的值)。
②若A为镁片,B为铝片,电解质为 溶液,则铝片为
溶液,则铝片为_____ (填“正极”或“负极”);写出该电极的电极反应式:_____ 。
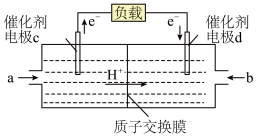
(3)燃料电池是一种具有应用前景的绿色电源, 和
和 组合形成的燃料电池的结构如图(电解质溶液是稀硫酸,质子交换膜只允许
组合形成的燃料电池的结构如图(电解质溶液是稀硫酸,质子交换膜只允许 通过)。则电极d是
通过)。则电极d是_____ (填“正极”或“负极”),则该燃料电池如下:
(4)为证明铁的金属活动性比铜强,某同学设计了如下一些方案。其中能证明铁的金属活动性比铜强的方案是
(1)事实证明,能设计成原电池的反应通常是放热反应,下列化学反应在理论上可以设计成原电池的_____(填字母)。
A. |
B.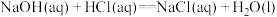 |
C.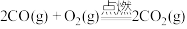 |
D.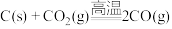 |

①若A为
 片,B为石墨棒,电解质溶液为稀硫酸,写出负极的电极反应式:
片,B为石墨棒,电解质溶液为稀硫酸,写出负极的电极反应式: 表示阿伏加德罗常数的值)。
表示阿伏加德罗常数的值)。②若A为镁片,B为铝片,电解质为
 溶液,则铝片为
溶液,则铝片为(3)燃料电池是一种具有应用前景的绿色电源,
 和
和 组合形成的燃料电池的结构如图(电解质溶液是稀硫酸,质子交换膜只允许
组合形成的燃料电池的结构如图(电解质溶液是稀硫酸,质子交换膜只允许 通过)。则电极d是
通过)。则电极d是
(4)为证明铁的金属活动性比铜强,某同学设计了如下一些方案。其中能证明铁的金属活动性比铜强的方案是
| 方案 | 现象或产物 |
A.将铁片置于 溶液中 溶液中 | 铁片上有亮红色物质析出 |
| B.将铁丝和铜丝分别在氯气燃烧 | 产物分别为 和 和 |
| C.将铁片和铜片分别置于稀硫酸溶液中 | 铁片上有气泡产生,铜片上无气泡产生 |
| D.将铁片和铜片置于盛有稀硫酸的烧杯中,并用导线连 | 铁片溶解,铜片上有气泡产生 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
5 . 完成下列问题。
(1)下列反应中,属于放热反应的是___________ (填字母,下同),属于吸热反应的是___________ 。
a.盐酸与烧碱溶液反应 b.Ba(OH)2·8H2O+2NH4Cl=BaCl2+10H2O+2NH3↑
c.氢气在氧气中燃烧生成水 d.高温煅烧石灰石使其分解
e.铝和盐酸反应 f.葡萄糖在人体内氧化分解
(2)为了研究化学反应A+B=C+D的能量变化情况,某同学设计了如图所示装置。当向盛有A的试管中滴加试剂B时,看到U形管中甲处液面下降乙处液面上升。
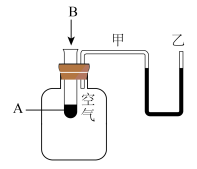
试回答下列问题:
①该反应为___________ 反应(填“放热”或“吸热”)。
②该反应的反应物化学键断裂吸收的能量________ (填“高”或“低”)于生成物化学键形成放出的能量。
(3) A、B、C、D四种金属按下表中装置进行实验。
根据实验现象回答下列问题:
①装置甲溶液中的阴离子移向________ (填“A”或“B”)极。
②装置乙中正极的电极反应式为________ 。
③四种金属活动性由强到弱的顺序是________ 。
(4)甲烷可直接应用于燃料电池,该电池采用KOH溶液为电解质,其工作原理如下图所示:
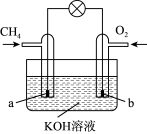
①外电路电子移动方向:___________ (填“a极到b极”或“b极到a极”)。
②a电极的电极方程式为___________ 。
(1)下列反应中,属于放热反应的是
a.盐酸与烧碱溶液反应 b.Ba(OH)2·8H2O+2NH4Cl=BaCl2+10H2O+2NH3↑
c.氢气在氧气中燃烧生成水 d.高温煅烧石灰石使其分解
e.铝和盐酸反应 f.葡萄糖在人体内氧化分解
(2)为了研究化学反应A+B=C+D的能量变化情况,某同学设计了如图所示装置。当向盛有A的试管中滴加试剂B时,看到U形管中甲处液面下降乙处液面上升。

试回答下列问题:
①该反应为
②该反应的反应物化学键断裂吸收的能量
(3) A、B、C、D四种金属按下表中装置进行实验。
| 装置 | 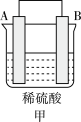 |  |  |
| 现象 | 金属A不断溶解 | C的质量增加 | A上有气体产生 |
①装置甲溶液中的阴离子移向
②装置乙中正极的电极反应式为
③四种金属活动性由强到弱的顺序是
(4)甲烷可直接应用于燃料电池,该电池采用KOH溶液为电解质,其工作原理如下图所示:

①外电路电子移动方向:
②a电极的电极方程式为
您最近一年使用:0次
名校
解题方法
6 . 化学能在一定条件下可转化为电能。
(1)如图所示为“锌-铜-稀硫酸”原电池,请写出锌与稀硫酸反应的离子方程式是___________ 。
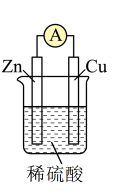
(2)装置中锌片上发生___________ (“氧化”或“还原”)反应,电极反应式是___________ ,铜片上发生反应的电极反应式是________ ,能证明化学能转化为电能的实验现象为_________ 。
(3)按照电化学装置的四个构成要素来看,Cu的作用是________ ,稀硫酸的作用是___________ 。
a.电极反应物 b.电极材料 c.离子导体 d.电子导体
(1)如图所示为“锌-铜-稀硫酸”原电池,请写出锌与稀硫酸反应的离子方程式是

(2)装置中锌片上发生
(3)按照电化学装置的四个构成要素来看,Cu的作用是
a.电极反应物 b.电极材料 c.离子导体 d.电子导体
您最近一年使用:0次
名校
解题方法
7 . 某化学兴趣小组欲探究a,b,c,d四种金属的活动性大小顺序,利用实验室现有材料和试剂进行实验,组装了如图所示的装置(电流表指针偏向正极,电解质溶液足量)。请回答下列问题:
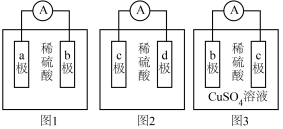
(1)观察到图1装置中的电流表指针偏向b极,说明a极为______ (填“正极”或“负极”),b极上发生的电极反应为______ 。
(2)观察到图2装置中的c极上有气泡生成,可观察到d极上的现象为______ 。
(3)图3装置中的电流表指针偏向c极,若b极为Fe电极,则b极上发生的电极反应为______ ,当该电路中转移0.4mole-时,______ (填“b”或“c”)极质量增重______ g。
(4)通过以上实验装置______ (填“能”或“不能”)比较出四种金属的活动性大小顺序,理由是______ 。

(1)观察到图1装置中的电流表指针偏向b极,说明a极为
(2)观察到图2装置中的c极上有气泡生成,可观察到d极上的现象为
(3)图3装置中的电流表指针偏向c极,若b极为Fe电极,则b极上发生的电极反应为
(4)通过以上实验装置
您最近一年使用:0次
名校
解题方法
8 . 化学反应与能量变化对人类生产、生活有重要的意义。回答下列问题:
(1)用A、B、C、D四种金属按如表所示的装置进行实验。
①装置甲中负极为___________ (填“A”或“B”)。
②装置乙中正极的电极反应式为___________ 。
③装置丙中溶液的pH___________ (填“变大”“变小”或“不变”)。
④四种金属的活动性由强到弱的顺序是___________ 。
(2)北京冬奥会基本实现100%绿电供应和碳中和,利用CO2和H2在光催化酶作用下可以高效合成甲醇(CH3OH)。
①写出甲醇燃烧的化学方程式:___________ 。
②氢气燃料电池和甲醇燃料电池在北京冬奥会上得到广泛应用。如图是碱性氢燃料电池的模拟示意图:
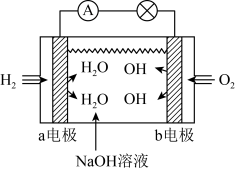
a电极是___________ 极,此时b电极发生反应的电极反应式是___________ , 向
向___________ (填“a”或“b”)电极移动。
(1)用A、B、C、D四种金属按如表所示的装置进行实验。
| 装置 | 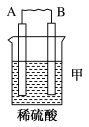 | 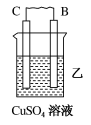 | 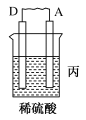 |
| 现象 | 二价金属A不断溶解 | C的质量增加 | A上有气体产生 |
②装置乙中正极的电极反应式为
③装置丙中溶液的pH
④四种金属的活动性由强到弱的顺序是
(2)北京冬奥会基本实现100%绿电供应和碳中和,利用CO2和H2在光催化酶作用下可以高效合成甲醇(CH3OH)。
①写出甲醇燃烧的化学方程式:
②氢气燃料电池和甲醇燃料电池在北京冬奥会上得到广泛应用。如图是碱性氢燃料电池的模拟示意图:

a电极是
 向
向
您最近一年使用:0次
2023高二上·全国·专题练习
9 . 锌铜原电池的工作原理
(1)ZnZnSO4半电池:在ZnSO4溶液中,锌片逐渐溶解,即Zn被_______ ,锌原子失去电子,形成Zn2+进入溶液,即Zn-2e-=Zn2+;从锌片上释放出的_______ ,经过导线流向铜片。
(2)CuCuSO4半电池:CuSO4溶液中的Cu2+从铜片上得到_______ ,_______ 为铜单质并沉积在铜片上,即Cu2++2e-=Cu。
(3)盐桥的作用:电池工作时,盐桥中的_______ 会移向ZnSO4溶液,_______ 移向CuSO4溶液,使两溶液均保持电中性。当取出盐桥后,形成断路,反应停止。
| 装置示意图 | 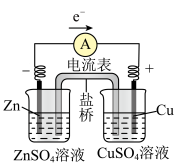 注:盐桥中装有含KCl饱和溶液的琼胶 |
| 现象 | 锌片 |
| 能量转换 | |
| 微观探析 | 在硫酸锌溶液中,负极一端的 在硫酸铜溶液中,正极一端的 |
| 电子或离子移动方向 | 电子: 盐桥: |
| 工作原理,电极反应式 | 负极:Zn-2e-=Zn2+( 正极:Cu2++2e-=Cu( |
| 总反应:Zn+Cu2+=Zn2++Cu |
(2)CuCuSO4半电池:CuSO4溶液中的Cu2+从铜片上得到
(3)盐桥的作用:电池工作时,盐桥中的
您最近一年使用:0次
解题方法
10 . 利用所学电化学反应原理,解决以下问题:
Ⅰ.如图所示,A为电源,B为浸透饱和食盐水和酚酞溶液的滤纸,滤纸中央滴有一滴KMnO4溶液,C、D为电解槽,其电极材料及电解质溶液如图所示。
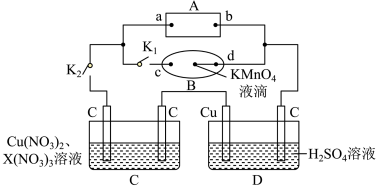
(1)闭合K1,断开K2,通电后,d端显红色,则电源b端为___________ 极,若c、d为惰性电极,检验c端产物的方法为___________ 。滤纸中央KMnO4溶液处发生的现象为___________ 。
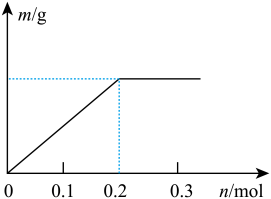
(2)已知C装置中溶液的溶质为Cu(NO3)2和X(NO3)3,且均为0.1mol,打开K1,关闭K2, 通电一段时间后,阴极析出固体质量m(g)与通过电子的物质的量n(mol)关系如图所示,则Cu2+、X3+、H+氧化能力由大到小的顺序是___________ 。
(3)D装置中溶液是H2SO4溶液,则电极C端从开始至一段时间后的实验现象是___________ 。
Ⅱ.电化学技术是有效解决 CO、SO2、NOx 等大气污染的重要方法,某兴趣小组以SO2为原料,采用电化学方法制取硫酸,装置如下 :
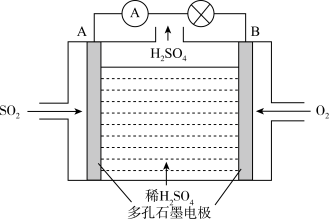
(4)电解质溶液中 离子向
离子向___________ (填“A极”或“B极” )移动。
(5)请写出负极电极反应式___________ 。
(6)用该原电池做电源,石墨做电极电解2L AgNO3和KNO3混合溶液,通电一段时间,两极均产生2.24 L(标准状况)气体,假设电解前后溶液体积不变,则电解后溶液中H+的浓度为___________ 。
Ⅰ.如图所示,A为电源,B为浸透饱和食盐水和酚酞溶液的滤纸,滤纸中央滴有一滴KMnO4溶液,C、D为电解槽,其电极材料及电解质溶液如图所示。

(1)闭合K1,断开K2,通电后,d端显红色,则电源b端为
(2)已知C装置中溶液的溶质为Cu(NO3)2和X(NO3)3,且均为0.1mol,打开K1,关闭K2, 通电一段时间后,阴极析出固体质量m(g)与通过电子的物质的量n(mol)关系如图所示,则Cu2+、X3+、H+氧化能力由大到小的顺序是

(3)D装置中溶液是H2SO4溶液,则电极C端从开始至一段时间后的实验现象是
Ⅱ.电化学技术是有效解决 CO、SO2、NOx 等大气污染的重要方法,某兴趣小组以SO2为原料,采用电化学方法制取硫酸,装置如下 :

(4)电解质溶液中
 离子向
离子向(5)请写出负极电极反应式
(6)用该原电池做电源,石墨做电极电解2L AgNO3和KNO3混合溶液,通电一段时间,两极均产生2.24 L(标准状况)气体,假设电解前后溶液体积不变,则电解后溶液中H+的浓度为
您最近一年使用:0次
2023-07-25更新
|
89次组卷
|
2卷引用:甘肃省平凉市2022-2023学年高三上学期11月期中化学试题



