2023高三·全国·专题练习
解题方法
1 . 填空。
(1)将燃煤产生的二氧化碳回收利用,可达到低碳排放的目的。下图是通过人工光合作用,以CO2和H2O为原料制备HCOOH和O2的原理示意图。
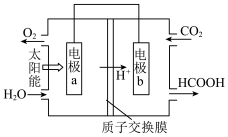
①电极b为_______ 极。
②电极b上的电极反应为_______ 。
(2)浓差电池中的电动势是由于电池中存在浓度差而产生的。某浓差电池的原理如图所示,该电池从浓缩海水中提取LiCl的同时又获得了电能。
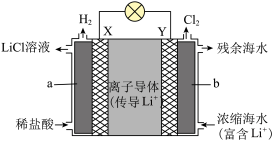
①X为_______ 极,Y极的电极反应式为_______ 。
②Y极生成1 mol Cl2时,_______ mol Li+移向_______ (填“X”或“Y”)极。
(3)微生物燃料电池是一种利用微生物将化学能直接转化成电能的装置。已知某种甲醇微生物燃料电池中,电解质溶液为酸性,示意图如下:
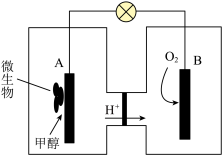
①该电池中外电路电子的流动方向为_______ (填“从A到B”或“从B到A”)。
②A电极附近甲醇发生的电极反应为_______ 。
(1)将燃煤产生的二氧化碳回收利用,可达到低碳排放的目的。下图是通过人工光合作用,以CO2和H2O为原料制备HCOOH和O2的原理示意图。

①电极b为
②电极b上的电极反应为
(2)浓差电池中的电动势是由于电池中存在浓度差而产生的。某浓差电池的原理如图所示,该电池从浓缩海水中提取LiCl的同时又获得了电能。

①X为
②Y极生成1 mol Cl2时,
(3)微生物燃料电池是一种利用微生物将化学能直接转化成电能的装置。已知某种甲醇微生物燃料电池中,电解质溶液为酸性,示意图如下:

①该电池中外电路电子的流动方向为
②A电极附近甲醇发生的电极反应为
您最近一年使用:0次
名校
解题方法
2 . Ⅰ.回答下列问题
(1)利用反应Cu+2FeCl3=CuCl2+2FeCl2,设计成如图所示的原电池,回答下列问题:
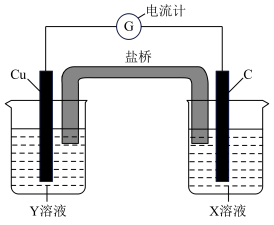
①写出电极反应式。正极:_______ ;负极:_______ 。
②图中X溶液的溶质是_______ (填化学式,下同),Y溶液的溶质是_______ 。
③原电池工作时,盐桥中的_______ (填“阳”或“阴”)离子向X溶液方向移动。
(2)控制合适的条件将反应2Fe3++2I-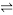 2Fe2++I2设计成如图所示的原电池。请回答下列问题:
2Fe2++I2设计成如图所示的原电池。请回答下列问题:

①反应开始时,乙中石墨电极上发生_______ (填“氧化”或“还原”,下同)反应,电极反应式为_______ 。甲中石墨电极上发生_______ 反应,电极反应式为_______ 。
②电流计读数为0时,反应达到平衡状态,此时在甲中加入FeCl2固体,则乙中的石墨作_______ (填“正”或“负”)极,该电极的电极反应式为_______ 。
(3)利用反应2Cu+O2+2H2SO4=2CuSO4+2H2O可制备CuSO4,若将该反应设计为原电池,其正极电极反应式为_______ 。
Ⅱ.已知:①将 0.1 mol·Lˉ1KI 溶液加入到 0.1 mol·L-1 FeCl3溶液中时,可以看到溶液颜色加深,滴加淀粉后溶液变为蓝色;
②当离子浓度相同时,氧化性:Ag+>Fe3+;
③ 若浓度减小时,离子的氧化性也会随之减弱。
(4)甲同学猜测,0.1 mol·Lˉ1 KI 溶液(加入几滴淀粉溶液)加入0.1mol·Lˉ1AgNO3 溶液中时,溶液应变蓝色。请写出该猜测对应的离子方程式_______ 。实验结果未见到蓝色。
(5)乙同学认为甲同学的实验方案有问题,理由是_______ 。请设计原电池证明Ag+也能氧化 Iˉ,画出装置图,并标明电极材料及电解质溶液。______
(1)利用反应Cu+2FeCl3=CuCl2+2FeCl2,设计成如图所示的原电池,回答下列问题:

①写出电极反应式。正极:
②图中X溶液的溶质是
③原电池工作时,盐桥中的
(2)控制合适的条件将反应2Fe3++2I-
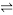 2Fe2++I2设计成如图所示的原电池。请回答下列问题:
2Fe2++I2设计成如图所示的原电池。请回答下列问题:
①反应开始时,乙中石墨电极上发生
②电流计读数为0时,反应达到平衡状态,此时在甲中加入FeCl2固体,则乙中的石墨作
(3)利用反应2Cu+O2+2H2SO4=2CuSO4+2H2O可制备CuSO4,若将该反应设计为原电池,其正极电极反应式为
Ⅱ.已知:①将 0.1 mol·Lˉ1KI 溶液加入到 0.1 mol·L-1 FeCl3溶液中时,可以看到溶液颜色加深,滴加淀粉后溶液变为蓝色;
②当离子浓度相同时,氧化性:Ag+>Fe3+;
③ 若浓度减小时,离子的氧化性也会随之减弱。
(4)甲同学猜测,0.1 mol·Lˉ1 KI 溶液(加入几滴淀粉溶液)加入0.1mol·Lˉ1AgNO3 溶液中时,溶液应变蓝色。请写出该猜测对应的离子方程式
(5)乙同学认为甲同学的实验方案有问题,理由是
您最近一年使用:0次
解题方法
3 . 根据信息填空
(1)用如图所示的装置进行铝热法炼铁实验,写出铝热法炼铁反应的化学方程式:_______ 。
(2)已知:Fe+2FeCl3=3FeCl2,利用这一反应,设计一个原电池,画出示意图,标明电极材料名称,电解质溶液______ 。该原电池中,三价铁离子向_______ (填“正极”或“负极”)移动。负极的电极反应式为_______

(3)古代《药性论》中有关铅丹(Pb3O4)的描述是治惊悸狂走,呕逆,消渴,铅丹(Pb3O4)也可作为防锈用涂料,呈红褐色,又名红丹。
①铅丹可用PbO在空气中加热制备,请写出有关反应的化学方程式_______ 。
②铅丹曾用于铁制品防锈,请举例说明铁制品防锈的其它方法_______ (只填一种方法)。
(1)用如图所示的装置进行铝热法炼铁实验,写出铝热法炼铁反应的化学方程式:

(2)已知:Fe+2FeCl3=3FeCl2,利用这一反应,设计一个原电池,画出示意图,标明电极材料名称,电解质溶液

(3)古代《药性论》中有关铅丹(Pb3O4)的描述是治惊悸狂走,呕逆,消渴,铅丹(Pb3O4)也可作为防锈用涂料,呈红褐色,又名红丹。
①铅丹可用PbO在空气中加热制备,请写出有关反应的化学方程式
②铅丹曾用于铁制品防锈,请举例说明铁制品防锈的其它方法
您最近一年使用:0次
2014高三·全国·专题练习
名校
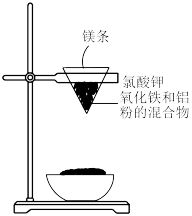
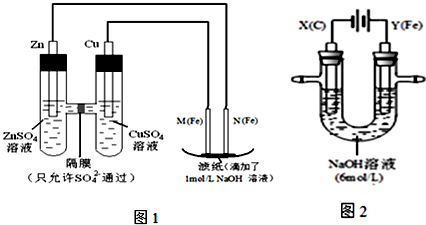
4 . 某课外小组分别用下图所示装置对原电池和电解原理进行实验探究.
请回答:
I.用图1所示装置进行第一组实验.
(1)在保证电极反应不变的情况下,不能替代Cu做电极的是______ (填字母序号).
A.铝 B.石墨 C.银 D.铂
(2)N极发生反应的电极反应式为_____________ .
(3)实验过程中,SO42-______ (填“从左向右”、“从右向左”或“不”)移动;滤纸上能观察到的现象有______________ .
II.用图2所示装置进行第二组实验.实验过程中,两极均有气体产生,Y极区溶液逐渐变成紫红色;停止实验,铁电极明显变细,电解液仍然澄清.查阅资料发现,高铁酸根(FeO42-)在溶液中呈紫红色.
(4)电解过程中,X极区溶液的pH______ (填“增大”、“减小”或“不变”).
(5)电解过程中,Y极发生的电极反应为_____________ 和4OH- - 4e-= 2H2O + O2↑
(6)若在X极收集到672mL气体,在Y极收集到168mL气体(均已折算为标准状况时气体体积),则Y电极(铁电极)质量减少______ g.
(7)在碱性锌电池中,用高铁酸钾作为正极材料,电池反应为:2K2FeO4+3Zn═Fe2O3+ZnO+2K2ZnO2 该电池正极发生的反应的电极反应式为__________ .

请回答:
I.用图1所示装置进行第一组实验.
(1)在保证电极反应不变的情况下,不能替代Cu做电极的是
A.铝 B.石墨 C.银 D.铂
(2)N极发生反应的电极反应式为
(3)实验过程中,SO42-
II.用图2所示装置进行第二组实验.实验过程中,两极均有气体产生,Y极区溶液逐渐变成紫红色;停止实验,铁电极明显变细,电解液仍然澄清.查阅资料发现,高铁酸根(FeO42-)在溶液中呈紫红色.
(4)电解过程中,X极区溶液的pH
(5)电解过程中,Y极发生的电极反应为
(6)若在X极收集到672mL气体,在Y极收集到168mL气体(均已折算为标准状况时气体体积),则Y电极(铁电极)质量减少
(7)在碱性锌电池中,用高铁酸钾作为正极材料,电池反应为:2K2FeO4+3Zn═Fe2O3+ZnO+2K2ZnO2 该电池正极发生的反应的电极反应式为
您最近一年使用:0次
2017-06-17更新
|
606次组卷
|
7卷引用:2014届高考化学二轮专题复习 电化学练习卷
(已下线)2014届高考化学二轮专题复习 电化学练习卷(已下线)2014高考名师推荐化学电解规律及电化学计算北京市2017届高三高考押题卷化学试题河南省南阳市第一中学校2016-2017学年高二下学期第三次月考化学试题河南省南阳市第一中学2016-2017学年高二下学期第三次月考化学试题2020届高考化学二轮复习大题精准训练 ——原电池、电解池填空题辽宁省沈阳市辽中区第一高级中学2020-2021学年高二下学期开学考试化学试题
解题方法
5 . 回答下列问题:
(1)将燃煤产生的二氧化碳回收利用,可达到低碳排放的目的。如图是通过人工光合作用,以CO2和H2O为原料制备HCOOH和O2的原理示意图。电极b作____ 极,表面发生的电极反应为____ 。
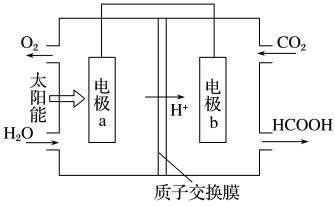
(2)浓差电池中的电动势是由于电池中存在浓度差而产生的。某浓差电池的原理如图所示,该电池从浓缩海水中提取LiCl的同时又获得了电能。
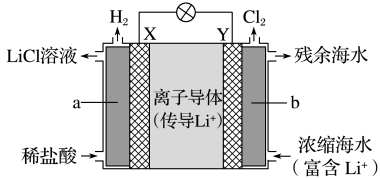
①X为____ 极,Y极反应式为_____ 。
②Y极生成1molCl2时,____ molLi+移向____ (填“X”或“Y”)极。
(3)一种以肼(N2H4)为液体燃料的电池装置如图所示。该电池用空气中的氧气作氧化剂,KOH作电解质。负极反应式为____ ;正极反应式为____ 。
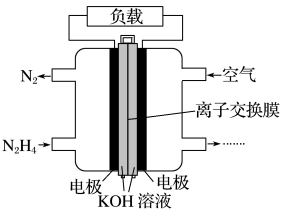
(4)Mg-AgCl电池是一种能被海水激活的一次性贮备电池,电池反应方程式为2AgCl+Mg=Mg2++2Ag+2Cl-。
①负极反应式为_____ ;
②正极反应式为_____ 。
(1)将燃煤产生的二氧化碳回收利用,可达到低碳排放的目的。如图是通过人工光合作用,以CO2和H2O为原料制备HCOOH和O2的原理示意图。电极b作

(2)浓差电池中的电动势是由于电池中存在浓度差而产生的。某浓差电池的原理如图所示,该电池从浓缩海水中提取LiCl的同时又获得了电能。

①X为
②Y极生成1molCl2时,
(3)一种以肼(N2H4)为液体燃料的电池装置如图所示。该电池用空气中的氧气作氧化剂,KOH作电解质。负极反应式为

(4)Mg-AgCl电池是一种能被海水激活的一次性贮备电池,电池反应方程式为2AgCl+Mg=Mg2++2Ag+2Cl-。
①负极反应式为
②正极反应式为
您最近一年使用:0次
2023高三·全国·专题练习
解题方法
6 . 回答下列问题:
(1)如将燃煤产生的二氧化碳回收利用,可达到低碳排放的目的。如图是通过人工光合作用,以CO2和H2O为原料制备HCOOH和O2的原理示意图。
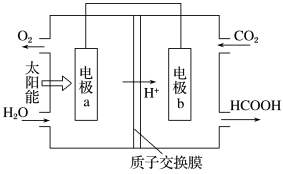
负极:_______ 。
正极:_______ 。
(2)液体燃料电池相比于气体燃料电池具有体积小等优点。一种以液态肼(N2H4)为燃料的电池装置如图所示。
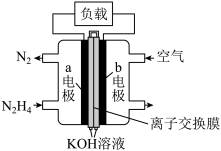
负极:_______ 。
正极:_______ 。
(1)如将燃煤产生的二氧化碳回收利用,可达到低碳排放的目的。如图是通过人工光合作用,以CO2和H2O为原料制备HCOOH和O2的原理示意图。

负极:
正极:
(2)液体燃料电池相比于气体燃料电池具有体积小等优点。一种以液态肼(N2H4)为燃料的电池装置如图所示。

负极:
正极:
您最近一年使用:0次
解题方法
7 . 物质的化学能可以在不同的条件下转化为热能、电能被人类利用。按要求回答下列问题。
(1)微生物电池是指在微生物作用下将化学能转化为电能的装置。其工作原理如下图所示。
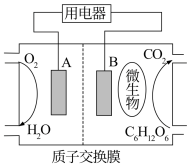
①A为生物燃料电池的_______ (填“正”或“负”)极。
②负极的电极反应式为_______ 。
③放电过程中, 由
由_______ 极区向_______ 极区迁移(填“正”或“负”)。
(2)用阴离子交换膜控制电解液中 的浓度制备纳米
的浓度制备纳米 。反应为
。反应为 ,装置如图。
,装置如图。
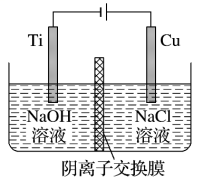
①电解时_______ 通过阴离子交换膜向_______ 极移动。
②阳极电极反应式为_______ 。
③阴极电极反应式为_______ 。
(3)我国科研人员研制出的可充电“ ”电池,以钠箔和多壁碳纳米管(
”电池,以钠箔和多壁碳纳米管(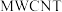 )为电极材料,可选用高氯酸钠-四甘醇二甲醚作电解液。总反应方程式为
)为电极材料,可选用高氯酸钠-四甘醇二甲醚作电解液。总反应方程式为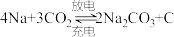 。放电时该电池“吸入”
。放电时该电池“吸入” 。
。
①放电时,正极的电极反应式为_______ 。
②可选用高氯酸钠-四甘醇二甲醚作电解液的理由是_______ 。
(1)微生物电池是指在微生物作用下将化学能转化为电能的装置。其工作原理如下图所示。

①A为生物燃料电池的
②负极的电极反应式为
③放电过程中,
 由
由(2)用阴离子交换膜控制电解液中
 的浓度制备纳米
的浓度制备纳米 。反应为
。反应为 ,装置如图。
,装置如图。
①电解时
②阳极电极反应式为
③阴极电极反应式为
(3)我国科研人员研制出的可充电“
 ”电池,以钠箔和多壁碳纳米管(
”电池,以钠箔和多壁碳纳米管( )为电极材料,可选用高氯酸钠-四甘醇二甲醚作电解液。总反应方程式为
)为电极材料,可选用高氯酸钠-四甘醇二甲醚作电解液。总反应方程式为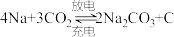 。放电时该电池“吸入”
。放电时该电池“吸入” 。
。①放电时,正极的电极反应式为
②可选用高氯酸钠-四甘醇二甲醚作电解液的理由是
您最近一年使用:0次
8 . 回答下列问题
(1)从能量的变化和反应的快慢等角度研究反应:2H2 + O2 = 2H2O。已知该反应为放热反应,如图能正确表示该反应中能量变化的是_______ 。(填“A”或“B”)

从断键和成键的角度分析上述反应中能量的变化。化学键的键能如表:
则生成1mol水可以放出热量 _______ kJ
(2)以下反应:①木炭与水制备水煤气②氯酸钾分解③炸药爆炸④酸与碱的中和反应⑤生石灰与水作用制熟石灰⑥ Ba(OH)2·8H2O与NH4Cl ⑦气态水液化,属于放热反应的有:_______ (填序号)。
(3)分别按图甲、乙所示装置进行实验,图中两个烧杯里的溶液为同浓度的稀硫酸,乙中A为电流表。请回答下列问题:

①以下叙述中,正确的是_______ (填字母)。
A.甲中锌片是负极,乙中铜片是正极 B.两烧杯中铜片表面均有气泡产生
C.两烧杯中溶液pH均增大 D.产生气泡的速度甲中比乙中慢
E.乙的外电路中电流方向Zn→Cu F.乙溶液中 向铜片方向移动
向铜片方向移动
②乙中能量转化的主要形式为_______ 。
③在乙实验中,如果把稀硫酸换成硫酸铜溶液,铜电极的电极反应式是_______ ,当电路中转移0.25 mol电子时,消耗负极材料的质量为_______ g。
(1)从能量的变化和反应的快慢等角度研究反应:2H2 + O2 = 2H2O。已知该反应为放热反应,如图能正确表示该反应中能量变化的是

从断键和成键的角度分析上述反应中能量的变化。化学键的键能如表:
| 化学键 | H-H | O=O | H-O |
| 键能kJ/mol | 436 | 496 | 463 |
(2)以下反应:①木炭与水制备水煤气②氯酸钾分解③炸药爆炸④酸与碱的中和反应⑤生石灰与水作用制熟石灰⑥ Ba(OH)2·8H2O与NH4Cl ⑦气态水液化,属于放热反应的有:
(3)分别按图甲、乙所示装置进行实验,图中两个烧杯里的溶液为同浓度的稀硫酸,乙中A为电流表。请回答下列问题:

①以下叙述中,正确的是
A.甲中锌片是负极,乙中铜片是正极 B.两烧杯中铜片表面均有气泡产生
C.两烧杯中溶液pH均增大 D.产生气泡的速度甲中比乙中慢
E.乙的外电路中电流方向Zn→Cu F.乙溶液中
 向铜片方向移动
向铜片方向移动②乙中能量转化的主要形式为
③在乙实验中,如果把稀硫酸换成硫酸铜溶液,铜电极的电极反应式是
您最近一年使用:0次
9 . 合成氨对人类生存具有重大意义:
(1)传统工业合成法:反应为N2(g)+3H2(g) 2NH3(g) ∆H。科学家研究在催化剂表面合成氨的反应机理,反应步骤与能量的关系如图所示(吸附在催化剂表面的微粒用*标注,省略了反应过程中部分微粒)。
2NH3(g) ∆H。科学家研究在催化剂表面合成氨的反应机理,反应步骤与能量的关系如图所示(吸附在催化剂表面的微粒用*标注,省略了反应过程中部分微粒)。
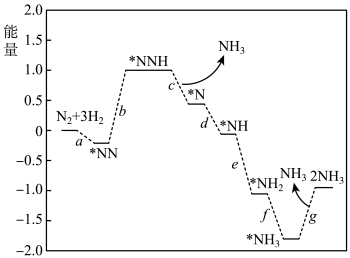
①N2的电子式是___ 。
②写出步骤b的化学方程式___ 。
③由图象可知合成氨反应的∆H__ 0(填“>”、“<”或“=”)。
④工业生产中,除了温度采用400℃—500℃外,促进该反应正向进行的措施是(至少两点)___ 。
(2)电化学制备方法:目前科学家利用生物燃料电池原理(电池工作时MV2+/MV+在电极与酶之间传递电子),研究室温下合成氨并取得初步成果,示意图如图:

①氢化酶区域发生反应的离子方程式是___ 。
②溶液中H+的移动方向是___ (填“向左”或“向右”)。
③下列说法正确的是___ 。
A.该装置可以实现电能转化为化学能
B.电极a是燃料电池的负极
C.该方法相较于传统工业合成方法具有条件温和,对环境友好等优点
(1)传统工业合成法:反应为N2(g)+3H2(g)
 2NH3(g) ∆H。科学家研究在催化剂表面合成氨的反应机理,反应步骤与能量的关系如图所示(吸附在催化剂表面的微粒用*标注,省略了反应过程中部分微粒)。
2NH3(g) ∆H。科学家研究在催化剂表面合成氨的反应机理,反应步骤与能量的关系如图所示(吸附在催化剂表面的微粒用*标注,省略了反应过程中部分微粒)。
①N2的电子式是
②写出步骤b的化学方程式
③由图象可知合成氨反应的∆H
④工业生产中,除了温度采用400℃—500℃外,促进该反应正向进行的措施是(至少两点)
(2)电化学制备方法:目前科学家利用生物燃料电池原理(电池工作时MV2+/MV+在电极与酶之间传递电子),研究室温下合成氨并取得初步成果,示意图如图:

①氢化酶区域发生反应的离子方程式是
②溶液中H+的移动方向是
③下列说法正确的是
A.该装置可以实现电能转化为化学能
B.电极a是燃料电池的负极
C.该方法相较于传统工业合成方法具有条件温和,对环境友好等优点
您最近一年使用:0次
名校
10 . 回答下列问题:
(1)将燃煤产生的二氧化碳回收利用,可达到低碳排放的目的。图是通过人工光合作用,以CO2和H2O为原料制备HCOOH和O2的原理示意图。电极b作___________ 极,发生的电极反应式为___________ 。
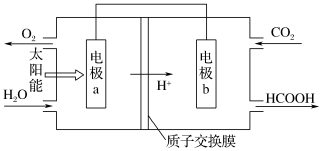
(2)浓差电池中的电动势是由于电池中存在浓度差而产生的。某浓差电池的原理如图所示,该电池从浓缩海水中提取LiCl的同时又获得了电能。

①X为___________ 极,Y电极反应式为___________ 。
②Y极生成1 mol Cl2时,___________ mol Li+移向X极。
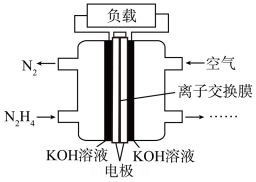
(3)一种以肼(N2H4)为液体燃料的电池装置如图所示。该电池用空气中的氧气作氧化剂,KOH溶液作电解质溶液。负极反应式为___________ ,正极反应式为___________ 。
(1)将燃煤产生的二氧化碳回收利用,可达到低碳排放的目的。图是通过人工光合作用,以CO2和H2O为原料制备HCOOH和O2的原理示意图。电极b作

(2)浓差电池中的电动势是由于电池中存在浓度差而产生的。某浓差电池的原理如图所示,该电池从浓缩海水中提取LiCl的同时又获得了电能。

①X为
②Y极生成1 mol Cl2时,
(3)一种以肼(N2H4)为液体燃料的电池装置如图所示。该电池用空气中的氧气作氧化剂,KOH溶液作电解质溶液。负极反应式为

您最近一年使用:0次



