名校
解题方法
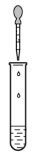
1 . 用下列仪器或装置(图中夹持装置略)进行相应实验,不能达到实验目的的是

| A.装置甲探究浓硫酸的脱水性和氧化性 | B.装置乙探究温度对水解程度的影响 |
| C.装置丙制备干燥的氢气 | D.装置丁验证Cu与Fe3+反应产生电流 |
您最近一年使用:0次
名校
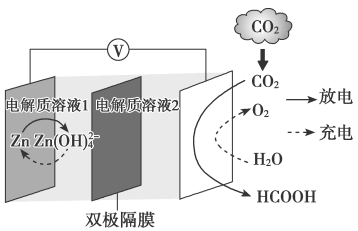
2 . 科学家近年发明了一种新型 水介质电池。电池示意图如下,电极为金属锌和选择性催化材料,放电时,温室气体
水介质电池。电池示意图如下,电极为金属锌和选择性催化材料,放电时,温室气体 被转化为储氢物质甲酸等,为解决环境和能源问题提供了一种新途径。下列说法不正确的是
被转化为储氢物质甲酸等,为解决环境和能源问题提供了一种新途径。下列说法不正确的是
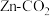 水介质电池。电池示意图如下,电极为金属锌和选择性催化材料,放电时,温室气体
水介质电池。电池示意图如下,电极为金属锌和选择性催化材料,放电时,温室气体 被转化为储氢物质甲酸等,为解决环境和能源问题提供了一种新途径。下列说法不正确的是
被转化为储氢物质甲酸等,为解决环境和能源问题提供了一种新途径。下列说法不正确的是
A.放电时,负极反应为 |
| B.电解质溶液1为碱性,电解质溶液2为酸性 |
C.充电时,阳极溶液中 浓度升高 浓度升高 |
D.充电时,电池总反应为: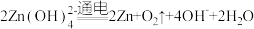 |
您最近一年使用:0次
2022-03-11更新
|
952次组卷
|
5卷引用:江苏省苏州市张家港市2021-2022学年高三下学期开学考试化学试题
江苏省苏州市张家港市2021-2022学年高三下学期开学考试化学试题四川省绵阳南山中学2021-2022学年高二下学期3月月考理综化学试题广东省广州市第十六中学2021-2022学年高二下学期期中测试化学试题(已下线)押江苏卷第12题 电化学及其应用 -备战2022年高考化学临考题号押题(江苏卷)江苏省盐城市2021-2022学年高二下学期期末联考模拟考试化学试题
解题方法
3 . 下列实验方案不能达到目的的是
| A | B | C | D | |
| 目的 | 判断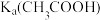 和 和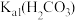 的大小 的大小 | 研究浓度对化学反应速率的影响 | 铁上镀锌 | 研究  氧化性强弱 氧化性强弱 |
| 实验方案 |
向2mL1molL-1CH3COOH溶液中滴加几滴1mol∙L-1Na2CO3溶液 |
向体积均为2mL0.1mol∙L-1、0.2mol∙L-1KMnO4溶液中分别滴加2mL0.1molL-1H2C2O4溶液 | 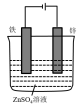 | 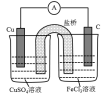 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
解题方法
4 . 某小组拟设计如图所示电化学装置探究 和
和 的氧化性强弱(烧杯中溶液体积均为100mL)。
的氧化性强弱(烧杯中溶液体积均为100mL)。

(1)配制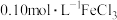 溶液时,先将一定量
溶液时,先将一定量 溶于盛有少量
溶于盛有少量_______ (填试剂名称)的烧杯中,然后进行移液、洗涤、定容等一系列操作。
(2)关闭K,电流表显示电流由银极流向铂极,由此可知银极为_______ 极。
(3)经过 ,测得银极质量净增0.432g,此时左侧溶液中
,测得银极质量净增0.432g,此时左侧溶液中
_______  (不考虑溶液体积变化、水解等因素)。
(不考虑溶液体积变化、水解等因素)。
(4)根据(2)、(3)的实验结果分析,铂极的电极反应式为_______ ;氧化性:
_______  (填“>”“<”或“=”)。
(填“>”“<”或“=”)。
(5)一段时间后,向铂极附近溶液中加入适量无水 固体,电流表显示电流由铂极流向银极,这说明
固体,电流表显示电流由铂极流向银极,这说明 和
和 的氧化性相对强弱与
的氧化性相对强弱与_______ 有关。
 和
和 的氧化性强弱(烧杯中溶液体积均为100mL)。
的氧化性强弱(烧杯中溶液体积均为100mL)。
(1)配制
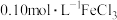 溶液时,先将一定量
溶液时,先将一定量 溶于盛有少量
溶于盛有少量(2)关闭K,电流表显示电流由银极流向铂极,由此可知银极为
(3)经过
 ,测得银极质量净增0.432g,此时左侧溶液中
,测得银极质量净增0.432g,此时左侧溶液中
 (不考虑溶液体积变化、水解等因素)。
(不考虑溶液体积变化、水解等因素)。(4)根据(2)、(3)的实验结果分析,铂极的电极反应式为

 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。(5)一段时间后,向铂极附近溶液中加入适量无水
 固体,电流表显示电流由铂极流向银极,这说明
固体,电流表显示电流由铂极流向银极,这说明 和
和 的氧化性相对强弱与
的氧化性相对强弱与
您最近一年使用:0次
2021-01-31更新
|
192次组卷
|
2卷引用:河南省平顶山市2020-2021学年高二上学期期末调研考试化学试题
名校
解题方法
5 . 钒有V(V)、V(Ⅳ)、V(Ⅲ)、V(Ⅱ)多种价态,且化合价越高氧化性越强,含有的VO /VO2+和V2+/V3+价态的钒离子溶液可作为正、负极的活性物质组成化学电池,其工作原理如图所示,下列说法不正确的是
/VO2+和V2+/V3+价态的钒离子溶液可作为正、负极的活性物质组成化学电池,其工作原理如图所示,下列说法不正确的是
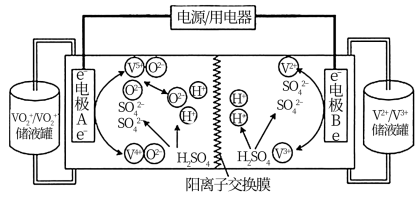
 /VO2+和V2+/V3+价态的钒离子溶液可作为正、负极的活性物质组成化学电池,其工作原理如图所示,下列说法不正确的是
/VO2+和V2+/V3+价态的钒离子溶液可作为正、负极的活性物质组成化学电池,其工作原理如图所示,下列说法不正确的是
| A.放电时,电极B的电极反应式为V2+-e- = V3+ |
| B.该电池清洁无污染,是一种理想的绿色电池 |
| C.该电池中充电时,电极A接电源正极 |
| D.放电时,H+从左向右移动 |
您最近一年使用:0次
名校
解题方法
6 . 已知负极的电极反应式为:Ag+Cl--e-=AgCl。下列说法不正确 的是


| A.正极的电极反应式是Ag++e-=Ag |
| B.电池总反应可表示为Ag+ +Cl-=AgCl |
C.反应时,盐桥中的NO 移向KCl溶液 移向KCl溶液 |
| D.该电池证明:Ag+浓度越大,氧化性越弱 |
您最近一年使用:0次
7 . 根据下列实验现象,所得结论正确的是( )
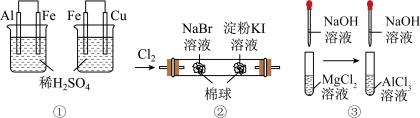

| 实验 | 实验现象 | 结论 |
| ① | 左边烧杯中铁表面有气泡,右边烧杯中铜表面有气泡 | 活动性:Al>Fe>Cu |
| ② | 左边棉花变橙色,右边棉花变蓝色 | 氧化性:Cl2>Br2>I2 |
| ③ | 左边试管中产生白色沉淀,右边试管中先产生白色沉淀后沉淀消失 | 溶解性:Ksp[Mg(OH)2]比Ksp[Al(OH)3]小 |
| A.① | B.①② |
| C.②③ | D.①③ |
您最近一年使用:0次
名校
解题方法
8 . 在通风橱中进行下列实验:
下列说法正确的是( )
| 步骤 | 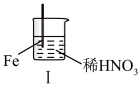 | 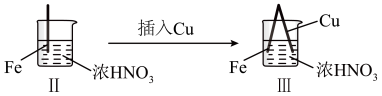 | |
| 现象 | Fe表面产生大量无色气泡,液面上方变为红棕色 | Fe表面产生少量红棕色气泡后,迅速停止 | Fe、Cu接触后,其表面均产生红棕色气泡 |
| A.Ⅰ中气体由无色变红棕色的化学方程式为:2NO+O2=NO2 |
| B.Ⅱ中现象是因为浓HNO3会使Fe表面覆盖一层保护膜,阻止Fe进一步反应,此反应不属于氧化还原反应 |
| C.对比Ⅰ、Ⅱ中现象,说明稀HNO3的氧化性强于浓HNO3 |
| D.针对Ⅲ中现象,在Fe、Cu之间连接电流表,可判断Fe是否被氧化 |
您最近一年使用:0次
2020-05-11更新
|
589次组卷
|
3卷引用:辽宁省沈阳铁路实验中学2019-2020学年高一下学期期中考试化学试题
9 . 能量转化是化学变化的主要特征之一,按要求回答下列问题。
(1)页岩气是从页岩层中开采出来的天然气,成分以甲烷为主,页岩气的资源潜力可能大于常规天然气。下列有关页岩气的叙述错误的是___________(填字母)。
(2)有关的电池装置如图:
①上述四种电池中,属于二次电池的是___________ (填字母)。
②a装置中,外电路中电子的流向是___________ (填“从Zn流向Cu”或“从Cu流向Zn”)。
③d装置放电时总反应为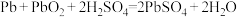 。写出放电时负极的电极反应式:
。写出放电时负极的电极反应式:___________ 。
(3)氧化还原反应一般可以设计成原电池。若将反应 设计成原电池,则:
设计成原电池,则:
①电池的负极材料是___________ ,负极发生___________ 反应(填“氧化”或“还原”,电解质溶液可以是:___________ ;
②正极上出现的现象是___________ ;
③当外电路中转移1mol 时,电解质溶液减少的质量是
时,电解质溶液减少的质量是___________ g。
(1)页岩气是从页岩层中开采出来的天然气,成分以甲烷为主,页岩气的资源潜力可能大于常规天然气。下列有关页岩气的叙述错误的是___________(填字母)。
| A.页岩气属于新能源 |
| B.页岩气和氧气的反应是放热反应 |
| C.甲烷中每个原子的最外层电子排布都达到8电子稳定结构 |
| D.页岩气可以作燃料电池的负极燃料 |
| 编号 | a | b | c | d |
| 电池装置 |  |  |  |  |
②a装置中,外电路中电子的流向是
③d装置放电时总反应为
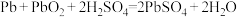 。写出放电时负极的电极反应式:
。写出放电时负极的电极反应式:(3)氧化还原反应一般可以设计成原电池。若将反应
 设计成原电池,则:
设计成原电池,则:①电池的负极材料是
②正极上出现的现象是
③当外电路中转移1mol
 时,电解质溶液减少的质量是
时,电解质溶液减少的质量是
您最近一年使用:0次
10 . 某实验小组同学进行如下实验,以检验化学反应中的能量变化。
(1)实验中发现,反应后①中的温度升高;②中的温度降低。由此判断铝条与盐酸的反应是__ 热反应,Ba(OH)2•8H2O与NH4Cl反应时,需要将固体研细其目的是__ ,反应过程__ (填“①”或“②”)的能量变化可用图表示。

(2)为了验证Fe3+与Cu2+氧化性强弱,下列装置能达到实验目的是__ (填序号)。

(1)实验中发现,反应后①中的温度升高;②中的温度降低。由此判断铝条与盐酸的反应是

(2)为了验证Fe3+与Cu2+氧化性强弱,下列装置能达到实验目的是

您最近一年使用:0次