名校
1 . 铜基催化剂催化甲醇水蒸气重整制氢是液体燃料制氢的重要方向,主要包含甲醇水蒸气重整反应、甲醇分解反应和水气变换反应,具体反应方程式如下:
Ⅰ.

Ⅱ.

Ⅲ.

回答下列问题:
(1)则
___________  。
。
(2)有利于提高甲醇平衡转化率的是___________ (填标号)。
A.增加 的用量 B.恒温恒压条件下通入Ar
的用量 B.恒温恒压条件下通入Ar
C.升高温度 D.选择更高效的催化剂 E.及时分离出
(3)一定条件下,向压强为 的恒压密闭容器中通入
的恒压密闭容器中通入 、
、 物质的量比为
物质的量比为 的混合气体,发生上述反应,达到平衡时,容器中
的混合气体,发生上述反应,达到平衡时,容器中 、
、 ,此时
,此时 的产率为
的产率为___________ ,反应Ⅱ的以分压表示的化学平衡常数 为
为___________ (用含 的代数式表示)。
的代数式表示)。
(4)液相空速表示进料速度的快慢。不同温度下,平衡时甲醇转化率和CO浓度随甲醇液相空速的变化如图所示。随温度升高,CO浓度变化的原因是___________ ,制氢产物可以用于车载燃料电池,CO含量太高会对电池产生巨大危害。甲醇水蒸气重整制氢的适宜条件是___________ ℃,___________  。
。 自由迁移的固体电解质氢氧燃料电池中,
自由迁移的固体电解质氢氧燃料电池中, 放电的电极反应式为
放电的电极反应式为___________ 。
Ⅰ.


Ⅱ.


Ⅲ.


回答下列问题:
(1)则

 。
。(2)有利于提高甲醇平衡转化率的是
A.增加
 的用量 B.恒温恒压条件下通入Ar
的用量 B.恒温恒压条件下通入ArC.升高温度 D.选择更高效的催化剂 E.及时分离出

(3)一定条件下,向压强为
 的恒压密闭容器中通入
的恒压密闭容器中通入 、
、 物质的量比为
物质的量比为 的混合气体,发生上述反应,达到平衡时,容器中
的混合气体,发生上述反应,达到平衡时,容器中 、
、 ,此时
,此时 的产率为
的产率为 为
为 的代数式表示)。
的代数式表示)。(4)液相空速表示进料速度的快慢。不同温度下,平衡时甲醇转化率和CO浓度随甲醇液相空速的变化如图所示。随温度升高,CO浓度变化的原因是
 。
。
 自由迁移的固体电解质氢氧燃料电池中,
自由迁移的固体电解质氢氧燃料电池中, 放电的电极反应式为
放电的电极反应式为
您最近一年使用:0次
2024-02-22更新
|
199次组卷
|
3卷引用:山东省济南市名校联盟2023-2024学年高三下学期开学考试化学试题
解题方法
2 . 氯碱工业是高耗能产业,一种将电解池与燃料电池相组合的新工艺可以节能30%以上,并同时制得 和
和 溶液。相关物料的传输与转化关系如图所示:
溶液。相关物料的传输与转化关系如图所示:
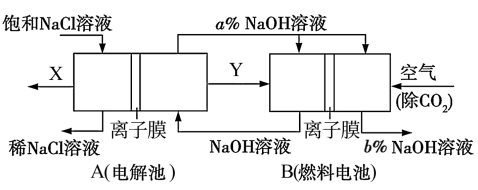
请回答下列问题:
(1)A池总反应的离子反应方程式为___________ 。燃料电池B中正极上发生的电极反应式为___________ 。
(2)装置中的离子膜是阳离子交换膜,当阴极产生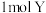 时,通过离子交换膜的
时,通过离子交换膜的 有
有___________  。
。
(3)装置图中氢氧化钠溶液质量分数的大小:
___________ 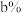 (填“>”、“=”或“<”)。
(填“>”、“=”或“<”)。
 和
和 溶液。相关物料的传输与转化关系如图所示:
溶液。相关物料的传输与转化关系如图所示:
请回答下列问题:
(1)A池总反应的离子反应方程式为
(2)装置中的离子膜是阳离子交换膜,当阴极产生
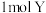 时,通过离子交换膜的
时,通过离子交换膜的 有
有 。
。(3)装置图中氢氧化钠溶液质量分数的大小:

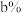 (填“>”、“=”或“<”)。
(填“>”、“=”或“<”)。
您最近一年使用:0次
解题方法
3 . 废旧碱性锌锰电池经以下工艺处理后,可实现钾、锌、锰等元素的有效回收。回答下列问题:
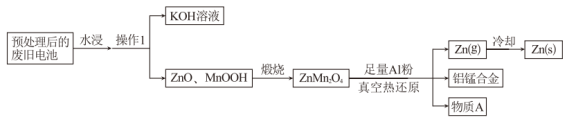
(1)“操作1”的名称为___________ 。
(2)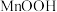 中
中 元素的化合价为
元素的化合价为___________ 。
(3)“煅烧”得到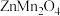 的化学方程式为
的化学方程式为___________ 。
(4)物质 的主要成分为
的主要成分为___________ (填化学式)。
(5)预处理后的废旧电池质量为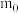 ,其中
,其中 元素的质量分数为
元素的质量分数为 ,回收得到
,回收得到 的质量为
的质量为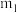 ,则
,则 元素的回收率为
元素的回收率为___________ (回收率 )。
)。
(6)氢氧燃料电池选用 溶液作为电解质溶液,负极的电极反应式为
溶液作为电解质溶液,负极的电极反应式为___________ 。

(1)“操作1”的名称为
(2)
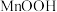 中
中 元素的化合价为
元素的化合价为(3)“煅烧”得到
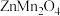 的化学方程式为
的化学方程式为(4)物质
 的主要成分为
的主要成分为(5)预处理后的废旧电池质量为
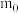 ,其中
,其中 元素的质量分数为
元素的质量分数为 ,回收得到
,回收得到 的质量为
的质量为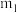 ,则
,则 元素的回收率为
元素的回收率为 )。
)。(6)氢氧燃料电池选用
 溶液作为电解质溶液,负极的电极反应式为
溶液作为电解质溶液,负极的电极反应式为
您最近一年使用:0次
名校
解题方法
4 . 电化学在科技、生产、社会和生活的各个发面都发挥着重要的作用。
(1)图中,为了减缓海水对钢闸门A的腐蚀,材料B可以选择_______ (填字母)。这种防止金属材料腐蚀的方法叫做_______。
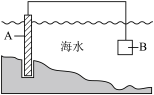
a.金块 b.锌板 c.铜板 d.钠块
氯碱工业是高耗能产业,一种将电解池与燃料电池相组合的新工艺,节能超过30%,在此工艺中,物料传输和转化关系如图。(电极均为石墨电极)
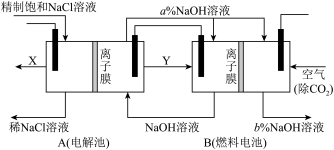
(2)写出A装置中发生反应的离子反应方程式:_______,分析比较图示中a%与b%的大小:a%_______b%(填“>”“<”或“=”)。
(3)写出燃料电池B中的负极的电极反应:_______。
通过NO传感器可监测汽车尾气中NO的含量,工作原理如图所示:
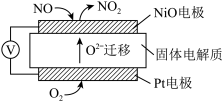
(4)NiO电极上发生的是反应_______(填“氧化”或“还原”)。Pt电极上的电极反应式为_______。
(1)图中,为了减缓海水对钢闸门A的腐蚀,材料B可以选择_______ (填字母)。这种防止金属材料腐蚀的方法叫做_______。

a.金块 b.锌板 c.铜板 d.钠块
氯碱工业是高耗能产业,一种将电解池与燃料电池相组合的新工艺,节能超过30%,在此工艺中,物料传输和转化关系如图。(电极均为石墨电极)

(2)写出A装置中发生反应的离子反应方程式:_______,分析比较图示中a%与b%的大小:a%_______b%(填“>”“<”或“=”)。
(3)写出燃料电池B中的负极的电极反应:_______。
通过NO传感器可监测汽车尾气中NO的含量,工作原理如图所示:

(4)NiO电极上发生的是反应_______(填“氧化”或“还原”)。Pt电极上的电极反应式为_______。
您最近一年使用:0次
2022-10-11更新
|
300次组卷
|
2卷引用:山东省枣庄市第三中学2022-2023学年高二上学期10月阶段检测化学试题
5 . 化学源于生活,又服务于生活。请根据所给材料回答以下问题:
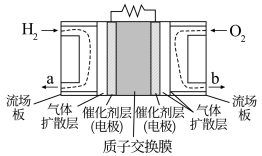
(1)氢氧燃料电池是公认的最适合载人航天器的化学能源。如图为第二代质子(H+)交换膜燃料电池,电池装置上加装冷凝水接收装置,应接在位置___________ 处(填a或b)。正极电极反应式:___________ ;负极电极反应式:___________ 。
(2)①氢气可通过电解水或饱和食盐水获得,请写出用惰性电极电解饱和食盐水的化学方程式:___________ 。
②用如图装置进行粗铜精炼时,下列说法正确的是___________ 。

A 电极a为粗铜,电极b为纯铜;
B.溶液可以用AgNO3溶液
C.电极b的电极反应式为Cu2++2e−=Cu
D.溶液中阳离子移动方向为a→b
E.若阳极质量减少64g,则电路中必定转移2mol电子
(3)已知可逆反应CO2(g)+2NH3(g) CO(NH2)2(s)+H2O(g) ΔH < 0,可生产尿素。
CO(NH2)2(s)+H2O(g) ΔH < 0,可生产尿素。

①可逆反应建立平衡后,t1时刻温度由T2变化到T1,水蒸气含量变化如图1所示,则可知T1___________ T2 (填>、=或<);
②若温度不变,水蒸气含量与压强关系如图2所示,则压强P1时的化学平衡常数K1___________ 压强P2时的化学平衡常数K2(填>、=或<);
③若要提高NH3的平衡转化率,应采取的措施为___________ 。
④向2 L恒容密闭容器中通入CO2和NH3,反应进行到不同时刻测得的物质的量部分数据如下:
从表中数据分析可得10min时NH3转化率为___________ ;平衡常数K=___________ 。
(1)氢氧燃料电池是公认的最适合载人航天器的化学能源。如图为第二代质子(H+)交换膜燃料电池,电池装置上加装冷凝水接收装置,应接在位置

(2)①氢气可通过电解水或饱和食盐水获得,请写出用惰性电极电解饱和食盐水的化学方程式:
②用如图装置进行粗铜精炼时,下列说法正确的是

A 电极a为粗铜,电极b为纯铜;
B.溶液可以用AgNO3溶液
C.电极b的电极反应式为Cu2++2e−=Cu
D.溶液中阳离子移动方向为a→b
E.若阳极质量减少64g,则电路中必定转移2mol电子
(3)已知可逆反应CO2(g)+2NH3(g)
 CO(NH2)2(s)+H2O(g) ΔH < 0,可生产尿素。
CO(NH2)2(s)+H2O(g) ΔH < 0,可生产尿素。
①可逆反应建立平衡后,t1时刻温度由T2变化到T1,水蒸气含量变化如图1所示,则可知T1
②若温度不变,水蒸气含量与压强关系如图2所示,则压强P1时的化学平衡常数K1
③若要提高NH3的平衡转化率,应采取的措施为
④向2 L恒容密闭容器中通入CO2和NH3,反应进行到不同时刻测得的物质的量部分数据如下:
 | 0 | 10 | 20 | 30 | 40 | 50 |
| CO2 | 12.0 | 11.3 | 9.1 | 6.0 | ||
| NH3 | 14.0 | 2.0 |
您最近一年使用:0次
2021-12-06更新
|
145次组卷
|
2卷引用:福建省宁德市同心顺联盟校2021—2022学年高二上学期期中联考化学试题
6 . 氢气(H2)是最理想的燃料。回答下列问题:
(1)利用太阳能直接分解水制氢,是最具吸引力的制氢途径,其能量转化形式为___________ 。
(2)氢气作为燃料的优点是________________ (写出一点即可)。目前,氢氧燃料电池已经使用于汽车。若该电池的电解质呈碱性,写出负极电池反应式:_____________ ;若该电池的电解质呈酸性,写出正极电池反应式:________________ 。
(3)氢气可制备H2O2。工业上较为成熟的方法是蒽醌法,其原理是:烷基蒽醌与有机溶剂配制成工作溶液,在压力为0.30MPa、温度55~65℃、有催化剂存在的条件下,通入氢气进行氢化,在40~44℃温度下与空气(或氧气)进行逆流氧化,经萃取、再生、精制与浓缩制得质量分数为20%~30%的过氧化氢水溶液产品。上述过程可用以下反应表示:
I.H2(g)+A(l)=B(l) △H1
II.O2(g)+B(l)=A(l)+H2O2(l) △H2
其中A、B为有机物,两反应均为自发反应,则H2(g)+O2(g)=H2O2(l)的△H_________ (填“>”“<”或“=”)0。
(4)金属氢化物(NaH、MgH2等)是常用的储氢材料,写出MgH2与水反应的化学方程式:__________________ 。
(1)利用太阳能直接分解水制氢,是最具吸引力的制氢途径,其能量转化形式为
(2)氢气作为燃料的优点是
(3)氢气可制备H2O2。工业上较为成熟的方法是蒽醌法,其原理是:烷基蒽醌与有机溶剂配制成工作溶液,在压力为0.30MPa、温度55~65℃、有催化剂存在的条件下,通入氢气进行氢化,在40~44℃温度下与空气(或氧气)进行逆流氧化,经萃取、再生、精制与浓缩制得质量分数为20%~30%的过氧化氢水溶液产品。上述过程可用以下反应表示:
I.H2(g)+A(l)=B(l) △H1
II.O2(g)+B(l)=A(l)+H2O2(l) △H2
其中A、B为有机物,两反应均为自发反应,则H2(g)+O2(g)=H2O2(l)的△H
(4)金属氢化物(NaH、MgH2等)是常用的储氢材料,写出MgH2与水反应的化学方程式:
您最近一年使用:0次
解题方法
7 . (1)一定温度下,在容积为V L的密闭容器中进行反应:aN(g) bM(g),M、N的物质的量随时间的变化曲线如图所示:
bM(g),M、N的物质的量随时间的变化曲线如图所示:
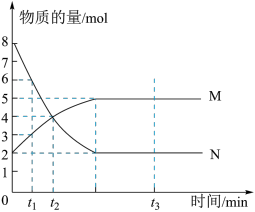
①此反应的化学方程式中a :b=__________
②t1到t2时刻,以M的浓度变化表示的平均反应速率为:_________________
③下列叙述中能说明上述反应达到平衡状态的是______________
A.反应中M与N的物质的量之比为1︰1
B.混合气体的总质量不随时间的变化而变化
C.混合气体的总物质的量不随时间的变化而变化
D.单位时间内每消耗a mol N,同时生成b mol M
E.混合气体的压强不随时间的变化而变化
F.N的质量分数在混合气体中保持不变
(2)如图是某锌锰干电池的基本构造图。

①该干电池的总反应式为2MnO2+Zn+2H2O=2MnO(OH)+ Zn(OH)2,该电池的负极是___________ ,工作时正极的电极反应式是______________________________ 。
②关于该电池的使用和性能,下列说法正确的是____________
A.该电池属于蓄电池
B.电池工作时OH-向负极移动
C.该电池的电解质溶液是H2SO4溶液
D.该电池用完后可随意丢弃,不需要回收处理
(3)另一种常用的电池锂电池由于比容量(单位质量电极材料所能转换的电量)特别大而广泛用于心脏起搏器,它的负极材料用金属锂制成,电解质溶液需用非水溶液配制,请用化学方程式表示不能用水溶液的原因_______________________________ 。
(4)燃料电池的工作原理是将燃料和氧化剂(如O2)反应所放出的化学能直接转化为电能。现设计一氢氧燃料电池,以电极a为正极,电极b为负极,采用氢氧化钠溶液为电解液,则氧气应通入_________ 极(填序号),电解质溶液的pH将____________ (填“变大”,“变小”或“不变”)
 bM(g),M、N的物质的量随时间的变化曲线如图所示:
bM(g),M、N的物质的量随时间的变化曲线如图所示:
①此反应的化学方程式中a :b=
②t1到t2时刻,以M的浓度变化表示的平均反应速率为:
③下列叙述中能说明上述反应达到平衡状态的是
A.反应中M与N的物质的量之比为1︰1
B.混合气体的总质量不随时间的变化而变化
C.混合气体的总物质的量不随时间的变化而变化
D.单位时间内每消耗a mol N,同时生成b mol M
E.混合气体的压强不随时间的变化而变化
F.N的质量分数在混合气体中保持不变
(2)如图是某锌锰干电池的基本构造图。

①该干电池的总反应式为2MnO2+Zn+2H2O=2MnO(OH)+ Zn(OH)2,该电池的负极是
②关于该电池的使用和性能,下列说法正确的是
A.该电池属于蓄电池
B.电池工作时OH-向负极移动
C.该电池的电解质溶液是H2SO4溶液
D.该电池用完后可随意丢弃,不需要回收处理
(3)另一种常用的电池锂电池由于比容量(单位质量电极材料所能转换的电量)特别大而广泛用于心脏起搏器,它的负极材料用金属锂制成,电解质溶液需用非水溶液配制,请用化学方程式表示不能用水溶液的原因
(4)燃料电池的工作原理是将燃料和氧化剂(如O2)反应所放出的化学能直接转化为电能。现设计一氢氧燃料电池,以电极a为正极,电极b为负极,采用氢氧化钠溶液为电解液,则氧气应通入
您最近一年使用:0次
解题方法
8 . 氯碱工业是以电解饱和食盐水为基础的化学工业。
I.电解所用的氯化钠溶液需精制,除去有影响的Ca2+、Mg2+、NH4+、SO42-及泥沙,其精制流程如下:
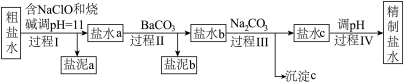
已知:①Ca2+、Mg2+开始形成相应氢氧化物沉淀的pH如下表。
②Ksp(BaSO4)= 1.1×10-10,Ksp(BaCO3)=2.6×10-9,Ksp(CaCO3)=5.0×10-9。
(1)盐泥a除泥沙外,还含有____________________________________ 。
(2)过程I中,NaClO的作用是将NH4+转化为N2,反应的离子方程式为________________________ 。
(3)过程III中,沉淀c主要成分的化学式为________________________ 。
(4)过程IV调pH目的是____________ 。
II.如图是将电解池与燃料电池相组合电解精制饱和食盐水的新工艺,可以节(电)能30%以上。相关物料的传输与转化关系如图所示,其中的电极未标出,所用的离子膜都只允许阳离子通过。
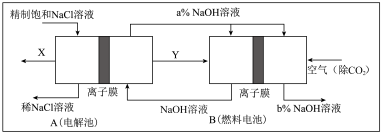
(1)图中X是____________ (填化学式)。
(2)Y在装置B中发生的电极反应式为____________ 。
(3)写出A装置中发生的总反应离子方程式____________ ,比较图示中氧氧化钠溶液质量分数a%与b%的大小:________________________ 。
(4)若用装置B作为装置A的辅助电源,每当消耗标准状况下氧气的体积为11.2L时,则装置B可向装置A提供的电量约为____________ (一个e-的电量为1.60×10-19C;计算结果精确到0.01)。
I.电解所用的氯化钠溶液需精制,除去有影响的Ca2+、Mg2+、NH4+、SO42-及泥沙,其精制流程如下:

已知:①Ca2+、Mg2+开始形成相应氢氧化物沉淀的pH如下表。
| Ca(OH)2 | Mg(OH)2 | |
| pH | ≥11.5 | ≥9.2 |
②Ksp(BaSO4)= 1.1×10-10,Ksp(BaCO3)=2.6×10-9,Ksp(CaCO3)=5.0×10-9。
(1)盐泥a除泥沙外,还含有
(2)过程I中,NaClO的作用是将NH4+转化为N2,反应的离子方程式为
(3)过程III中,沉淀c主要成分的化学式为
(4)过程IV调pH目的是
II.如图是将电解池与燃料电池相组合电解精制饱和食盐水的新工艺,可以节(电)能30%以上。相关物料的传输与转化关系如图所示,其中的电极未标出,所用的离子膜都只允许阳离子通过。

(1)图中X是
(2)Y在装置B中发生的电极反应式为
(3)写出A装置中发生的总反应离子方程式
(4)若用装置B作为装置A的辅助电源,每当消耗标准状况下氧气的体积为11.2L时,则装置B可向装置A提供的电量约为
您最近一年使用:0次
解题方法
9 . A、B、C、D四种短周期主族元素,原子序数依次增大,A是相对原子质量最小的元素,B元素原子的最外层电子数是次外层的2倍,C是地壳中含量最多的元素,D是第三周期原子半径最小的元素,A、B两种元素组成的最简单的化合物为X。
(1)B元素在元素周期表中的位置___ 。
(2)X分子的空间结构为___ 。
(3)B与C非金属性强的元素是___ (填元素符号)。
(4)A2与C2组成的燃料电池,通入A2的一极是___ (填“正极”或“负极”),该燃料电池的优点___ (写一条即可)。
(5)写出X与D单质生成BA3D的化学方程式___ ,该反应类型为___ 。
(1)B元素在元素周期表中的位置
(2)X分子的空间结构为
(3)B与C非金属性强的元素是
(4)A2与C2组成的燃料电池,通入A2的一极是
(5)写出X与D单质生成BA3D的化学方程式
您最近一年使用:0次
名校
解题方法
10 . Ⅰ.化学反应中的焓变(Δ H)与反应物和生成物的键能(E)有关。下表给出了一些化学键的键能:
已知工业合成氨: N2(g)+3H2(g) 2NH3(g) Δ H= -92.4 kJ· mol-1, 请回答下列问题:
2NH3(g) Δ H= -92.4 kJ· mol-1, 请回答下列问题:
(1)表中 a =______ kJ· mol-1
(2)1 mol N2和3 mol H2充分反应,放出的热量______ 92.4 kJ(填“>”、“<”或“=”)。
II.随着人类对温室效应和资源短缺等问题的重视,如何降低大气中 CO2的含量及有效地开发利用CO2,引起了普遍的重视。
(1)目前工业上有一种方法是用 CO2来生产甲醇:CO2(g)+3H2(g) CH3OH(g)+H2O(g)。下图表示该反应进行过程中能量的变化,该反应是
CH3OH(g)+H2O(g)。下图表示该反应进行过程中能量的变化,该反应是_____ (填“吸热”或“放热”)反应;

(2)下列各项中,能说明 CO2(g)+3H2(g) CH3OH(g)+H2O(g)已达到平衡的是
CH3OH(g)+H2O(g)已达到平衡的是____ (填选项)。
A.恒温、恒容条件下,容器内的压强不发生变化
B.一定条件下,CH3OH 分解的速率和 CH3OH 生成的速率相等
C.一定条件下,单位时间内消耗 1 mol CO2,同时生成 1 mol CH3OH
D.一定条件下,H2O(g)的浓度保持不变
III.如图是氢氧燃料电池构造示意图。
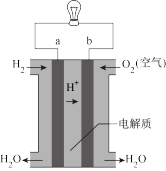
该电池工作时,电子的流向______ →_____ (填“a”“b”),每生成1 mol H2O则理论上电路中通过的电子数为__________ 。
| 化学键 | H-H | N≡N | O=O | O-H | N-H |
| 键能(kJ/mol) | 436 | 942 | 500 | 463 | a |
已知工业合成氨: N2(g)+3H2(g)
 2NH3(g) Δ H= -92.4 kJ· mol-1, 请回答下列问题:
2NH3(g) Δ H= -92.4 kJ· mol-1, 请回答下列问题:(1)表中 a =
(2)1 mol N2和3 mol H2充分反应,放出的热量
II.随着人类对温室效应和资源短缺等问题的重视,如何降低大气中 CO2的含量及有效地开发利用CO2,引起了普遍的重视。
(1)目前工业上有一种方法是用 CO2来生产甲醇:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g)。下图表示该反应进行过程中能量的变化,该反应是
CH3OH(g)+H2O(g)。下图表示该反应进行过程中能量的变化,该反应是
(2)下列各项中,能说明 CO2(g)+3H2(g)
 CH3OH(g)+H2O(g)已达到平衡的是
CH3OH(g)+H2O(g)已达到平衡的是A.恒温、恒容条件下,容器内的压强不发生变化
B.一定条件下,CH3OH 分解的速率和 CH3OH 生成的速率相等
C.一定条件下,单位时间内消耗 1 mol CO2,同时生成 1 mol CH3OH
D.一定条件下,H2O(g)的浓度保持不变
III.如图是氢氧燃料电池构造示意图。

该电池工作时,电子的流向
您最近一年使用:0次
2020-09-12更新
|
80次组卷
|
2卷引用:江西省赣州市赣县第三中学2020-2021学年高二上学期9月入学考试化学试题(重点班)



