名校
解题方法
1 . 电化学在现代生活、生产和科学技术的发展中发挥着越来越重要的作用。
(1)Na2FeO4是制造高铁电池的重要原料,同时也是一种新型的高效净水剂。在工业上通常利用如图装置生产Na2FeO4。
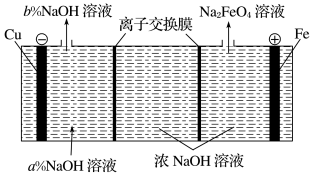
①阳极的电极反应式为_______ 。
②右侧的离子交换膜为_______ (填“阴”或“阳”)离子交换膜,阴极区a%_______ b%(填“>”“═”或“<”)。
③阴极产生的气体为_______ 。
(2)SO2和NOx是主要大气污染物,如图是同时吸收SO2和NOx的示意图。
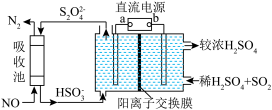
①b是直流电源的_______ 。
②已知电解池的阴极室中溶液的pH在4~7之间,阴极的电极反应为_______ 。
③当NOx均为NO时,吸收池中发生反应的氧化剂与还原剂的物质的量之比为_______ 。
(3)某原电池装置如图所示,电池总反应为2Ag+Cl2═2AgCl。

①当电路中转移amole-时,交换膜左侧溶液中约减少_______ mol离子。交换膜右侧溶液中c(HCl)________ (填“>”“<”或“═”)1mol•L-1(忽略溶液体积变化)。
②若质子交换膜换成阴离子交换膜,其他不变。若有11.2L氯气(标准状况)参与反应,则必有_______ mol离子通过交换膜向_______ 侧迁移。(填“左”、“右”)
(1)Na2FeO4是制造高铁电池的重要原料,同时也是一种新型的高效净水剂。在工业上通常利用如图装置生产Na2FeO4。

①阳极的电极反应式为
②右侧的离子交换膜为
③阴极产生的气体为
(2)SO2和NOx是主要大气污染物,如图是同时吸收SO2和NOx的示意图。

①b是直流电源的
②已知电解池的阴极室中溶液的pH在4~7之间,阴极的电极反应为
③当NOx均为NO时,吸收池中发生反应的氧化剂与还原剂的物质的量之比为
(3)某原电池装置如图所示,电池总反应为2Ag+Cl2═2AgCl。

①当电路中转移amole-时,交换膜左侧溶液中约减少
②若质子交换膜换成阴离子交换膜,其他不变。若有11.2L氯气(标准状况)参与反应,则必有
您最近一年使用:0次
名校
解题方法
2 . 回答下列问题
(1)下列事实中,与电化学腐蚀无关的是_______
A.埋在潮湿土壤里的铁管比埋在干燥土壤里的铁管更易被腐蚀
B.金属钠置于空气中表面变暗
C.镀银的铁制品,镀层部分受损后,露出的铁表面更易被腐蚀
D.黄铜(铜锌合金)制作的铜锣不易产生铜绿
E.生铁比软铁芯(几乎是纯铁)容易生锈
F.铁制器件附有铜制配件,在接触处易生铁锈
(2)以石墨为电极,电解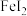 溶液,阳极电极反应式为
溶液,阳极电极反应式为_______ 。
(3)利用反应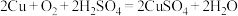 可制备
可制备 ,若将该反应设计为原电池,其正极电极反应式为
,若将该反应设计为原电池,其正极电极反应式为_______ 。
(4)利用人工光合作用可将 转化为甲酸,反应原理为
转化为甲酸,反应原理为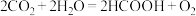 ,装置如图所示:
,装置如图所示:
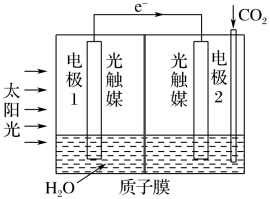
电极2的电极反应式是_______ ;
(5)离子液体是一种室温熔融盐,为非水体系,由有机阳离子、 和
和 组成的离子液体作电解液时,可在钢制品上电镀铝。钢制品应接电源的
组成的离子液体作电解液时,可在钢制品上电镀铝。钢制品应接电源的_______ 极,已知电镀过程中不产生其他离子且有机阳离子不参与电极反应,阴极电极反应式为_______ 。
(6)已知 是可逆反应,设计如图装置(
是可逆反应,设计如图装置( 、
、 均为石墨电极)开始时:
均为石墨电极)开始时: 棒电极反应式
棒电极反应式_______ ,当电流表_______ 时,反应达到化学平衡状态。
(1)下列事实中,与电化学腐蚀无关的是
A.埋在潮湿土壤里的铁管比埋在干燥土壤里的铁管更易被腐蚀
B.金属钠置于空气中表面变暗
C.镀银的铁制品,镀层部分受损后,露出的铁表面更易被腐蚀
D.黄铜(铜锌合金)制作的铜锣不易产生铜绿
E.生铁比软铁芯(几乎是纯铁)容易生锈
F.铁制器件附有铜制配件,在接触处易生铁锈
(2)以石墨为电极,电解
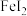 溶液,阳极电极反应式为
溶液,阳极电极反应式为(3)利用反应
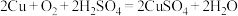 可制备
可制备 ,若将该反应设计为原电池,其正极电极反应式为
,若将该反应设计为原电池,其正极电极反应式为(4)利用人工光合作用可将
 转化为甲酸,反应原理为
转化为甲酸,反应原理为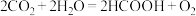 ,装置如图所示:
,装置如图所示:
电极2的电极反应式是
(5)离子液体是一种室温熔融盐,为非水体系,由有机阳离子、
 和
和 组成的离子液体作电解液时,可在钢制品上电镀铝。钢制品应接电源的
组成的离子液体作电解液时,可在钢制品上电镀铝。钢制品应接电源的(6)已知
 是可逆反应,设计如图装置(
是可逆反应,设计如图装置( 、
、 均为石墨电极)开始时:
均为石墨电极)开始时: 棒电极反应式
棒电极反应式
您最近一年使用:0次
解题方法
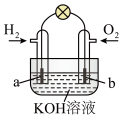
3 . 某课外活动小组进行电解饱和食盐水的实验(如图)。请回答下列问题。

(1)通电一段时间后,可观察到_______ 电极(填“阴极”或“阳极”)附近溶液颜色先变红,该电极上的电极反应式为_______ 。
(2)该溶液电解反应的化学方程式为_______ 。
(3)若开始时改用银棒做阳极,阳极的电极反应式为_______ 。
(4)若用H2和O2为反应物,以KOH为电解质溶液,可构成新型燃料电池(如图),两个电极均由多孔性炭制成,通入的气体由孔隙中逸出,并在电极表面放电。则a极的电极反应式为_______ 。

(1)通电一段时间后,可观察到
(2)该溶液电解反应的化学方程式为
(3)若开始时改用银棒做阳极,阳极的电极反应式为
(4)若用H2和O2为反应物,以KOH为电解质溶液,可构成新型燃料电池(如图),两个电极均由多孔性炭制成,通入的气体由孔隙中逸出,并在电极表面放电。则a极的电极反应式为

您最近一年使用:0次
名校
4 . 镍氢电池广泛用于油电一体的混合动力汽车,该电池材料的回收利用也成为研究热点。
Ⅰ.某品牌镍氢电池的总反应为 ,其中,MH为吸附了氢原子的储氢合金。图1为该电池放电时的工作原理示意图。
,其中,MH为吸附了氢原子的储氢合金。图1为该电池放电时的工作原理示意图。
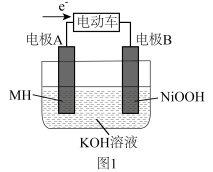
(1)混合动力车上坡时利用电池放电提供能源。
①电极A是_______ (填“正极”或“负极”)。
②正极的电极反应式为_______ 。
(2)混合动力车下坡时利用动能回收给电池充电,此时电极A附近的pH_______ (填“变大”“不变”或“变小”)
Ⅱ.该品牌废旧镍氢电池回收过程中,金属镍的转化过程如下:

转化过程中所用 和NaOH溶液通过电解
和NaOH溶液通过电解 溶液获得,装置如图2。
溶液获得,装置如图2。
已知:阴离子交换膜可选择性透过阴离子,阳离子交换膜可选择性透过阳离子。

(3)图2中,电极C为电解池的_______ (填“阴极”或“阳极”)。
(4)产生 的是
的是_______ (填“甲池”“乙池”或“丙池”),结合化学用语说明产生 的原理:
的原理:_______ 。
(5)回收该品牌废旧镍氢电池过程中,在阴极收集到气体134.4L(标准状况下),理论上最多可回收得到 (摩尔质量为
(摩尔质量为 )的质量为
)的质量为_______ 。
Ⅰ.某品牌镍氢电池的总反应为
 ,其中,MH为吸附了氢原子的储氢合金。图1为该电池放电时的工作原理示意图。
,其中,MH为吸附了氢原子的储氢合金。图1为该电池放电时的工作原理示意图。
(1)混合动力车上坡时利用电池放电提供能源。
①电极A是
②正极的电极反应式为
(2)混合动力车下坡时利用动能回收给电池充电,此时电极A附近的pH
Ⅱ.该品牌废旧镍氢电池回收过程中,金属镍的转化过程如下:

转化过程中所用
 和NaOH溶液通过电解
和NaOH溶液通过电解 溶液获得,装置如图2。
溶液获得,装置如图2。已知:阴离子交换膜可选择性透过阴离子,阳离子交换膜可选择性透过阳离子。

(3)图2中,电极C为电解池的
(4)产生
 的是
的是 的原理:
的原理:(5)回收该品牌废旧镍氢电池过程中,在阴极收集到气体134.4L(标准状况下),理论上最多可回收得到
 (摩尔质量为
(摩尔质量为 )的质量为
)的质量为
您最近一年使用:0次
2023-01-06更新
|
793次组卷
|
7卷引用:天津市耀华中学2023-2024学年高二上学期12月月考化学试卷
解题方法
5 . 电化学理论在钢铁防腐、废水处理中有着重要应用价值。请按要求回答下列问题。
(1)在潮湿的空气里,钢铁易发生电化学腐蚀,其中正极的电极反应式为_______ 。
(2)在海洋工程上,通常用铝锌镉合金(金属性:Al Zn
Zn Cd)保护海底钢铁设施,其原理如图所示:
Cd)保护海底钢铁设施,其原理如图所示:
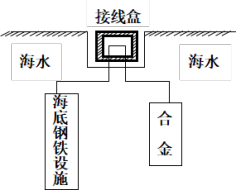
其负极电极反应式为_______ ;在实际应用中,用铝合金而不选用纯铝,纯铝不能很好地起到保护作用,其原因是_______ 。
(3)工业上处理含 的酸性工业废水常用以下方法:
的酸性工业废水常用以下方法:
a.往工业废水里加入适量的NaCl,搅拌均匀
b.用Fe作电极进行电解,一段时间后有Cr(OH)3和Fe(OH)3沉淀产生
c.过滤回收沉淀,废水达到排放标准
①电解时阳极反应式:_______ 。
② 转变成Cr3+的离子方程式:
转变成Cr3+的离子方程式:_______ 。
③解释Cr(OH)3、Fe(OH)3沉淀的产生原因:_______ 。
④能否用Cu电极来代替Fe电极?_______ (填“能”或“不能”),简述理由:_______ 。
(1)在潮湿的空气里,钢铁易发生电化学腐蚀,其中正极的电极反应式为
(2)在海洋工程上,通常用铝锌镉合金(金属性:Al
 Zn
Zn Cd)保护海底钢铁设施,其原理如图所示:
Cd)保护海底钢铁设施,其原理如图所示:
其负极电极反应式为
(3)工业上处理含
 的酸性工业废水常用以下方法:
的酸性工业废水常用以下方法:a.往工业废水里加入适量的NaCl,搅拌均匀
b.用Fe作电极进行电解,一段时间后有Cr(OH)3和Fe(OH)3沉淀产生
c.过滤回收沉淀,废水达到排放标准
①电解时阳极反应式:
②
 转变成Cr3+的离子方程式:
转变成Cr3+的离子方程式:③解释Cr(OH)3、Fe(OH)3沉淀的产生原因:
④能否用Cu电极来代替Fe电极?
您最近一年使用:0次
名校
解题方法
6 . 按要求填空:
(1)一种微型电池得电极材料是石墨和锂,电解质溶液为等物质的量的LiCl、AlCl3溶解在SOCl2中形成的溶液,总反应式为8Li +3SOCl2 =6LiCl +Li2SO3 +2S,则该电池的正极电极反应式为_______
(2)某研究小组将两个甲烷燃料电池串联后作为电源,进行电解饱和食盐水,如图所示。

①甲烷燃料电池工作时,其负极电极反应式为_______
②闭合开关K后,a,b电极上均有气体生成,b电极的电极名称为_______ 极(填“正”“负”“阴”或“阳”),电极反应式为_______ ,电解饱和食盐水总反应的离子方程式为_______ 。
(1)一种微型电池得电极材料是石墨和锂,电解质溶液为等物质的量的LiCl、AlCl3溶解在SOCl2中形成的溶液,总反应式为8Li +3SOCl2 =6LiCl +Li2SO3 +2S,则该电池的正极电极反应式为
(2)某研究小组将两个甲烷燃料电池串联后作为电源,进行电解饱和食盐水,如图所示。

①甲烷燃料电池工作时,其负极电极反应式为
②闭合开关K后,a,b电极上均有气体生成,b电极的电极名称为
您最近一年使用:0次
解题方法
7 . 物质的化学能可以在不同的条件下转化为热能、电能被人类利用。按要求回答下列问题。
(1)微生物电池是指在微生物作用下将化学能转化为电能的装置。其工作原理如下图所示。
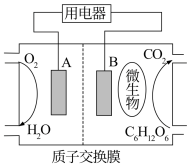
①A为生物燃料电池的_______ (填“正”或“负”)极。
②负极的电极反应式为_______ 。
③放电过程中, 由
由_______ 极区向_______ 极区迁移(填“正”或“负”)。
(2)用阴离子交换膜控制电解液中 的浓度制备纳米
的浓度制备纳米 。反应为
。反应为 ,装置如图。
,装置如图。
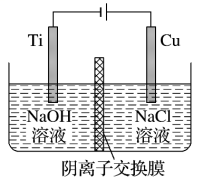
①电解时_______ 通过阴离子交换膜向_______ 极移动。
②阳极电极反应式为_______ 。
③阴极电极反应式为_______ 。
(3)我国科研人员研制出的可充电“ ”电池,以钠箔和多壁碳纳米管(
”电池,以钠箔和多壁碳纳米管( )为电极材料,可选用高氯酸钠-四甘醇二甲醚作电解液。总反应方程式为
)为电极材料,可选用高氯酸钠-四甘醇二甲醚作电解液。总反应方程式为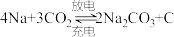 。放电时该电池“吸入”
。放电时该电池“吸入” 。
。
①放电时,正极的电极反应式为_______ 。
②可选用高氯酸钠-四甘醇二甲醚作电解液的理由是_______ 。
(1)微生物电池是指在微生物作用下将化学能转化为电能的装置。其工作原理如下图所示。

①A为生物燃料电池的
②负极的电极反应式为
③放电过程中,
 由
由(2)用阴离子交换膜控制电解液中
 的浓度制备纳米
的浓度制备纳米 。反应为
。反应为 ,装置如图。
,装置如图。
①电解时
②阳极电极反应式为
③阴极电极反应式为
(3)我国科研人员研制出的可充电“
 ”电池,以钠箔和多壁碳纳米管(
”电池,以钠箔和多壁碳纳米管(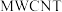 )为电极材料,可选用高氯酸钠-四甘醇二甲醚作电解液。总反应方程式为
)为电极材料,可选用高氯酸钠-四甘醇二甲醚作电解液。总反应方程式为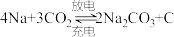 。放电时该电池“吸入”
。放电时该电池“吸入” 。
。①放电时,正极的电极反应式为
②可选用高氯酸钠-四甘醇二甲醚作电解液的理由是
您最近一年使用:0次
解题方法
8 . 电解原理在化学工业中有广泛的应用。如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题:
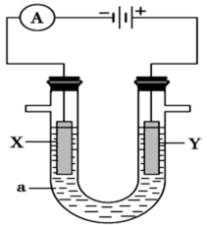
(1)若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则:
①电解池中X极上的电极反应式为_______ ,在X极附近观察到的现象是_______ 。
②Y电极上的电极反应式为_______ ,检验该电极反应产物的方法是_______ 。
(2)如要用电解方法精炼粗铜,电解液a选用CuSO4溶液,则:
①X电极的材料是_______ ,电极反应式为_______ 。
②溶液中的c(Cu2+)与电解前相比_______ (填“变大”、“变小”或“不变”)。
(3)如利用该装置实现铁上镀锌,电极Y上发生的反应为_______ ,电解池盛放的电镀液可以是_______ 。

(1)若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则:
①电解池中X极上的电极反应式为
②Y电极上的电极反应式为
(2)如要用电解方法精炼粗铜,电解液a选用CuSO4溶液,则:
①X电极的材料是
②溶液中的c(Cu2+)与电解前相比
(3)如利用该装置实现铁上镀锌,电极Y上发生的反应为
您最近一年使用:0次
9 . 化学在环境保护中起着十分重要的作用,催化反硝化法和电化学降解法可用于治理水中硝酸盐的污染。
(1)催化反硝化法中,H2能将NO3-还原为N2。25℃时,反应进行10min,溶液的pH由7变为12。
①N2的结构式为____________________ 。
②上述反应的离子方程式为_______________________________________ ,其平均反应速率υ(NO3-)为_________________ mol·L-1min-1。
③还原过程中可生成中间产物NO2-,写出3种促进NO2-水解的方法_______________________ 。
(2)电化学降解NO3-的原理如图所示。

①电源正极为__________ (填A或B),阴极反应式为________________ 。
②若电解过程中转移了2mol电子,则膜两侧电解液的质量变化差(Δm左-Δm右)为____ g。
(1)催化反硝化法中,H2能将NO3-还原为N2。25℃时,反应进行10min,溶液的pH由7变为12。
①N2的结构式为
②上述反应的离子方程式为
③还原过程中可生成中间产物NO2-,写出3种促进NO2-水解的方法
(2)电化学降解NO3-的原理如图所示。

①电源正极为
②若电解过程中转移了2mol电子,则膜两侧电解液的质量变化差(Δm左-Δm右)为
您最近一年使用:0次
2019-01-30更新
|
1617次组卷
|
6卷引用:2013-2014学年天津市南开区高二上学期期末考试化学试卷
(已下线)2013-2014学年天津市南开区高二上学期期末考试化学试卷2013年全国普通高等学校招生统一考试理科综合能力测试化学(重庆卷)(已下线)2014届高考化学二轮复习必做训练 电化学原理及其应用练习卷黑龙江省牡丹江市第一高级中学2018届高三上学期期末考试化学试题(已下线)【南昌新东方】2016 莲塘一中 高三期末 011吉林省长春外国语学校2022-2023学年高二下学期开学考试化学试题
10 . 电化学与我们的生活有着密切的联系,请结合电化学知识回答下列有关问题。
(1)炒过菜的铁锅未及时洗净(残液中含有NaCl),不久便会因腐蚀而出现红棕色锈斑。试回答:
铁锅的锈蚀应属于________________ (填“析氢腐蚀”或“吸氧腐蚀”),铁锅锈蚀的负极反应式为:__________________ ;正负极反应产物会继续发生反应,最终生成的红棕色锈斑的主要成分是________________ (填化学式)。
(2)下图是一个电化学过程的示意图。
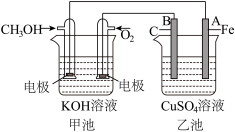
已知甲池的总反应式为:2CH3OH+3O2+4KOH=2K2CO3+6H2O
①甲池是_______ 装置,通O2一极的电极反应式为____________________ 。
②乙池中反应的化学方程式为_____________________________ 。如果开始加入的CuSO4溶液足量,当乙池中A(Fe)极的质量增加3.2 g时,甲池中消耗O2_________ mL(标准状况下)。
(1)炒过菜的铁锅未及时洗净(残液中含有NaCl),不久便会因腐蚀而出现红棕色锈斑。试回答:
铁锅的锈蚀应属于
(2)下图是一个电化学过程的示意图。

已知甲池的总反应式为:2CH3OH+3O2+4KOH=2K2CO3+6H2O
①甲池是
②乙池中反应的化学方程式为
您最近一年使用:0次



