名校
解题方法
1 . 我国提出争取在2030年前实现碳达峰、2060年实现碳中和,这对于改善环境、实现绿色发展至关重要。回答下列问题:
Ⅰ.如图所示电解装置可将CO2转化为乙烯(C2H4),该装置中的电解质溶液为稀硫酸,电极材料均为惰性电极。

(1)电极b是_______ (填“阴极”或“阳极”),电极a上发生的电极反应式是_______ 。
(2)电解过程中H+运动方向为_______ (填“由a到b”或“由b到a”)。电解后,溶液中n(H+)_______ (填“增大”“减小”或“不变”)。
Ⅱ.实验室用CH4燃料电池作电源探究氯碱工业原理和粗铜的精炼原理,其中乙装置中的X为阳离子交换膜。

(3)甲装置中,负极的电极反应式为_______ 。
(4)乙装置中,石墨(C)极的电极反应式为_______ 。
(5)若在标准状况下,有1.12L氧气参加反应,则理论上通过乙装置中X交换膜的电量为_______ C(已知:法拉第常数代表每摩尔电子所携带的电荷,数值F=9.65×104C·mol−1)。一段时间后,丙装置中c(Cu2+)_______ (填“增大”“减小”或“不变”)。
(6)若以该CH4燃料电池为电源,用石墨作电极电解200mL0.5mol·L-1的CuSO4溶液,电解一段时间后,两极收集到的气体的体积相同(相同条件下测定),则整个电解过程转移电子的物质的量是_______ 。
Ⅰ.如图所示电解装置可将CO2转化为乙烯(C2H4),该装置中的电解质溶液为稀硫酸,电极材料均为惰性电极。

(1)电极b是
(2)电解过程中H+运动方向为
Ⅱ.实验室用CH4燃料电池作电源探究氯碱工业原理和粗铜的精炼原理,其中乙装置中的X为阳离子交换膜。

(3)甲装置中,负极的电极反应式为
(4)乙装置中,石墨(C)极的电极反应式为
(5)若在标准状况下,有1.12L氧气参加反应,则理论上通过乙装置中X交换膜的电量为
(6)若以该CH4燃料电池为电源,用石墨作电极电解200mL0.5mol·L-1的CuSO4溶液,电解一段时间后,两极收集到的气体的体积相同(相同条件下测定),则整个电解过程转移电子的物质的量是
您最近一年使用:0次
2022-12-13更新
|
213次组卷
|
2卷引用:山西省晋城市第二中学校2022-2023学年高二上学期12月月考化学试题
名校
2 . 电解原理在化学工业中有着广泛的应用。
(1)如图,其中a是电解质溶液,X、Y是两块惰性电极板。若X、Y是惰性电极,a是CuSO4溶液,则电解时的化学方程式为____ ;通电一段时间后,向烧杯中的电解质溶液中加入0.2molCuO粉末,电解质溶液恰好恢复到电解前的浓度和pH,则电解过程中转移的电子的物质的量为____ 。若X、Y分别是铁和铜,a仍是CuSO4溶液,则Y极的电极反应式为___ 。

(2)已知+2价的铁的化合物通常具有较强的还原性,易被氧化。实验室用亚铁盐溶液与烧碱反应很难制得白色纯净的Fe(OH)2沉淀,但是用电解的方法可以制得纯净的Fe(OH)2沉淀。制备装置如图所示,其中a、b两电极材料分别为铁和石墨。

①a电极上的反应式为____ 。
②电解质溶液d最好选____ (填编号)。
A.纯水B.CuSO4溶液C.NaOH溶液D.H2SO4溶液
③液体C为____ (填编号)。
A.四氯化碳B.硝基苯C.苯D.乙醇
(1)如图,其中a是电解质溶液,X、Y是两块惰性电极板。若X、Y是惰性电极,a是CuSO4溶液,则电解时的化学方程式为

(2)已知+2价的铁的化合物通常具有较强的还原性,易被氧化。实验室用亚铁盐溶液与烧碱反应很难制得白色纯净的Fe(OH)2沉淀,但是用电解的方法可以制得纯净的Fe(OH)2沉淀。制备装置如图所示,其中a、b两电极材料分别为铁和石墨。

①a电极上的反应式为
②电解质溶液d最好选
A.纯水B.CuSO4溶液C.NaOH溶液D.H2SO4溶液
③液体C为
A.四氯化碳B.硝基苯C.苯D.乙醇
您最近一年使用:0次
2022-04-13更新
|
38次组卷
|
2卷引用:山西省运城市芮城中学2021-2022学年高二下学期开学摸底考试化学试题
名校
解题方法
3 . 电化学给人类的生活和工业生产带来极大的方便。回答下列问题:
(1)一种利用垃圾渗滤液中 发电的原理如图所示。
发电的原理如图所示。

①X为该装置的_______ 极。
②该装置工作时,Y电极周围溶液的
_______ (填“升高”或“降低”)。
③写出该装置工作时的电池反应式:_______ 。
(2)若将(1)中电极X、Y分别与如图的a、f相连,一段时间后,测得 溶液浓度变为
溶液浓度变为 。
。

①电极b上生成的气体的体积(标准状况下)约为_______ L,该电极上发生的电极反应为_______ 。
②电极c的质量增加_______ g。
③一段时间后, 溶液中
溶液中 全部析出,此时电解还能继续进行,其原因是
全部析出,此时电解还能继续进行,其原因是_______ 。
(1)一种利用垃圾渗滤液中
 发电的原理如图所示。
发电的原理如图所示。
①X为该装置的
②该装置工作时,Y电极周围溶液的

③写出该装置工作时的电池反应式:
(2)若将(1)中电极X、Y分别与如图的a、f相连,一段时间后,测得
 溶液浓度变为
溶液浓度变为 。
。
①电极b上生成的气体的体积(标准状况下)约为
②电极c的质量增加
③一段时间后,
 溶液中
溶液中 全部析出,此时电解还能继续进行,其原因是
全部析出,此时电解还能继续进行,其原因是
您最近一年使用:0次
2022-04-04更新
|
192次组卷
|
3卷引用:山西省长治市上党区第一中学校2022-2023学年高二上学期期末考试化学试题
解题方法
4 . 化学电源在日常生活和工业生产中有着重要的应用。如图所示,某同学设计了一个 燃料电池并探究氯碱工业原理和粗铜的精炼原理,其中乙装置中X为阳离子交换膜。请按要求回答相关问题:
燃料电池并探究氯碱工业原理和粗铜的精炼原理,其中乙装置中X为阳离子交换膜。请按要求回答相关问题:

(1)甲烷燃料电池负极反应式为_______ ,石墨(C)极的电极反应式为_______ 。
(2)乙装置所用饱和氯化钠溶液由粗盐水精制而成。精制时为除去食盐水中的 和
和 ,要加入的试剂及顺序为:先加
,要加入的试剂及顺序为:先加_______ ,再加_______ 。
(3)若在标准状况下,有 氧气参加反应,则理论上通过乙装置中X交换膜的电量为
氧气参加反应,则理论上通过乙装置中X交换膜的电量为_______ C(法拉第常数 ),一段时间后丙装置中
),一段时间后丙装置中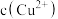
_______ (填“增大”“减小”或“不变”)。
(4)若以该电池为电源,用石墨作电极电解 的
的 溶液,电解一段时间后,两极收集到相同体积(相同条件)的气体,则整个电解过程转移电子的数目是
溶液,电解一段时间后,两极收集到相同体积(相同条件)的气体,则整个电解过程转移电子的数目是_______ 。
 燃料电池并探究氯碱工业原理和粗铜的精炼原理,其中乙装置中X为阳离子交换膜。请按要求回答相关问题:
燃料电池并探究氯碱工业原理和粗铜的精炼原理,其中乙装置中X为阳离子交换膜。请按要求回答相关问题:
(1)甲烷燃料电池负极反应式为
(2)乙装置所用饱和氯化钠溶液由粗盐水精制而成。精制时为除去食盐水中的
 和
和 ,要加入的试剂及顺序为:先加
,要加入的试剂及顺序为:先加(3)若在标准状况下,有
 氧气参加反应,则理论上通过乙装置中X交换膜的电量为
氧气参加反应,则理论上通过乙装置中X交换膜的电量为 ),一段时间后丙装置中
),一段时间后丙装置中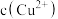
(4)若以该电池为电源,用石墨作电极电解
 的
的 溶液,电解一段时间后,两极收集到相同体积(相同条件)的气体,则整个电解过程转移电子的数目是
溶液,电解一段时间后,两极收集到相同体积(相同条件)的气体,则整个电解过程转移电子的数目是
您最近一年使用:0次
5 . 某小组同学认为,可以模拟工业上离子交换膜法制烧碱的方法,利用如图装置电解硫酸钾溶液来制取氢气、氧气、硫酸和氢氧化钾。

(1)该电解池的阳极反应式为___________ ,此时通过阴离子交换膜的离子数___________ (填“大于”“小于”或“等于”)通过阳离子交换膜的离子数。
(2)制得的KOH溶液从出口___________ (填“A”“B”“C”或“D”)导出。
(3)通电开始后,阴极附近溶液的pH会增大,请简述原因___________ 。
(4)若将制得的氢气、氧气和氢氧化钾溶液组合为氢氧燃料电池,则电池正极的反应式为___________ 。

(1)该电解池的阳极反应式为
(2)制得的KOH溶液从出口
(3)通电开始后,阴极附近溶液的pH会增大,请简述原因
(4)若将制得的氢气、氧气和氢氧化钾溶液组合为氢氧燃料电池,则电池正极的反应式为
您最近一年使用:0次
名校
6 . 如图是利用氯碱工业的原理图。回答下列问题:
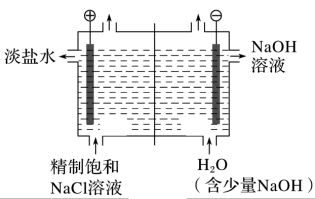
(1)请写出氯碱工业的电极反应方程式:__ ,__ 。(注明电极)
(2)图中的离子交换膜是__ (填“阳离子”或“阴离子”)交换膜,采用该离子交换膜的作用有__ (写出一点)。
(3)请写出检验左室气体产物的方法__ 。
(4)请写出NaOH在工业上的一种用途__ 。

(1)请写出氯碱工业的电极反应方程式:
(2)图中的离子交换膜是
(3)请写出检验左室气体产物的方法
(4)请写出NaOH在工业上的一种用途
您最近一年使用:0次
7 . 目前很多工厂实现了烟气的脱硫脱硝和氨氮废水的无害化处理,回答下列问题:
(1)某小组同学在实验室里尝试模拟工厂处理氨氮废水(主要含NH )的不同方法,过程如下:①甲同学采用Ca(ClO)2作为氧化剂。将废水中的NH
)的不同方法,过程如下:①甲同学采用Ca(ClO)2作为氧化剂。将废水中的NH 转化为无毒气体。他在实验中发现其他条件相同时,Ca(ClO)2的浓度越大碱性越强,处理后的废水中亚硝酸盐(NO
转化为无毒气体。他在实验中发现其他条件相同时,Ca(ClO)2的浓度越大碱性越强,处理后的废水中亚硝酸盐(NO )的浓度也随之变大,写出该反应的离子方程式:
)的浓度也随之变大,写出该反应的离子方程式:___ 。
②乙同学在实验室模拟工业上的“吹脱法”测定废水的含氮量,设计了以下实验:精确称取wg废水样品,注入如所图示的仪器中,然后逐滴加入足量10%NaOH溶液,通入水蒸气。将样品液中的氨全部蒸出,用V1mLc1mol·L-1盐酸标准溶液吸收。蒸氨结束后取下接收瓶,用c2mol•L-1NaOH标准溶液滴定过剩的HCl,到终点时消耗V2mLNaOH溶液。
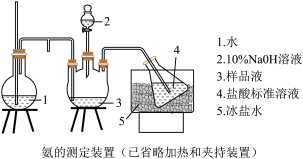
NH4Cl的电子式为___ 。盛放样品液的仪器是___ (填名称);圆底烧瓶中长玻璃导管的作用是___ ;冰盐水的作用是___ 。
(2)某工厂利用NaClO2/(NH4)2CO3溶液脱除烟气中的SO2和NO。①保持溶液中NaClO2的浓度不变,研究(NH4)2CO3的浓度对NO和SO2脱除效率的影响[已知:(NH4)2CO3溶液显碱性;NaClO2的氧化性随pH增加而下降,酸性条件下会生成ClO2]。实验结果如图所示,随着(NH4)2CO3溶液浓度的增大造成NO脱除效率下降的主要原因是___ 。
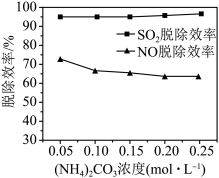
②NO脱除效率总是小于SO2脱除效率的主要原因是___ 。(写出一点)
(3)某工厂采用微生物硝化法处理氨氮废水,过程如图:
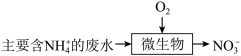
下列有关说法正确的是___ (填标号)。
①微生物硝化法处理废水后会导致水体的pH升高
②若微生物保持活性的pH范围为7~9,则适宜用来调节水体pH的是CO2
③不能采用电解法在阴极将NH 直接转化为NO
直接转化为NO
(1)某小组同学在实验室里尝试模拟工厂处理氨氮废水(主要含NH
 )的不同方法,过程如下:①甲同学采用Ca(ClO)2作为氧化剂。将废水中的NH
)的不同方法,过程如下:①甲同学采用Ca(ClO)2作为氧化剂。将废水中的NH 转化为无毒气体。他在实验中发现其他条件相同时,Ca(ClO)2的浓度越大碱性越强,处理后的废水中亚硝酸盐(NO
转化为无毒气体。他在实验中发现其他条件相同时,Ca(ClO)2的浓度越大碱性越强,处理后的废水中亚硝酸盐(NO )的浓度也随之变大,写出该反应的离子方程式:
)的浓度也随之变大,写出该反应的离子方程式:②乙同学在实验室模拟工业上的“吹脱法”测定废水的含氮量,设计了以下实验:精确称取wg废水样品,注入如所图示的仪器中,然后逐滴加入足量10%NaOH溶液,通入水蒸气。将样品液中的氨全部蒸出,用V1mLc1mol·L-1盐酸标准溶液吸收。蒸氨结束后取下接收瓶,用c2mol•L-1NaOH标准溶液滴定过剩的HCl,到终点时消耗V2mLNaOH溶液。

NH4Cl的电子式为
(2)某工厂利用NaClO2/(NH4)2CO3溶液脱除烟气中的SO2和NO。①保持溶液中NaClO2的浓度不变,研究(NH4)2CO3的浓度对NO和SO2脱除效率的影响[已知:(NH4)2CO3溶液显碱性;NaClO2的氧化性随pH增加而下降,酸性条件下会生成ClO2]。实验结果如图所示,随着(NH4)2CO3溶液浓度的增大造成NO脱除效率下降的主要原因是

②NO脱除效率总是小于SO2脱除效率的主要原因是
(3)某工厂采用微生物硝化法处理氨氮废水,过程如图:

下列有关说法正确的是
①微生物硝化法处理废水后会导致水体的pH升高
②若微生物保持活性的pH范围为7~9,则适宜用来调节水体pH的是CO2
③不能采用电解法在阴极将NH
 直接转化为NO
直接转化为NO
您最近一年使用:0次
8 . 将PbO溶解在HCl和NaCl的混合溶液中,得到含Na2PbCl4的电解液,电解Na2PbCl4溶液生成Pb的装置如图所示。
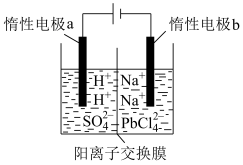
①写出电解时阴极的电极反应式_____________ 。
②电解过程中通过阳离子交换膜的离子主要为________ 。
③电解过程中,Na2PbCl4电解液浓度不断减小,为了恢复其浓度,应该向___________ 极室(填“阴”或者“阳”)加入____________ (填化学式)。

①写出电解时阴极的电极反应式
②电解过程中通过阳离子交换膜的离子主要为
③电解过程中,Na2PbCl4电解液浓度不断减小,为了恢复其浓度,应该向
您最近一年使用:0次
9 . 纳米级Cu2O由于具有优良的催化性能而受到关注,采用肼(N2H4)燃料电池为电源,用离子交换膜控制电解液中c(OH-)制备纳米Cu2O,其装置如图甲、乙。
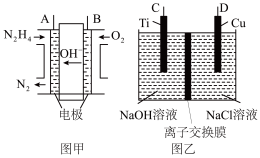
(1)上述装置中D电极应连接肼燃料电池的________ 极(填“A”或“B”),该电解池中离子交换膜为________ 离子交换膜(填“阴”或“阳”)。
(2)该电解池的阳极反应式为________________________________________ ,
肼燃料电池中A极发生的电极反应为____________________________ 。
(3)当反应生成14.4 g Cu2O时,至少需要肼________ mol。

(1)上述装置中D电极应连接肼燃料电池的
(2)该电解池的阳极反应式为
肼燃料电池中A极发生的电极反应为
(3)当反应生成14.4 g Cu2O时,至少需要肼
您最近一年使用:0次
2019-11-19更新
|
195次组卷
|
6卷引用:山西省朔州市怀仁市大地学校高中部2023-2024学年高二上学期12月月考化学试题
山西省朔州市怀仁市大地学校高中部2023-2024学年高二上学期12月月考化学试题辽宁省六校协作体2019-2020学年高二上学期期中考试化学试题江苏省苏州市相城区陆慕高级中学2019-2020高二下学期4月质量检测化学试题黑龙江省齐齐哈尔三立高级中学2022届高三上学期开学考试化学试题(已下线)综合复习与测试(1)-【上好课】2021-2022学年高二化学同步备课系列(苏教版2019选择性必修1)河北定州中学2023-2024学年高二上学期12月月考化学试题
10-11高二上·山西·阶段练习
10 . 从 、
、 、H+、Cu2+、Ba2+、Ag+、Cl-等离子中选出适当的离子组成电解质,采用惰性电极对其溶液进行电解。若两极分别放出气体,且体积比为1∶1,电解质的化学式可能是
、H+、Cu2+、Ba2+、Ag+、Cl-等离子中选出适当的离子组成电解质,采用惰性电极对其溶液进行电解。若两极分别放出气体,且体积比为1∶1,电解质的化学式可能是_______ 。
 、
、 、H+、Cu2+、Ba2+、Ag+、Cl-等离子中选出适当的离子组成电解质,采用惰性电极对其溶液进行电解。若两极分别放出气体,且体积比为1∶1,电解质的化学式可能是
、H+、Cu2+、Ba2+、Ag+、Cl-等离子中选出适当的离子组成电解质,采用惰性电极对其溶液进行电解。若两极分别放出气体,且体积比为1∶1,电解质的化学式可能是
您最近一年使用:0次



