解题方法
1 . 如图所示,甲、乙为相互串联的两个电解池。

(1)甲池为精炼铜的装置,A电极为_______ (填“阳极”或“阴极”),电极材料是_______ ,电极反应为_______ ,电解质溶液可以是_______ 。
(2)乙池中C为惰性电极,则电极反应式为_______ ,若在乙池中滴入少量酚酞溶液,电解一段时间后,Fe极附近呈_______ 色。

(1)甲池为精炼铜的装置,A电极为
(2)乙池中C为惰性电极,则电极反应式为
您最近一年使用:0次
解题方法
2 . 在硫酸铜溶液中,插入两个电极进行电解。
(1)若两极均为Pt电极,则阳极反应式是_________ ,阴极反应式是_________ ,电解的化学方程式是_________ 。
(2)若两极均为铜片,则阳极反应式是_________ ,阴极反应式是_________ ,电解过程中溶液的浓度变化是_________ 。
(3)若阳极为锌片,阴极为铜片,则阳极反应式是_________ ,电解过程中两极的变化是_________ 。
(1)若两极均为Pt电极,则阳极反应式是
(2)若两极均为铜片,则阳极反应式是
(3)若阳极为锌片,阴极为铜片,则阳极反应式是
您最近一年使用:0次
3 . 用下图所示装置进行第二组实验。实验过程中,观察到与第一组实验不同的现象:两极均有气体产生,Y极区溶液逐渐变成紫红色;停止实验,铁电极明显变细,电解液仍然澄清。 查阅资料得知,高铁酸根离子(FeO42—)在溶液中呈紫红色。
(1)电解过程中,X 极区溶液的 pH__ (填“增大”“减小”或“不变”)。
(2)电解过程中,Y 极发生的电极反应之一为 Fe﹣6e﹣+8OH﹣=FeO42—+4H2O 若在 X 极收集到672 mL 气体,在 Y 极收集到 168 mL 气体(均已折算为标准状况时气体体积),则 Y 电极(铁电极)质量减少__ g。
(3)在碱性锌电池中,用高铁酸钾作为正极材料,电池反应为 2K2FeO4+3Zn=Fe2O3+ZnO+2K2ZnO2,该电池正极发生的反应的电极反应式为________ 。
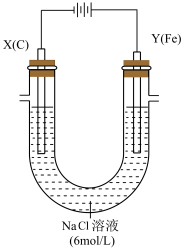
(1)电解过程中,X 极区溶液的 pH
(2)电解过程中,Y 极发生的电极反应之一为 Fe﹣6e﹣+8OH﹣=FeO42—+4H2O 若在 X 极收集到672 mL 气体,在 Y 极收集到 168 mL 气体(均已折算为标准状况时气体体积),则 Y 电极(铁电极)质量减少
(3)在碱性锌电池中,用高铁酸钾作为正极材料,电池反应为 2K2FeO4+3Zn=Fe2O3+ZnO+2K2ZnO2,该电池正极发生的反应的电极反应式为
您最近一年使用:0次
名校
4 . 某课外小组分别用如图所示装置对原电池和电解原理进行实验探究。
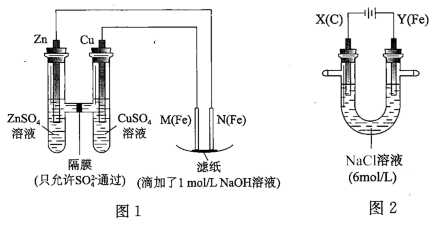
请回答:
Ⅰ.用图 1 所示装置进行第一组实验。
(1)在保证电极反应不变的情况下,不能替代 Cu 作电极的是__ (填字母序号)。
A 铝 B 石墨 C 银 D 铂
(2)N 极发生反应的电极反应式为__ 。
Ⅱ.用图 2 所示装置进行第二组实验。实验过程中,观察到与第一组实验不同的现象:两极均有气体产生,Y极区溶液逐渐变成紫红色;停止实验,铁电极明显变细,电解液仍然澄清。 查阅资料得知,高铁酸根离子(FeO42-)在溶液中呈紫红色。
(3)电解过程中,X 极区溶液的 pH__ (填“增大”“减小”或“不变”)。
(4)电解过程中,Y 极发生的电极反应之一为 Fe﹣6e﹣+8OH﹣= FeO42-+4H2O 若在 X 极收集到672 mL 气体,在 Y 极收集到 168 mL 气体(均已折算为标准状况时气体体积),则 Y 电极(铁电极)质量减少____ g。
(5)在碱性锌电池中,用高铁酸钾作为正极材料,电池反应为 2K2FeO4+3Z=Fe2O3+ZnO+2K2ZnO2,该电池正极发生的反应的电极反应式为__ 。

请回答:
Ⅰ.用图 1 所示装置进行第一组实验。
(1)在保证电极反应不变的情况下,不能替代 Cu 作电极的是
A 铝 B 石墨 C 银 D 铂
(2)N 极发生反应的电极反应式为
Ⅱ.用图 2 所示装置进行第二组实验。实验过程中,观察到与第一组实验不同的现象:两极均有气体产生,Y极区溶液逐渐变成紫红色;停止实验,铁电极明显变细,电解液仍然澄清。 查阅资料得知,高铁酸根离子(FeO42-)在溶液中呈紫红色。
(3)电解过程中,X 极区溶液的 pH
(4)电解过程中,Y 极发生的电极反应之一为 Fe﹣6e﹣+8OH﹣= FeO42-+4H2O 若在 X 极收集到672 mL 气体,在 Y 极收集到 168 mL 气体(均已折算为标准状况时气体体积),则 Y 电极(铁电极)质量减少
(5)在碱性锌电池中,用高铁酸钾作为正极材料,电池反应为 2K2FeO4+3Z=Fe2O3+ZnO+2K2ZnO2,该电池正极发生的反应的电极反应式为
您最近一年使用:0次
2019-06-28更新
|
411次组卷
|
21卷引用:云南省广南二中2018-2019学年高二6月考试化学试题
云南省广南二中2018-2019学年高二6月考试化学试题云南省屏边县民族中学2019-2020学年高二上学期12月月考化学试题云南省河口县第一中学2019-2020学年高二上学期12月月考化学试题云南省镇康县第一中学2019-2020学年高二12月月考化学试题云南省云县第一中学2019-2020学年高二12月月考化学试题2云南省迪庆州香格里拉中学2019-2020学年高二上学期期末考试化学试题云南省武定民族中学2019-2020学年高二上学期期末考试化学试题云南省普洱市镇沅县第一中学2019—2020学年高二上学期期末考试化学试题云南省普洱市江城县第一中学2019—2020学年高二上学期期末考试化学试题云南省普洱市普洱第二中学2019—2020学年高二上学期期末考试化学试题云南省曲靖市沾益县第二中学2019-2020学年高二上学期期末考试化学试题云南省昆明市寻甸县第三中学2019-2020学年高二上学期期末考试化学云南省玉溪市江川区第二中学2020-2021学年高二下学期期中考试化学试题云南省玉龙县第一中学2021-2022学年高二下学期3月份考试化学试题吉林省扶余市第一中学2017-2018学年高一下学期期末考试化学试题(已下线)《2018-2019学年同步单元双基双测AB卷》第四单元 电化学基础单元测试A卷贵州省三都水族自治县高级中学2019-2020学年高二上学期期末考试化学试题贵州省岑巩县第二中学2019-2020学年高二上学期期末考试化学试题贵州省三穗县三中2019-2020学年高二上学期期末考试化学试题黑龙江省哈尔滨师范大学青冈实验中学校2018-2019学年高二上学期开学考试化学试题安徽省怀宁中学2020-2021学年高二上学期第二次质量检测(普通班)化学试题
名校
5 . X、Y、Z、M、Q、R是6种短周期元素,其原子半径及主要化合价如下:
(1)Z在元素中期表中的位置是______________________________ 。
(2)X、Y、Q各自形成简单离子,其中离子半径最大的是__________ (填离子符号)。
(3)周期表中有些处于对角线(左上→右下)位置的元素,它们的单质及其化合物的性质相似,则M的氧化物与强碱溶液反应的离子方程式______________________________ 。
(4)Q和R按原子个数比1:1组成的化合物甲是一种“绿色”氧化剂。
①甲中所含共价键类型是____________________ 。
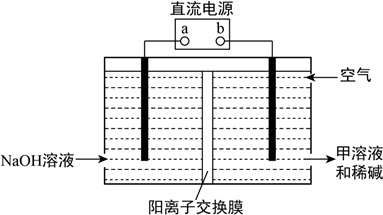
②空气阴极法电解制备甲的装置如图所示。在碱性溶液中,利用空气中的氧气还原得到甲和稀碱的溶液。图中a是__________ 极,阴极的电极反应式是____________________ 。
| 元素代号 | X | Y | Z | M | Q | R |
| 原子半径/nm | 0.160 | 0.143 | 0.102 | 0.089 | 0.074 | 0.037 |
| 主要化合价 | +2 | +3 | +6,-2 | +2 | -2 | +1 |
(1)Z在元素中期表中的位置是
(2)X、Y、Q各自形成简单离子,其中离子半径最大的是
(3)周期表中有些处于对角线(左上→右下)位置的元素,它们的单质及其化合物的性质相似,则M的氧化物与强碱溶液反应的离子方程式
(4)Q和R按原子个数比1:1组成的化合物甲是一种“绿色”氧化剂。
①甲中所含共价键类型是
②空气阴极法电解制备甲的装置如图所示。在碱性溶液中,利用空气中的氧气还原得到甲和稀碱的溶液。图中a是

您最近一年使用:0次
2018-01-10更新
|
237次组卷
|
4卷引用:云南省峨山彝族自治县第一中学2018届高三上学期期末考试仿真化学试题
6 . 次磷酸(H3PO2)是一种精细磷化工产品,具有较强还原性.回答下列问题:
(1)H3PO2是一元中强酸,写出其电离方程式_______________________ .
(2)H3PO2及NaH2PO2均可将溶液中的Ag+还原为银,从而可用于化学镀银.
①(H3PO2)中,P元素的化合价为_____________________ .
②利用(H3PO2)进行化学镀银反应中,氧化剂与还原剂的物质的量之比为4:1,则氧化产物为:____________ (填化学式).
③NaH2PO2为_____________ (填“正盐”或“酸式盐”),其溶液显___________ (填“弱酸性”、“中性”或“弱碱性”).
(3)(H3PO2)的工业制法是:将白磷(P4)与Ba(OH)2溶液反应生成PH3气体和Ba(H2PO2)2,后者再与H2SO4反应.写出白磷与Ba(OH)2溶液反应的化学方程式________________ .
(4)H3PO2也可用电渗析法制备,“四室电渗析法”工作原理如图所示(阳膜和阴膜分别只允许阳离子、阴离子通过):

①写出阳极的电极反应式____________________ .
②分析产品室可得到H3PO2的原因_______________________ .
③早期采用“三室电渗析法”制备H3PO2,将“四室电渗析法”中阳极室的稀硫酸用H3PO2稀溶液代替,并撤去阳极室与产品室之间的阳膜,从而合并了阳极室与产品室,其缺点是产品中混有__________ 杂质.
(1)H3PO2是一元中强酸,写出其电离方程式
(2)H3PO2及NaH2PO2均可将溶液中的Ag+还原为银,从而可用于化学镀银.
①(H3PO2)中,P元素的化合价为
②利用(H3PO2)进行化学镀银反应中,氧化剂与还原剂的物质的量之比为4:1,则氧化产物为:
③NaH2PO2为
(3)(H3PO2)的工业制法是:将白磷(P4)与Ba(OH)2溶液反应生成PH3气体和Ba(H2PO2)2,后者再与H2SO4反应.写出白磷与Ba(OH)2溶液反应的化学方程式
(4)H3PO2也可用电渗析法制备,“四室电渗析法”工作原理如图所示(阳膜和阴膜分别只允许阳离子、阴离子通过):

①写出阳极的电极反应式
②分析产品室可得到H3PO2的原因
③早期采用“三室电渗析法”制备H3PO2,将“四室电渗析法”中阳极室的稀硫酸用H3PO2稀溶液代替,并撤去阳极室与产品室之间的阳膜,从而合并了阳极室与产品室,其缺点是产品中混有
您最近一年使用:0次
2016-12-09更新
|
238次组卷
|
2卷引用:云南省大理州南涧彝族自治县民族中学2016-2017学年高二下学期6月月考化学试题
10-11高二下·云南昆明·期末
7 . 从H+、Cu2+、Na+、SO42-、Cl-五种离子中恰当地组成电解质,按下列要求进行电解:
(1)以石墨为电极进行电解,使电解质质量减少,水质量不变,可采用的电解质有__________
(2)以石墨为电极进行电解,使电解质质量不变,水质量减少,可采用的电解质有_________
(3)以石墨为电极进行电解,使电解质和水的质量都减少,可采用的电解质有__________
(1)以石墨为电极进行电解,使电解质质量减少,水质量不变,可采用的电解质有
(2)以石墨为电极进行电解,使电解质质量不变,水质量减少,可采用的电解质有
(3)以石墨为电极进行电解,使电解质和水的质量都减少,可采用的电解质有
您最近一年使用:0次



