1 . 空气中 含量的控制和
含量的控制和 资源利用具有重要意义。
资源利用具有重要意义。
(1)燃煤烟气中 的捕集可通过如下所示的物质转化实现。
的捕集可通过如下所示的物质转化实现。

“吸收”后所得的 溶液与石灰乳反应的化学方程式为
溶液与石灰乳反应的化学方程式为___________ ;载人航天器内,常用LiOH固体而很少用KOH固体吸收空气中的 ,其原因是
,其原因是___________ 。
(2)合成尿素[ ]是利用
]是利用 的途径之一。尿素合成主要通过下列反应实现
的途径之一。尿素合成主要通过下列反应实现
反应Ⅰ: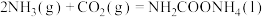
反应Ⅱ:
①密闭体系中反应Ⅰ的平衡常数(K)与温度的关系如图甲所示,反应Ⅰ的
___________ (填“=0”或“>0”或“<0”)。

②反应体系中除发生反应Ⅰ、反应Ⅱ外,还发生尿素水解、尿素缩合生成缩二脲[ ]和尿素转化为氰酸铵(
]和尿素转化为氰酸铵(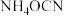 )等副反应。尿素生产中实际投入
)等副反应。尿素生产中实际投入 和
和 的物质的量之比为
的物质的量之比为 ,其实际投料比值远大于理论值的原因是
,其实际投料比值远大于理论值的原因是___________ 。
(3)催化电解吸收 的KOH溶液可将
的KOH溶液可将 转化为有机物。在相同条件下,恒定通过电解池的电量,电解得到的部分还原产物的法拉第效率(
转化为有机物。在相同条件下,恒定通过电解池的电量,电解得到的部分还原产物的法拉第效率( )随电解电压的变化如图乙所示。
)随电解电压的变化如图乙所示。


其中, ,n表示电解生成还原产物X所转移电子的物质的量,F表示法拉第常数。
,n表示电解生成还原产物X所转移电子的物质的量,F表示法拉第常数。
①当电解电压为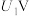 时,电解过程中含碳还原产物的
时,电解过程中含碳还原产物的 为0,阴极主要还原产物为
为0,阴极主要还原产物为___________ (填化学式)。
②当电解电压为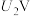 时,阴极由
时,阴极由 生成
生成 的电极反应式为
的电极反应式为___________ 。
③当电解电压为 时,电解生成的
时,电解生成的 和
和 的物质的量之比为
的物质的量之比为___________ (写出计算过程)。
 含量的控制和
含量的控制和 资源利用具有重要意义。
资源利用具有重要意义。(1)燃煤烟气中
 的捕集可通过如下所示的物质转化实现。
的捕集可通过如下所示的物质转化实现。
“吸收”后所得的
 溶液与石灰乳反应的化学方程式为
溶液与石灰乳反应的化学方程式为 ,其原因是
,其原因是(2)合成尿素[
 ]是利用
]是利用 的途径之一。尿素合成主要通过下列反应实现
的途径之一。尿素合成主要通过下列反应实现反应Ⅰ:
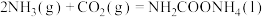
反应Ⅱ:

①密闭体系中反应Ⅰ的平衡常数(K)与温度的关系如图甲所示,反应Ⅰ的


②反应体系中除发生反应Ⅰ、反应Ⅱ外,还发生尿素水解、尿素缩合生成缩二脲[
 ]和尿素转化为氰酸铵(
]和尿素转化为氰酸铵(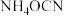 )等副反应。尿素生产中实际投入
)等副反应。尿素生产中实际投入 和
和 的物质的量之比为
的物质的量之比为 ,其实际投料比值远大于理论值的原因是
,其实际投料比值远大于理论值的原因是(3)催化电解吸收
 的KOH溶液可将
的KOH溶液可将 转化为有机物。在相同条件下,恒定通过电解池的电量,电解得到的部分还原产物的法拉第效率(
转化为有机物。在相同条件下,恒定通过电解池的电量,电解得到的部分还原产物的法拉第效率( )随电解电压的变化如图乙所示。
)随电解电压的变化如图乙所示。

其中,
 ,n表示电解生成还原产物X所转移电子的物质的量,F表示法拉第常数。
,n表示电解生成还原产物X所转移电子的物质的量,F表示法拉第常数。①当电解电压为
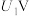 时,电解过程中含碳还原产物的
时,电解过程中含碳还原产物的 为0,阴极主要还原产物为
为0,阴极主要还原产物为②当电解电压为
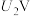 时,阴极由
时,阴极由 生成
生成 的电极反应式为
的电极反应式为③当电解电压为
 时,电解生成的
时,电解生成的 和
和 的物质的量之比为
的物质的量之比为
您最近一年使用:0次
2023-08-07更新
|
5358次组卷
|
4卷引用:2023年高考江苏卷化学真题
2023年高考江苏卷化学真题(已下线)原理综合题江苏省扬州大学附属中学2023-2024学年高二上学期12月月考化学试题(已下线)专题08 电解池 金属的腐蚀与防护-【寒假自学课】2024年高二化学寒假提升学与练(人教版2019)
真题
解题方法
2 . 氢元素及其化合物在自然界广泛存在且具有重要应用。 、
、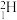 、
、 是氢元素的3种核素,基态H原子
是氢元素的3种核素,基态H原子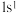 的核外电子排布,使得H既可以形成
的核外电子排布,使得H既可以形成 又可以形成
又可以形成 ,还能形成
,还能形成 、
、 、
、 、
、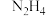 、
、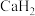 等重要化合物;水煤气法、电解水、光催化分解水都能获得
等重要化合物;水煤气法、电解水、光催化分解水都能获得 ,如水煤气法制氢反应中,
,如水煤气法制氢反应中, 与足量
与足量 反应生成
反应生成 和
和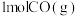 吸收131.3kJ的热量。
吸收131.3kJ的热量。 在金属冶炼、新能源开发、碳中和等方面具有重要应用,如
在金属冶炼、新能源开发、碳中和等方面具有重要应用,如 在催化剂作用下与
在催化剂作用下与 反应可得到
反应可得到 。我国科学家在氢气的制备和应用等方面都取得了重大成果。下列化学反应表示正确的是
。我国科学家在氢气的制备和应用等方面都取得了重大成果。下列化学反应表示正确的是
 、
、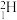 、
、 是氢元素的3种核素,基态H原子
是氢元素的3种核素,基态H原子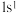 的核外电子排布,使得H既可以形成
的核外电子排布,使得H既可以形成 又可以形成
又可以形成 ,还能形成
,还能形成 、
、 、
、 、
、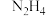 、
、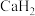 等重要化合物;水煤气法、电解水、光催化分解水都能获得
等重要化合物;水煤气法、电解水、光催化分解水都能获得 ,如水煤气法制氢反应中,
,如水煤气法制氢反应中, 与足量
与足量 反应生成
反应生成 和
和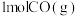 吸收131.3kJ的热量。
吸收131.3kJ的热量。 在金属冶炼、新能源开发、碳中和等方面具有重要应用,如
在金属冶炼、新能源开发、碳中和等方面具有重要应用,如 在催化剂作用下与
在催化剂作用下与 反应可得到
反应可得到 。我国科学家在氢气的制备和应用等方面都取得了重大成果。下列化学反应表示正确的是
。我国科学家在氢气的制备和应用等方面都取得了重大成果。下列化学反应表示正确的是A.水煤气法制氢: 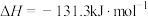 |
B. 催化加氢生成 催化加氢生成 的反应: 的反应: |
C.电解水制氢的阳极反应: |
D.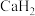 与水反应: 与水反应: |
您最近一年使用:0次
2023-08-07更新
|
4417次组卷
|
6卷引用:2023年高考江苏卷化学真题
2023年高考江苏卷化学真题(已下线)选择题6-10(已下线)考点1 化学反应的热效应(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)(已下线)专题01 化学反应的热效应-【寒假自学课】2024年高二化学寒假提升学与练(人教版2019)湖南省长沙市弘益高级中学2023-2024学年高三上学期第四次月考化学试卷浙江省2024届高三下学期5月选考化学适应性试题
3 . CO2的资源化利用能有效减少CO2排放,充分利用碳资源。
(1)CaO可在较高温度下捕集CO2,在更高温度下将捕集的CO2释放利用。CaC2O4·H2O热分解可制备CaO,CaC2O4·H2O加热升温过程中固体的质量变化见下图。
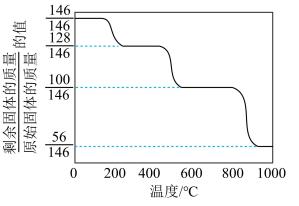
①写出400~600 ℃范围内分解反应的化学方程式:________ 。
②与CaCO3热分解制备的CaO相比,CaC2O4·H2O热分解制备的CaO具有更好的CO2捕集性能,其原因是________ 。
(2)电解法转化CO2可实现CO2资源化利用。电解CO2制HCOOH的原理示意图如下。

①写出阴极CO2还原为HCOO−的电极反应式:________ 。
②电解一段时间后,阳极区的KHCO3溶液浓度降低,其原因是________ 。
(3)CO2催化加氢合成二甲醚是一种CO2转化方法,其过程中主要发生下列反应:
反应Ⅰ:CO2(g)+H2(g) CO(g)+H2O(g) ΔH =41.2 kJ·mol−1
CO(g)+H2O(g) ΔH =41.2 kJ·mol−1
反应Ⅱ:2CO2(g)+6H2(g) CH3OCH3(g)+3H2O(g) ΔH =﹣122.5 kJ·mol−1
CH3OCH3(g)+3H2O(g) ΔH =﹣122.5 kJ·mol−1
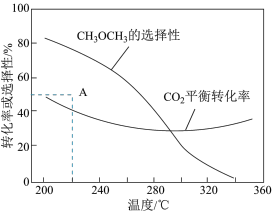
在恒压、CO2和H2的起始量一定的条件下,CO2平衡转化率和平衡时CH3OCH3的选择性随温度的变化如图。其中:
CH3OCH3的选择性=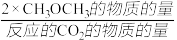 ×100%
×100%
①温度高于300 ℃,CO2平衡转化率随温度升高而上升的原因是________ 。
②220 ℃时,在催化剂作用下CO2与H2反应一段时间后,测得CH3OCH3的选择性为48%(图中A点)。不改变反应时间和温度,一定能提高CH3OCH3选择性的措施有________ 。
(1)CaO可在较高温度下捕集CO2,在更高温度下将捕集的CO2释放利用。CaC2O4·H2O热分解可制备CaO,CaC2O4·H2O加热升温过程中固体的质量变化见下图。

①写出400~600 ℃范围内分解反应的化学方程式:
②与CaCO3热分解制备的CaO相比,CaC2O4·H2O热分解制备的CaO具有更好的CO2捕集性能,其原因是
(2)电解法转化CO2可实现CO2资源化利用。电解CO2制HCOOH的原理示意图如下。

①写出阴极CO2还原为HCOO−的电极反应式:
②电解一段时间后,阳极区的KHCO3溶液浓度降低,其原因是
(3)CO2催化加氢合成二甲醚是一种CO2转化方法,其过程中主要发生下列反应:
反应Ⅰ:CO2(g)+H2(g)
 CO(g)+H2O(g) ΔH =41.2 kJ·mol−1
CO(g)+H2O(g) ΔH =41.2 kJ·mol−1反应Ⅱ:2CO2(g)+6H2(g)
 CH3OCH3(g)+3H2O(g) ΔH =﹣122.5 kJ·mol−1
CH3OCH3(g)+3H2O(g) ΔH =﹣122.5 kJ·mol−1在恒压、CO2和H2的起始量一定的条件下,CO2平衡转化率和平衡时CH3OCH3的选择性随温度的变化如图。其中:

CH3OCH3的选择性=
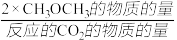 ×100%
×100%①温度高于300 ℃,CO2平衡转化率随温度升高而上升的原因是
②220 ℃时,在催化剂作用下CO2与H2反应一段时间后,测得CH3OCH3的选择性为48%(图中A点)。不改变反应时间和温度,一定能提高CH3OCH3选择性的措施有
您最近一年使用:0次
2019-06-10更新
|
6297次组卷
|
7卷引用:2019年江苏省高考化学试题
2019年江苏省高考化学试题(已下线)原理综合题北京市朝阳区第八十中学2020届高三模拟化学试题鲁科版(2019)选择性必修1 模块复习备考攻略人教版(2019)高二选择性必修第一册 模块复习备考攻略湖北省石首一中2020-2021学年高三上学期11月月考化学试题(已下线)专题12 化学反应原理综合题—2022年高考化学二轮复习讲练测(全国版)-练习
真题
名校
4 . NOx(主要指NO和NO2)是大气主要污染物之一。有效去除大气中的NOx是环境保护的重要课题。
(1)用水吸收NOx的相关热化学方程式如下:
2NO2(g)+H2O(l)=HNO3(aq)+HNO2(aq) ΔH=−116.1 kJ·mol−1
3HNO2(aq)=HNO3(aq)+2NO(g)+H2O(l) ΔH=75.9 kJ·mol−1
反应3NO2(g)+H2O(l)=2HNO3(aq)+NO(g)的ΔH=___________ kJ·mol−1。
(2)用稀硝酸吸收NOx,得到HNO3和HNO2的混合溶液,电解该混合溶液可获得较浓的硝酸。写出电解时阳极的电极反应式:____________________________________ 。
(3)用酸性(NH2)2CO水溶液吸收NOx,吸收过程中存在HNO2与(NH2)2CO生成N2和CO2的反应。写出该反应的化学方程式:____________________________________ 。
(4)在有氧条件下,新型催化剂M能催化NH3与NOx反应生成N2。
①NH3与NO2生成N2的反应中,当生成1 mol N2时,转移的电子数为__________ mol。
②将一定比例的O2、NH3和NOx的混合气体,匀速通入装有催化剂M的反应器中反应(装置见图)。

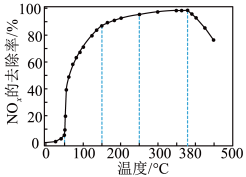
反应相同时间NOx的去除率随反应温度的变化曲线如图所示,在50~250 ℃范围内随着温度的升高,NOx的去除率先迅速上升后上升缓慢的主要原因是____________________________ ;当反应温度高于380 ℃时,NOx的去除率迅速下降的原因可能是___________________________ 。
 。
。
(1)用水吸收NOx的相关热化学方程式如下:
2NO2(g)+H2O(l)=HNO3(aq)+HNO2(aq) ΔH=−116.1 kJ·mol−1
3HNO2(aq)=HNO3(aq)+2NO(g)+H2O(l) ΔH=75.9 kJ·mol−1
反应3NO2(g)+H2O(l)=2HNO3(aq)+NO(g)的ΔH=
(2)用稀硝酸吸收NOx,得到HNO3和HNO2的混合溶液,电解该混合溶液可获得较浓的硝酸。写出电解时阳极的电极反应式:
(3)用酸性(NH2)2CO水溶液吸收NOx,吸收过程中存在HNO2与(NH2)2CO生成N2和CO2的反应。写出该反应的化学方程式:
(4)在有氧条件下,新型催化剂M能催化NH3与NOx反应生成N2。
①NH3与NO2生成N2的反应中,当生成1 mol N2时,转移的电子数为
②将一定比例的O2、NH3和NOx的混合气体,匀速通入装有催化剂M的反应器中反应(装置见图)。

反应相同时间NOx的去除率随反应温度的变化曲线如图所示,在50~250 ℃范围内随着温度的升高,NOx的去除率先迅速上升后上升缓慢的主要原因是
 。
。
您最近一年使用:0次
2018-06-10更新
|
4895次组卷
|
8卷引用:2018年全国普通高等学校招生统一考试化学(江苏卷)
真题
名校
5 . 硫化氢的转化是资源利用和环境保护的重要研究课题。由硫化氢获得硫单质有多种方法。
(1)将烧碱吸收H2S后的溶液加入到如题图—1所示的电解池的阳极区进行电解。电解过程中阳极区发生如下反应:S2-—2e-=S(n—1)S+ S2-=Sn2-。
①写出电解时阴极的电极反应式:__________________ 。
②电解后阳极区的溶液用稀硫酸酸化得到硫单质,其离子方程式可写成_____________ 。
(2)将H2S和空气的混合气体通入FeCl3、FeCl2、CuCl2的混合溶液中反应回收S,其物质转化如题图—2所示。
①在图示的转化中,化合价不变的元素是___________ 。
②反应中当有1molH2S转化为硫单质时,保持溶液中Fe3+的物质的量不变,需要消耗O2的物质的量为_______________ 。
③在温度一定和不补加溶液的条件下,缓慢通入混合气体,并充分搅拌。欲使生成的硫单质中不含CuS,可采取的措施有___________________ 。
(3)H2S在高温下分解生成硫蒸气和H2。若反应在不同温度下达到平衡时,混合气体中各组分的体积分数如题图—3所示,H2S在高温下分解反应的化学方程式为_____________ 。
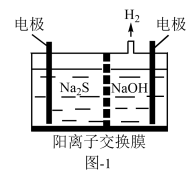


(1)将烧碱吸收H2S后的溶液加入到如题图—1所示的电解池的阳极区进行电解。电解过程中阳极区发生如下反应:S2-—2e-=S(n—1)S+ S2-=Sn2-。
①写出电解时阴极的电极反应式:
②电解后阳极区的溶液用稀硫酸酸化得到硫单质,其离子方程式可写成
(2)将H2S和空气的混合气体通入FeCl3、FeCl2、CuCl2的混合溶液中反应回收S,其物质转化如题图—2所示。
①在图示的转化中,化合价不变的元素是
②反应中当有1molH2S转化为硫单质时,保持溶液中Fe3+的物质的量不变,需要消耗O2的物质的量为
③在温度一定和不补加溶液的条件下,缓慢通入混合气体,并充分搅拌。欲使生成的硫单质中不含CuS,可采取的措施有
(3)H2S在高温下分解生成硫蒸气和H2。若反应在不同温度下达到平衡时,混合气体中各组分的体积分数如题图—3所示,H2S在高温下分解反应的化学方程式为



您最近一年使用:0次
2016-12-09更新
|
2720次组卷
|
5卷引用:2014年全国普通高等学校招生统一考试理科综合能力测试化学(江苏卷)
2014年全国普通高等学校招生统一考试理科综合能力测试化学(江苏卷)2016届江苏省南通市天星湖中学高三上学期第一次阶段测化学试卷(已下线)2019高考备考二轮复习精品资料-专题3 氧化还原反应(教学案)北京市海淀区中央民族大学附属中学2020届高三考前热身化学试题北京市清华大学附属中学2020届高三三模试卷化学试题
真题
解题方法
6 . 下表列出了3种燃煤烟气脱硫方法的原理。
(1) 方法Ⅰ中氨水吸收燃煤烟气中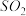 的化学反应为:
的化学反应为:

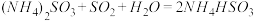
能提高燃煤烟气中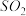 去除率的措施有
去除率的措施有__________ (填字母)。
A.增大氨水浓度 B.升高反应温度
C.使燃煤烟气与氨水充分接触 D. 通入空气使HSO3-转化为SO42-
采用方法Ⅰ脱硫,并不需要预先除去燃煤烟气中大量的 ,原因是
,原因是________ (用离子方程式表示)。
(2)方法Ⅱ重要发生了下列反应:
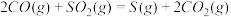 ∆H=8.0kJ/mol
∆H=8.0kJ/mol
 ∆H=90.4kJ/mol
∆H=90.4kJ/mol
 ∆H=-566.0kJ/mol
∆H=-566.0kJ/mol
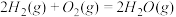 ∆H=-483.6kJ/mol
∆H=-483.6kJ/mol
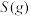 与
与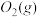 反应生成
反应生成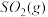 的热化学方程式为
的热化学方程式为_____________ 。
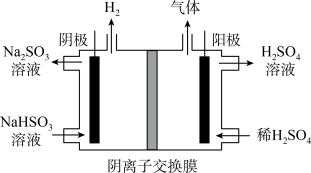
(3) 方法Ⅲ中用惰性电极电解 溶液的装置如上图所示。阳极区放出气体的成分为
溶液的装置如上图所示。阳极区放出气体的成分为______________ 。(填化学式)
| 方法I | 用氨水将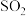 转化为 转化为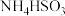 ,再氧化成( ,再氧化成(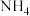 ) )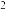 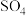 |
| 方法II | 用生物质热解气(主要成分CO、 、 、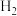 )将 )将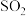 在高温下还原成单质硫 在高温下还原成单质硫 |
| 方法III | 用 溶液吸收 溶液吸收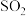 ,再经电解转化为 ,再经电解转化为 |
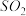 的化学反应为:
的化学反应为:
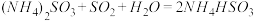
能提高燃煤烟气中
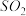 去除率的措施有
去除率的措施有A.增大氨水浓度 B.升高反应温度
C.使燃煤烟气与氨水充分接触 D. 通入空气使HSO3-转化为SO42-
采用方法Ⅰ脱硫,并不需要预先除去燃煤烟气中大量的
 ,原因是
,原因是(2)方法Ⅱ重要发生了下列反应:
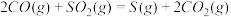 ∆H=8.0kJ/mol
∆H=8.0kJ/mol ∆H=90.4kJ/mol
∆H=90.4kJ/mol ∆H=-566.0kJ/mol
∆H=-566.0kJ/mol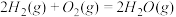 ∆H=-483.6kJ/mol
∆H=-483.6kJ/mol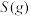 与
与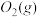 反应生成
反应生成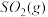 的热化学方程式为
的热化学方程式为
(3) 方法Ⅲ中用惰性电极电解
 溶液的装置如上图所示。阳极区放出气体的成分为
溶液的装置如上图所示。阳极区放出气体的成分为
您最近一年使用:0次
2019-01-30更新
|
204次组卷
|
4卷引用:2010年普通高等学校招生统一考试理综试题化学部分(江苏卷)
真题
7 . 以氯化钾和钛白厂的副产品硫酸亚铁为原料生产硫酸钾、过二硫酸铵和氧化铁红颜料, 原料的综合利用率较高。其主要流程如下:

(1)反应I前需在FeSO4溶液中加入_____ (填字母),以除去溶液中的Fe3+。
(2)反应I需控制反应温度低35℃,其目的是______________________ 。
(3)工业生产上常在反应Ⅲ的过程中加入一定量的醇类溶剂,其目的是:________ 。
(4)反应Ⅳ常被用于电解生产(NH4)2S2O8(过二硫酸铵)。电解时均用惰性电极,阳极
发生的电极反应可表示为:__________________________ 。

(1)反应I前需在FeSO4溶液中加入
| A.锌粉 | B.铁屑 | C.KI溶液 | D.H2 |
(2)反应I需控制反应温度低35℃,其目的是
(3)工业生产上常在反应Ⅲ的过程中加入一定量的醇类溶剂,其目的是:
(4)反应Ⅳ常被用于电解生产(NH4)2S2O8(过二硫酸铵)。电解时均用惰性电极,阳极
发生的电极反应可表示为:
您最近一年使用:0次
2016-12-09更新
|
193次组卷
|
5卷引用:2009年普通高等学校招生统一考试化学试题(江苏卷)



