名校
解题方法
1 . 下列关于金属防护方法的说法不正确 的是
| A.利用阳极氧化法处理铝制品的表面,使之形成致密的氧化膜而钝化 |
| B.用K3[Fe(CN)6]溶液检验Fe2+,若得到蓝色溶液,证明原溶液中含Fe2+ |
| C.轮船在船壳水线以下常装有一些锌块,这是利用了牺牲阳极的阴极保护法 |
| D.外加电流,将需要保护的金属做阴极,可以起到防止金属被腐蚀的作用 |
您最近半年使用:0次
2022-04-12更新
|
213次组卷
|
2卷引用:浙江省宁波效实中学2021-2022学年高二上学期期中考试化学试题
解题方法
2 . 下图是元素周期表的一部分。按要求填写下列空白:
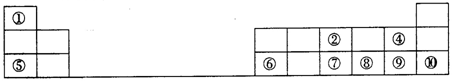
(1)元素⑦在周期表中的位置可表示为_______ 。
(2)①~⑩元素的最高价氧化物对应的水化物中,酸性最强的是_______ (填化学式)。
(3)④⑧⑨三种元素形成的气态氢化物稳定性由大到小的顺序是_______ (用化学式表示)。
(4)⑤和⑥两种元素的最高价氧化物对应的水化物反应的离子方程式为_______ 。
(5)为了证明⑤和⑥两种元素的金属性强弱,下列说法或实验能提供证据的是_______ 。
A.比较两种元素的单质的熔点、沸点高低
B.将两种元素的单质分别与冷水反应,观察反应的剧烈程度
C.比较两种元素的最高价氧化物对应的水化物的碱性强弱
(6)铁元素处在周期表第四周期第Ⅷ族,它在地壳中含量仅次于铝。全世界每年都有大量的钢铁因生锈而损失。钢铁发生电化学腐蚀时,负极反应是_______ 。

(1)元素⑦在周期表中的位置可表示为
(2)①~⑩元素的最高价氧化物对应的水化物中,酸性最强的是
(3)④⑧⑨三种元素形成的气态氢化物稳定性由大到小的顺序是
(4)⑤和⑥两种元素的最高价氧化物对应的水化物反应的离子方程式为
(5)为了证明⑤和⑥两种元素的金属性强弱,下列说法或实验能提供证据的是
A.比较两种元素的单质的熔点、沸点高低
B.将两种元素的单质分别与冷水反应,观察反应的剧烈程度
C.比较两种元素的最高价氧化物对应的水化物的碱性强弱
(6)铁元素处在周期表第四周期第Ⅷ族,它在地壳中含量仅次于铝。全世界每年都有大量的钢铁因生锈而损失。钢铁发生电化学腐蚀时,负极反应是
您最近半年使用:0次
名校
解题方法
3 . 下列装置或操作不能 达到实验目的是
| A | B |
 | 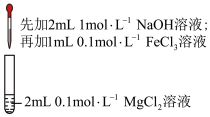 |
| 测定中和反应的反应热 | 证明沉淀可以转化 |
| C | D |
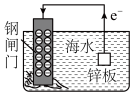 |  |
| 防止水库的钢闸门腐蚀 | 探究温度对平衡的影响 |
| A.A | B.B | C.C | D.D |
您最近半年使用:0次
2024-03-02更新
|
120次组卷
|
2卷引用:福建省南平市2023-2024学年高二上学期期末质量检测化学试题
名校
解题方法
4 . 下列实验方案能达到实验目的的是
| 实验方案 | 实验目的 | |
| A | 白铁皮(镀锌铁)出现刮痕后浸泡在食盐水中,一段时间后浸泡液中滴入几滴 | 探究上述过程铁是否发生腐蚀 |
| B | 将 (强氧化剂)固体溶于水后,加入浓盐酸 (强氧化剂)固体溶于水后,加入浓盐酸 | 证明 溶液存在平衡: 溶液存在平衡: + + ⇌ ⇌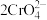 + + |
| C | 用两支试管各取 的 的 溶液,分别加入10滴 溶液,分别加入10滴 和 和 的草酸(H2C2O4)溶液,记录溶液褪色所需的时间 的草酸(H2C2O4)溶液,记录溶液褪色所需的时间 | 探究反应物浓度对反应速率的影响 |
| D | 分别在20℃、30℃下,向 溶液中依次加入 溶液中依次加入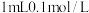 硫酸和2滴淀粉溶液 硫酸和2滴淀粉溶液 | 探究温度对4I-+O2+4H+=2I2+2H2O反应速率的影响 |
| A.A | B.B | C.C | D.D |
您最近半年使用:0次
5 . Ⅰ.某化学兴趣小组的同学学了金属的电化学腐蚀,对教材叙述[钢铁在酸性环境中发生析氢腐蚀;在酸性很弱或呈中性,溶有 的环境中发生吸氧腐蚀;钢铁等金属的腐蚀主要为吸氧腐蚀]产生疑问,决定用数字化实验模拟探究钢铁在酸性环境下的腐蚀情况。
的环境中发生吸氧腐蚀;钢铁等金属的腐蚀主要为吸氧腐蚀]产生疑问,决定用数字化实验模拟探究钢铁在酸性环境下的腐蚀情况。
(1)用图1所示装置进行实验:打开a________ (填仪器名称)的活塞,加入1mL溶液,测得压强随时间变化曲线如图2。
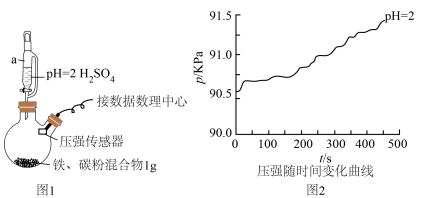
同学甲得出结论:酸性条件下,铁粉发生析氢腐蚀。
(2)同学乙认为甲的结论不科学,锥形瓶内压强变大还可能是___________ ,提出改进措施___________ 。改进后,再次实验,证明甲、乙的猜想均正确,请在图2绘制出改进后的曲线___________ 。
(3)同学丙认为甲、乙的实验不具代表性,建议用不同浓度的酸进行实验。在改进后的装置中分别用 、
、 的硫酸实验,测定压强随时间变化情况,结果如图3.同学丙得出:酸性较弱时,铁会发生吸氧腐蚀,其依据是
的硫酸实验,测定压强随时间变化情况,结果如图3.同学丙得出:酸性较弱时,铁会发生吸氧腐蚀,其依据是___________ 。
(4)对于图3中 时,铁是否发生了腐蚀?同学们意见不统一,经讨论,他们把压强传感器换成氧气传感器,得出不同pH时装置中
时,铁是否发生了腐蚀?同学们意见不统一,经讨论,他们把压强传感器换成氧气传感器,得出不同pH时装置中 浓度随时间的变化曲线如图4。
浓度随时间的变化曲线如图4。
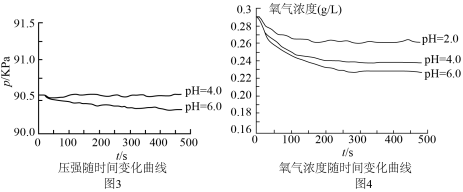
结合实验分析: 时,压强几乎不随时间改变是因为
时,压强几乎不随时间改变是因为___________ 。
综上,小组同学得出结论:教材表述科学严谨。
Ⅱ.拓展研究:
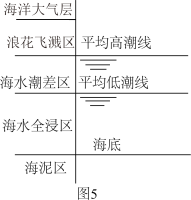
(5)侯保荣院士专门研究海洋钢架结构桥海洋大气层梁腐蚀,他发现腐蚀最严重的是浪花飞溅区浪花飞溅区(海洋环境分区如图5),请你解释原因___________ 。
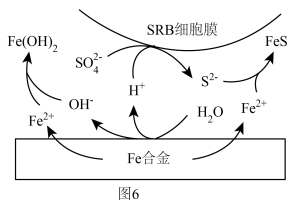
(6)科学家还发现在 浓度很小的海底也有厌氧微生物(如硫酸盐还原菌SRB)对海洋钢制部件的腐蚀,其原理如图6,已知溶液中的
浓度很小的海底也有厌氧微生物(如硫酸盐还原菌SRB)对海洋钢制部件的腐蚀,其原理如图6,已知溶液中的 完全转化为FeS,请写出该铁合金腐蚀的总反应
完全转化为FeS,请写出该铁合金腐蚀的总反应___________ (离子方程式)。
(7)请列举出生产生活中金属制品的防腐措施___________ (任写一点即可)。
 的环境中发生吸氧腐蚀;钢铁等金属的腐蚀主要为吸氧腐蚀]产生疑问,决定用数字化实验模拟探究钢铁在酸性环境下的腐蚀情况。
的环境中发生吸氧腐蚀;钢铁等金属的腐蚀主要为吸氧腐蚀]产生疑问,决定用数字化实验模拟探究钢铁在酸性环境下的腐蚀情况。(1)用图1所示装置进行实验:打开a

同学甲得出结论:酸性条件下,铁粉发生析氢腐蚀。
(2)同学乙认为甲的结论不科学,锥形瓶内压强变大还可能是
(3)同学丙认为甲、乙的实验不具代表性,建议用不同浓度的酸进行实验。在改进后的装置中分别用
 、
、 的硫酸实验,测定压强随时间变化情况,结果如图3.同学丙得出:酸性较弱时,铁会发生吸氧腐蚀,其依据是
的硫酸实验,测定压强随时间变化情况,结果如图3.同学丙得出:酸性较弱时,铁会发生吸氧腐蚀,其依据是(4)对于图3中
 时,铁是否发生了腐蚀?同学们意见不统一,经讨论,他们把压强传感器换成氧气传感器,得出不同pH时装置中
时,铁是否发生了腐蚀?同学们意见不统一,经讨论,他们把压强传感器换成氧气传感器,得出不同pH时装置中 浓度随时间的变化曲线如图4。
浓度随时间的变化曲线如图4。
结合实验分析:
 时,压强几乎不随时间改变是因为
时,压强几乎不随时间改变是因为综上,小组同学得出结论:教材表述科学严谨。
Ⅱ.拓展研究:
(5)侯保荣院士专门研究海洋钢架结构桥海洋大气层梁腐蚀,他发现腐蚀最严重的是浪花飞溅区浪花飞溅区(海洋环境分区如图5),请你解释原因

(6)科学家还发现在
 浓度很小的海底也有厌氧微生物(如硫酸盐还原菌SRB)对海洋钢制部件的腐蚀,其原理如图6,已知溶液中的
浓度很小的海底也有厌氧微生物(如硫酸盐还原菌SRB)对海洋钢制部件的腐蚀,其原理如图6,已知溶液中的 完全转化为FeS,请写出该铁合金腐蚀的总反应
完全转化为FeS,请写出该铁合金腐蚀的总反应
(7)请列举出生产生活中金属制品的防腐措施
您最近半年使用:0次
2024-01-05更新
|
866次组卷
|
2卷引用:2024届广东东莞中学、广州二中、惠州一中、深圳实验、珠海一中、中山纪念中学六校高三上学期第三次联考化学
名校
解题方法
6 . 某小相同学为探究电极对金属腐蚀与防护的影响,设计如下实验:将饱和食盐水与琼脂(凝固剂,不参与反应)的混合液置于两个培养皿中,向其中滴入少量酚酞溶液和 溶液,混合均匀,分别将包裹锌片和铜片的铁钉放入两个培养皿中,观察现象如表。已知:
溶液,混合均匀,分别将包裹锌片和铜片的铁钉放入两个培养皿中,观察现象如表。已知: 遇到
遇到 能产生蓝色沉淀,对有关实验现象及分析不正确的是
能产生蓝色沉淀,对有关实验现象及分析不正确的是
 溶液,混合均匀,分别将包裹锌片和铜片的铁钉放入两个培养皿中,观察现象如表。已知:
溶液,混合均匀,分别将包裹锌片和铜片的铁钉放入两个培养皿中,观察现象如表。已知: 遇到
遇到 能产生蓝色沉淀,对有关实验现象及分析不正确的是
能产生蓝色沉淀,对有关实验现象及分析不正确的是变红变蓝 | 变红 |
| ⅰ.包裹铜片的铁钉 | ⅱ.包裹锌片的铁钉 |
| A.两个培养皿中金属均发生吸氧腐蚀,且铁钉腐蚀速度ⅰ快 |
| B.该实验证明,若给金属表面镀活泼性比被保护金属强的金属,则破损后依旧可以防护 |
| C.培养皿ⅱ中对铁钉的防护是牺牲阳极的阴极保护法 |
| D.随着反应的进行,培养皿ⅰ和ⅱ中均出现红褐色浑浊 |
您最近半年使用:0次
2023-11-16更新
|
394次组卷
|
2卷引用:江苏省苏州中学2023-2024学年高二上学期10月月考化学试题
名校
7 . 某小组同学为探究电极对金属腐蚀与防护的影响,设计如下实验:将饱和食盐水与琼脂(凝固剂,不参与反应)的混合液置于两个培养皿中,向其中滴入少量酚酞溶液和K3[Fe(CN)6]溶液,混合均匀。分别将包裹锌片和铜片的铁钉放入两个培养皿中,观察现象如表。
已知:K3[Fe(CN)6]遇到Fe2+能产生蓝色沉淀。
对有关实验现象及分析正确的是
变红 | 变红变蓝 |
| i.包裹锌片的铁钉 | ii.包裹铜片的铁钉 |
对有关实验现象及分析正确的是
| A.两个培养皿中金属均发生吸氧腐蚀,且铁钉腐蚀速度i快 |
| B.随着反应的进行,培养皿i和ii中均出现红褐色浑浊 |
| C.培养皿ii中对铁钉的防护是牺牲阳极保护法 |
| D.该探究实验证明金属的防护需要给金属表面镀活泼性比被保护金属强的金属 |
您最近半年使用:0次
2023-04-29更新
|
249次组卷
|
2卷引用:山东省菏泽市2022-2023学年高一下学期期中考试化学(A)试题
解题方法
8 . 下列电化学装置能达到相应目的的是
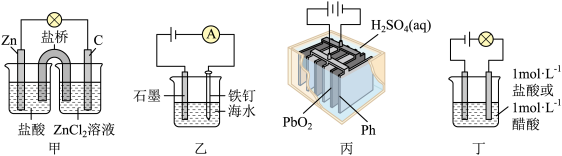

A.用甲装置验证盐酸与 反应有电子转移 反应有电子转移 |
| B.用乙装置模拟外加电流法防止铁钉腐蚀 |
| C.按丙装置连线方式对铅蓄电池充电 |
| D.用丁装置证明盐酸为强酸 |
您最近半年使用:0次
9 . 将裹有锌片的铁钉放入溶有琼脂的饱和NaCl溶液中,滴入少量酚酞,回答下列问题。
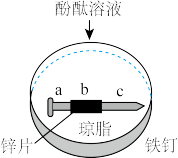
(1)一段时间后a处可能出现的现象是_____ ,请结合化学用语解释原因______ 。
(2)某同学为验证选择的铁钉未被腐蚀,取少量溶液于试管,分别进行如表实验,能证明铁钉未被腐蚀的实验是_____ (填序号)。
(3)某同学欲将铁棒镀铜设计电镀铜实验,请依据提供实验用品完成如图所示电镀装置_____ ,并写出电池工作一段时间后的现象。
供选择的实验用品:FeCl2溶液,CuSO4溶液,铜棒,锌棒,铁棒
实验现象:_____ 。

(1)一段时间后a处可能出现的现象是
(2)某同学为验证选择的铁钉未被腐蚀,取少量溶液于试管,分别进行如表实验,能证明铁钉未被腐蚀的实验是
| 序号 | ① | ② | ③ | ④ |
| 滴入试剂 | AgNO3溶液 | 淀粉KI溶液 | KSCN溶液 | K3[Fe(CN)6]溶液 |
| 实验现象 | 产生沉淀 | 无蓝色出现 | 无红色出现 | 无蓝色沉淀 |
供选择的实验用品:FeCl2溶液,CuSO4溶液,铜棒,锌棒,铁棒

实验现象:
您最近半年使用:0次
名校
10 . 由下列实验操作及现象能得出相应结论的是
| 实验操作 | 实验现象 | 实验结论 | |
| A | 向盛有浓HNO3溶液的两支试管中分别加入除去氧化膜的镁带和铝片 | 加入镁带的试管中迅速产生红棕色气体。加入铝片试管中无明显现象 | 金属活泼性:Mg>Al |
| B | 向BaCl2溶液中通入SO2和气体X | 产生白色沉淀 | 气体X一定为氧化剂 |
| C | 将苯、液溴、铁粉混合物反应产生的气体通入到AgNO3溶液中 | 生成淡黄色沉淀 | 证明苯与液溴在Fe催化下发生取代反应 |
| D | 一块除去铁锈的铁片上滴一滴铁氰化钾溶液,静置2~3min | 生成蓝色沉淀 | 铁片上可能发生了电化学腐蚀 |
| A.A | B.B | C.C | D.D |
您最近半年使用:0次



