1 . 下列说法中正确的是( )
| A.因为p轨道是“8”字形的,所以p电子走“8”字形 |
| B.电子层数为3时,有3s、3p、3d、3f四个轨道 |
| C.氢原子中只有一个电子,故氢原子只有一条轨道 |
| D.原子轨道与电子云都是用来形象描述电子运动状态的 |
您最近一年使用:0次
2019-06-23更新
|
135次组卷
|
9卷引用:云南省大姚县一中2020-2021学年高二下学期6月份考试化学试题
云南省大姚县一中2020-2021学年高二下学期6月份考试化学试题云南省玉溪市通海三中2018-2019学年高二上学期10月考试化学试题云南省普洱市云南省思茅第一中学2022-2023学年高二下学期6月月考化学试题云南省保山第一中学2022-2023学年高二下学期期末考试化学试题高中化学人教版 选修三 第1章 原子结构与性质 电子云与原子轨道人教版2017-2018学年高二化学选修三同步训练:1.1 原子结构(第2课时)贵州省遵义育新高级中学2018-2019学年高二上学期11月月考化学试题广西蒙山县第一中学2018-2019学年高二下学期第二次月考化学试题(已下线)第37练 原子结构-2023年高考化学一轮复习小题多维练(全国通用)
名校
2 . 现有主族元素X、Y、Z,X原子的最外层电子排布为ns1;Y原子的M电子层有2个未成对电子;Z原子的最外层p原子轨道上只有一对成对电子,且Z原子的核外电子比Y原子少8个。由这三种元素组成的化合物的化学式不可能是( )
| A.X2YZ3 | B.X2YZ4 | C.X2Y2Z3 | D.XYZ4 |
您最近一年使用:0次
2019-04-09更新
|
497次组卷
|
16卷引用:云南省玉溪市通海县第二中学2021-2022学年高二上学期12月月考化学试题
云南省玉溪市通海县第二中学2021-2022学年高二上学期12月月考化学试题云南省曲靖市沾益二中2017-2018学年高二下学期期末考试化学试题云南省玉溪市通海三中2018-2019学年高二上学期10月考试化学试题云南省江城一中2018-2019学年高二下学期期末考试化学试题云南省普洱市墨江县民族学校2019—2020学年高二上学期期末考试化学试题(人教版2019)选择性必修2 第一章 原子结构与性质 B素养拓展区陕西省榆林市第十二中学2020-2021学年高二下学期第一次月考化学试题宁夏海原第一中学2020-2021学年高二下学期期中考试化学试题四川省峨眉第二中学校2021-2022学年高二上学期10月月考化学试题四川省南充市南部县第二中学2021-2022学年高二上学期11月月考化学试题云南省景东彝族自治县第一中学2021-2022学年高二下学期3月份考试化学试题云南省蒙自一中2021-2022学年高二下学期3月份考试化学试题2015-2016学年福建省漳州市芗城中学高二下期中理科化学试卷福建省华安县第一中学2018-2019学年高二下学期第一次月考化学试题第1章 原子结构——B拓展区综合拓展(鲁科版选修3)广西蒙山县第一中学2018-2019学年高二下学期第二次月考化学试题
3 . 按电子排布可把周期表里的元素划分成5个区,以下元素属于s区的是( )
| A.Fe | B.Mg | C.Al | D.La |
您最近一年使用:0次
2019-03-21更新
|
142次组卷
|
3卷引用:云南省玉溪市华宁二中2020-2021学年高二下学期期中考试化学试题
4 . 下列各微粒中,各能层电子数均达到2n2的是( )
| A.Ne,Ar | B.F-,Mg2+ |
| C.Al,O2- | D.Cl-,Ar |
您最近一年使用:0次
2019-01-02更新
|
631次组卷
|
9卷引用:云南省玉溪市通海县第二中学2021-2022学年高二上学期12月月考化学试题
5 . 有U、V、W、X四种短周期元素,原子序数依次增大,其相关信息如下表:
请回答下列问题:
(1)U、V两种元素组成的一种化合物甲是重要的化工原料,常把它的产量作为衡量石油化工发展水平的标志,则甲分子中σ键和π键的个数比为________ ,其中心原子采取______ 杂化。
(2)V与W原子结合形成的V3W4晶体,其硬度比金刚石大,则V3W4晶体中含有________ 键,属于________ 晶体。
(3)乙和丙分别是V和X的氢化物,这两种氢化物分子中都含有18个电子。乙和丙的化学式分别是________ 、____________ ,两者沸点的关系为:乙________ 丙(填“>”或“<”),原因是______________ 。
| 元素编号 | 相关信息 |
| U | 所处的周期数、族序数分别与其原子序数相等 |
| V | 基态时,电子分布在三个能级上,且各能级中电子数相等 |
| W | 基态时,2p轨道处于半充满状态 |
| X | 与W元素处于同一周期,且X的第一电离能小于W的第一电离能 |
(1)U、V两种元素组成的一种化合物甲是重要的化工原料,常把它的产量作为衡量石油化工发展水平的标志,则甲分子中σ键和π键的个数比为
(2)V与W原子结合形成的V3W4晶体,其硬度比金刚石大,则V3W4晶体中含有
(3)乙和丙分别是V和X的氢化物,这两种氢化物分子中都含有18个电子。乙和丙的化学式分别是
您最近一年使用:0次
2018-12-19更新
|
134次组卷
|
2卷引用:云南省易门一中2020-2021学年高二6月月考化学试题
名校
6 . Cu2+能与NH3、H2O、OH﹣、Cl﹣等形成配位数为4的配合物。
(1)向CuSO4溶液中加入过量NaOH溶液可生成Na2[Cu(OH)4]。
①画出配离子[Cu(OH)4]2+中的配位键__ 。
②Na2[Cu(OH)4]中除了配位键外,还存在的化学键类型有__ (填序号)。
A.离子键 B.金属键 C.极性共价键 D.非极性共价键
(2)金属铜单独与氨水或过氧化氢都不能反应,但可与氨水和过氧化氢的混合溶液发生如下反应:Cu+H2O2+4NH3═[Cu(OH)4]2++2OH﹣。其原因是_________________ .
(3)Cu2+可以与乙二胺(H2N﹣CH2CH2﹣NH2)形成配离子(如图):
①H、O、N三种元素的电负性从大到小的顺序____ 。
②乙二胺分子中N原子成键时采取的杂化类型是__ 。
③乙二胺沸点高于Cl﹣CH2CH2﹣Cl的主要原因是__ 。
(1)向CuSO4溶液中加入过量NaOH溶液可生成Na2[Cu(OH)4]。
①画出配离子[Cu(OH)4]2+中的配位键
②Na2[Cu(OH)4]中除了配位键外,还存在的化学键类型有
A.离子键 B.金属键 C.极性共价键 D.非极性共价键
(2)金属铜单独与氨水或过氧化氢都不能反应,但可与氨水和过氧化氢的混合溶液发生如下反应:Cu+H2O2+4NH3═[Cu(OH)4]2++2OH﹣。其原因是
(3)Cu2+可以与乙二胺(H2N﹣CH2CH2﹣NH2)形成配离子(如图):
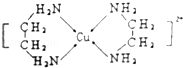
①H、O、N三种元素的电负性从大到小的顺序
②乙二胺分子中N原子成键时采取的杂化类型是
③乙二胺沸点高于Cl﹣CH2CH2﹣Cl的主要原因是
您最近一年使用:0次
2018-12-17更新
|
284次组卷
|
5卷引用:云南省玉溪市通海县第二中学2021-2022学年高二上学期12月月考化学试题
名校
7 . 具有下列电子排布式的原子中,半径最大的是( )
| A.1s22s22p63s23p5 | B.1s22s22p3 |
| C.1s22s22p2 | D.1s22s22p63s23p4 |
您最近一年使用:0次
2018-12-13更新
|
275次组卷
|
8卷引用:云南省易门一中2020-2021学年高二6月月考化学试题
名校
解题方法
8 . 根据下列微粒的最外层电子排布,能确定该元素在元素周期表中位置的是( )
| A.4s1 | B.3d104sn | C.nsnnp3n | D.ns2np3 |
您最近一年使用:0次
2018-12-04更新
|
882次组卷
|
11卷引用:云南省大姚县一中2020-2021学年高二下学期6月份考试化学试题
云南省大姚县一中2020-2021学年高二下学期6月份考试化学试题云南省澄江二中2018-2019学年高二上学期期中考试化学试题云南省华宁二中2018-2019学年高二下学期开学考试化学试题(人教版2019)选择性必修2 第一章 原子结构与性质 第二节 原子结构与元素的性质(已下线)1.2.1 原子结构与元素周期表(素养提优B练)-2021-2022学年高二化学课时过关提优AB练(人教版2019选择性必修2)(已下线)1.2.1 原子结构与元素周期表-2021-2022学年高二化学同步课时跟踪训练(人教版2019选择性必修2)贵州省黄平县且兰高级中学2018-2019学年高二上学期12月份考试化学试题湖北省宜昌市葛洲坝中学2018-2019学年高二下学期期中考试化学试题黑龙江省鸡西市鸡东县第二中学2019-2020 学年高二下学期期末考试化学试题(已下线)【知识图鉴】单元讲练测选择性必修2第1章01讲核心(已下线)1.2.1 原子结构与元素周期表-同步学习必备知识
2018高三上·全国·专题练习
名校
9 . 人们通常将在同一原子轨道上运动、自旋方向相反的2个电子,称为“电子对”,将在某一原子轨道上运动的单个电子,称为“未成对电子”。下列基态原子的电子排布式中,未成对电子数最多的是
| A.1s22s22p63s23p6 | B.1s22s22p63s23p63d54s2 |
| C.1s22s22p63s23p63d54s1 | D.1s22s22p63s23p63d104s1 |
您最近一年使用:0次
2018-11-24更新
|
778次组卷
|
16卷引用:云南省玉溪市通海县第二中学2021-2022学年高二上学期12月月考化学试题
云南省玉溪市通海县第二中学2021-2022学年高二上学期12月月考化学试题云南省昭通市巧家县第四中学2019-2020学年高二上学期期末考试化学试题(已下线)第30讲 原子结构与性质(练) — 2022年高考化学一轮复习讲练测(新教材新高考)(已下线)2018年11月22日 《每日一题》人教版一轮复习-原子(或离子)的核外电子排布贵州省习水县一中2018-2019学年高二上学期12月份月考化学试题鲁科版高中化学选修3模块综合测评卷内蒙古包头市包钢第四中学2018-2019学年高二下学期4月月考化学试题辽宁省凌源市第二高级中学2019-2020学年高二第四次网上测试化学试题安徽省安庆市太湖县2019-2020学年高二下学期期中质量调研考试化学试题宁夏海原县第一中学2019-2020学年高二下学期期末考试化学试题(已下线)第34讲 原子结构与性质-2021年高考化学一轮复习名师精讲练山西省朔州市怀仁县大地学校2019-2020学年高二下学期期末考试化学试题安徽省蚌埠第三中学2019-2020学年高二下学期期末考试化学试题(已下线)第29讲 原子结构与性质(练)-2023年高考化学一轮复习讲练测(新教材新高考)(已下线)第1讲 原子结构 核外电子排布广东省广州市广雅中学2023-2024学年高二下学期学科综合素养评估化学试卷
名校
10 . 氯元素的原子结构示意图为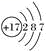 ,下列说法正确的是( )
,下列说法正确的是( )
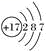 ,下列说法正确的是( )
,下列说法正确的是( )| A.氯原子在化学反应中易失去电子 |
| B.氯原子易得到电子形成稳定的氯离子 |
| C.氯元素的化合价只有-1价 |
| D.氯的原子核外有7个电子 |
您最近一年使用:0次
2018-08-02更新
|
211次组卷
|
9卷引用:云南省玉溪市江川区第二中学2020-2021学年高一下学期期中考试化学试题
云南省玉溪市江川区第二中学2020-2021学年高一下学期期中考试化学试题云南省盐津县第一中学2020-2021学年高一下学期6月份考试化学试题云南省曲靖市沾益二中2017-2018学年高一下学期期末考试化学试题云南省文山壮族苗族自治州富宁县第二中学2019-2020学年高一上学期期末考试化学试题云南省腾冲市第一中学2021-2022学年高一下学期3月份考试化学试题2020年春季人教版高中化学必修2第一章《物质结构 元素周期律》测试卷广西壮族自治区崇左市扶绥县第二中学2019-2020学年高一上学期期末考试化学试题(已下线)3.1.2 氯气的性质与应用练习(1)——《高中新教材同步备课》(苏教版 必修第一册)湖北省沙市中学2020-2021学年高一上学期期中考试化学(学考)试题



