1 .  与一定量的水形成晶体
与一定量的水形成晶体 ,Q在一定条件下可转化为R:
,Q在一定条件下可转化为R:

回答下列问题:
(1)元素B位于元素周期表的第______ 周期,第______ 族。其常见化合价应为______ 价。B的原子结构示意图是______ 。
(2) 的电子式为
的电子式为______ ,每个R的阴离子中含有极性键的数目为______ 。 的形成过程,可用电子式表示为
的形成过程,可用电子式表示为______ 。上述Q和R的转化属于______ 变化(填“物理”或“化学”)。
(3)HF气体的稳定性______ HCl气体(填“>”或“<”)。已知 ,该反应的还原剂是
,该反应的还原剂是______ ,氧化产物是______ 。
(4)若不慎将KOH溶液沾到皮肤上,应立即用大量水冲洗,然后涂上1%的硼酸。已知硼酸( )在水溶液中呈现酸性的原因是:
)在水溶液中呈现酸性的原因是: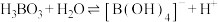 。则按照酸类物质常用的分类方法,硼酸应属于
。则按照酸类物质常用的分类方法,硼酸应属于______ 元酸。它与KOH溶液反应的离子方程式为____________ 。
 与一定量的水形成晶体
与一定量的水形成晶体 ,Q在一定条件下可转化为R:
,Q在一定条件下可转化为R:
回答下列问题:
(1)元素B位于元素周期表的第
(2)
 的电子式为
的电子式为 的形成过程,可用电子式表示为
的形成过程,可用电子式表示为(3)HF气体的稳定性
 ,该反应的还原剂是
,该反应的还原剂是(4)若不慎将KOH溶液沾到皮肤上,应立即用大量水冲洗,然后涂上1%的硼酸。已知硼酸(
 )在水溶液中呈现酸性的原因是:
)在水溶液中呈现酸性的原因是: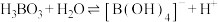 。则按照酸类物质常用的分类方法,硼酸应属于
。则按照酸类物质常用的分类方法,硼酸应属于
您最近一年使用:0次
解题方法
2 . Ⅰ.  U是重要的核工业原料,在自然界的丰度很低。
U是重要的核工业原料,在自然界的丰度很低。 U的浓缩一直为国际社会关注。回答下列有关问题:
U的浓缩一直为国际社会关注。回答下列有关问题:
(1)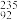 U的中子数是
U的中子数是___ 。
(2) U、
U、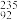 U、
U、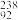 U互为同位素,下列对同位素的理解不正确的是
U互为同位素,下列对同位素的理解不正确的是___ (填序号,下同)。
A.元素符号相同 B.物理性质相同 C.化学性质基本相同 D.在周期表中位置相同
(3)下列有关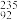 U说法不正确的是
U说法不正确的是___ 。
A. U原子核内中子数与质子数之差为51
U原子核内中子数与质子数之差为51
B. U与
U与 U的质子数、电子数都相等
U的质子数、电子数都相等
C. U与
U与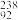 U是两种质子数相同,中子数不同的原子
U是两种质子数相同,中子数不同的原子
D.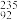 U与
U与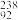 U是同种原子
U是同种原子
Ⅱ.锂的材料在社会生活中广泛应用,如亚氨基锂(Li2NH)是一种储氢容量高、安全性好的固体储氢材料,LiCoO2用作便携式电源的正极材料,碳酸锂(Li2CO3)广泛应用于陶瓷和医药等领域。根据下列要求回答相关问题:
(1)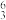 Li和
Li和 Li用作核反应堆最佳载热体,
Li用作核反应堆最佳载热体, LiH和
LiH和 LiD用作高温堆减速剂。下列说法中正确的是
LiD用作高温堆减速剂。下列说法中正确的是_______ (填序号,下同)。
A.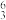 Li和
Li和 Li互为同位素 B
Li互为同位素 B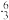 Li和
Li和 Li属于同种核素
Li属于同种核素
C. LiH和
LiH和 LiD的化学性质不同 D.
LiD的化学性质不同 D. LiH和
LiH和 LiD是同种物质
LiD是同种物质
(2)下列说法不正确的是_________ 。
A.碱性:Be(OH)2<LiOH<NaOH<KOH B.半径:K>Na>Li>Li+
C.氧化性:Li+<Na+<K+<Rb+<Cs+ D.金属性:Cs>Rb>K>Na>Li>Be
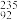 U是重要的核工业原料,在自然界的丰度很低。
U是重要的核工业原料,在自然界的丰度很低。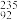 U的浓缩一直为国际社会关注。回答下列有关问题:
U的浓缩一直为国际社会关注。回答下列有关问题:(1)
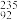 U的中子数是
U的中子数是(2)
 U、
U、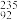 U、
U、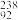 U互为同位素,下列对同位素的理解不正确的是
U互为同位素,下列对同位素的理解不正确的是A.元素符号相同 B.物理性质相同 C.化学性质基本相同 D.在周期表中位置相同
(3)下列有关
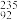 U说法不正确的是
U说法不正确的是A.
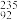 U原子核内中子数与质子数之差为51
U原子核内中子数与质子数之差为51B.
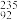 U与
U与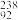 U的质子数、电子数都相等
U的质子数、电子数都相等C.
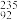 U与
U与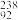 U是两种质子数相同,中子数不同的原子
U是两种质子数相同,中子数不同的原子D.
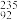 U与
U与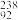 U是同种原子
U是同种原子Ⅱ.锂的材料在社会生活中广泛应用,如亚氨基锂(Li2NH)是一种储氢容量高、安全性好的固体储氢材料,LiCoO2用作便携式电源的正极材料,碳酸锂(Li2CO3)广泛应用于陶瓷和医药等领域。根据下列要求回答相关问题:
(1)
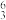 Li和
Li和 Li用作核反应堆最佳载热体,
Li用作核反应堆最佳载热体, LiH和
LiH和 LiD用作高温堆减速剂。下列说法中正确的是
LiD用作高温堆减速剂。下列说法中正确的是A.
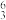 Li和
Li和 Li互为同位素 B
Li互为同位素 B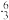 Li和
Li和 Li属于同种核素
Li属于同种核素C.
 LiH和
LiH和 LiD的化学性质不同 D.
LiD的化学性质不同 D. LiH和
LiH和 LiD是同种物质
LiD是同种物质(2)下列说法不正确的是
A.碱性:Be(OH)2<LiOH<NaOH<KOH B.半径:K>Na>Li>Li+
C.氧化性:Li+<Na+<K+<Rb+<Cs+ D.金属性:Cs>Rb>K>Na>Li>Be
您最近一年使用:0次
名校
3 . 铁氮化合物(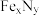 )在磁记录材料领域有着广泛的应用前景。某
)在磁记录材料领域有着广泛的应用前景。某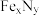 的制备需铁、氮气、丙酮和乙醇参与。
的制备需铁、氮气、丙酮和乙醇参与。
(1) 基态核外电子排布式为
基态核外电子排布式为_______ 。
(2)丙酮(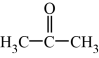 )分子中碳原子轨道的杂化类型是
)分子中碳原子轨道的杂化类型是_______ ,1mol丙酮分子中含有σ键的数目为______________ 。
(3)C、H、O三种元素的电负性由小到大的顺序为_____ 。
(4)乙醇的沸点高于丙酮,这是因为_______ 。
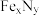 )在磁记录材料领域有着广泛的应用前景。某
)在磁记录材料领域有着广泛的应用前景。某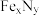 的制备需铁、氮气、丙酮和乙醇参与。
的制备需铁、氮气、丙酮和乙醇参与。(1)
 基态核外电子排布式为
基态核外电子排布式为(2)丙酮(
 )分子中碳原子轨道的杂化类型是
)分子中碳原子轨道的杂化类型是(3)C、H、O三种元素的电负性由小到大的顺序为
(4)乙醇的沸点高于丙酮,这是因为
您最近一年使用:0次
2020-04-08更新
|
125次组卷
|
3卷引用:河南省林州市第一中学2019-2020学年高二4月月考(实验班)化学试题
4 . 锌在工业中有重要作用,也是人体必需的微量元素。回答下列问题:
(1)元素Zn位于元素周期表的________ 族、________ 区;基态Zn原子价层电子的电子排布图(轨道表示式)为________ 。
(2)基态Zn原子核外电子占据最高能层的符号是________ ,占据该能层电子的电子云轮廓图形状为________ 形。
(3)黄铜是人类最早使用的合金之一,主要由Zn和Cu组成,第一电离能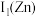
__________  (填“大于”或“小于”)。原因是
(填“大于”或“小于”)。原因是________________ 。
(4)光催化还原 制备
制备 反应中,带状纳米
反应中,带状纳米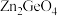 是该反应的良好催化剂。Zn、Ge、O电负性由大至小的顺序是
是该反应的良好催化剂。Zn、Ge、O电负性由大至小的顺序是________________ 。
(1)元素Zn位于元素周期表的
(2)基态Zn原子核外电子占据最高能层的符号是
(3)黄铜是人类最早使用的合金之一,主要由Zn和Cu组成,第一电离能
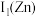
 (填“大于”或“小于”)。原因是
(填“大于”或“小于”)。原因是(4)光催化还原
 制备
制备 反应中,带状纳米
反应中,带状纳米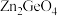 是该反应的良好催化剂。Zn、Ge、O电负性由大至小的顺序是
是该反应的良好催化剂。Zn、Ge、O电负性由大至小的顺序是
您最近一年使用:0次
解题方法
5 . 不锈钢是由铁、铬、镍、碳及众多不同元素所组成的合金,铁是主要成分元素,铬是第一主要的合金元素。其中铬的含量不能低于11%,不然就不能生成致密氧化膜CrO3以防止腐蚀。
(1)基态碳原子的电子排布图为___ 。
(2)铬和镍元素都易形成配位化合物:
①[Cr(H2O)4Cl2]Cl•2H2O中Cr3+的配位数为___ 。
②硫酸镍溶于氨水形成[Ni(NH3)6]SO4蓝色溶液。[Ni(NH3)6]SO4中阴离子的立体构型是___ ,在[Ni(NH3)6]2+中Ni2+与NH3之间形成的化学键称为____ 。
③氨是___ 分子(填“极性”或“非极性”),中心原子的轨道杂化类型为___ ,氨的沸点高于PH3,原因是___ 。
(3)镍元素基态原子的价电子排布式为___ ,3d能级上的未成对电子数为___ 。
(4)单质铜及镍都是由金属键形成的晶体,元素铜与镍的第二电离能分别为:ICu=1958kJ/mol、INi=1753kJ/mol,ICu>INi的原因是___ 。
(5)某镍白铜合金的立方晶胞结构如图所示。若合金的密度为dg/cm3,晶胞参数a=___ nm。

(1)基态碳原子的电子排布图为
(2)铬和镍元素都易形成配位化合物:
①[Cr(H2O)4Cl2]Cl•2H2O中Cr3+的配位数为
②硫酸镍溶于氨水形成[Ni(NH3)6]SO4蓝色溶液。[Ni(NH3)6]SO4中阴离子的立体构型是
③氨是
(3)镍元素基态原子的价电子排布式为
(4)单质铜及镍都是由金属键形成的晶体,元素铜与镍的第二电离能分别为:ICu=1958kJ/mol、INi=1753kJ/mol,ICu>INi的原因是
(5)某镍白铜合金的立方晶胞结构如图所示。若合金的密度为dg/cm3,晶胞参数a=

您最近一年使用:0次
2020-02-12更新
|
793次组卷
|
3卷引用:河南省洛阳市2019-2020学年高二上学期期末考试化学试题
6 . 铁及其化合物用途非常广泛,如二茂铁可用作火箭燃料添加剂,铁酸锶用于直流电机永久陶瓷磁铁。用环戊二烯钠法制备二茂铁(如图)的原理为C5H6+NaOH→C5H5Na+H2O;2C5H5Na+FeCl2→(C5H5)2Fe+2NaCl。

(1)铁元素的基态价电子排布式为________________ 。
(2)基态Na原子中,核外电子占据的最高能级的符号是________ ,占据该能层电子的电子云轮廓图形状为________ 。Na和K属于同一主族,但金属Na的熔点比金属K高,原因是______________ 。
(3)(C5H5)2Fe中阴离子 中的σ键总数为
中的σ键总数为____ 个。分子中的大π键可用符号II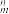 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为Ⅱ
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为Ⅱ ),则
),则 中的大π键应表示为
中的大π键应表示为________________ 。
(4)用二乙胺法合成二茂铁的原料有(C2H5)2NH、FeCl2·4H2O及C5H6。(C2H5)2NH分子中采用sp3杂化的原子是________ ;FeCl2·4H2O是一种配合物,其结构如图所示,Fe2+与配体之间形成的化学键称为____________ 。

(5)铁酸锶的晶胞结构如下图所示:

①晶胞中距离最近的两个氧原子的距离为________ cm(列出计算表达式即可)。
②该晶体的密度为_____________ g·cm-3(列出计算表达式即可)。

(1)铁元素的基态价电子排布式为
(2)基态Na原子中,核外电子占据的最高能级的符号是
(3)(C5H5)2Fe中阴离子
 中的σ键总数为
中的σ键总数为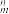 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为Ⅱ
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为Ⅱ ),则
),则 中的大π键应表示为
中的大π键应表示为(4)用二乙胺法合成二茂铁的原料有(C2H5)2NH、FeCl2·4H2O及C5H6。(C2H5)2NH分子中采用sp3杂化的原子是

(5)铁酸锶的晶胞结构如下图所示:

①晶胞中距离最近的两个氧原子的距离为
②该晶体的密度为
您最近一年使用:0次
名校
7 . (1)下列分子或离子中空间构型是V形的是______ (填写序号)。
a.H3O+b.H2O c.NO2+d.NO2-
(2)已知FeCl3的沸点:319℃,熔点:306℃,则FeCl3的晶体类型为_____________ 。P可形成H3PO4、HPO3、H3PO3等多种酸,则这三种酸的酸性由强到弱的顺序为____________ 。(用化学式填写)
(3)原子序数小于36的元素Q和T,在周期表中既处于同一周期又位于同一族,且原子序数T比Q多2。T的基态原子外围电子(价电子)排布式为________ ,Q2+的未成对电子数为__________ 。
(4)右图是从NaCl或CsCl晶体结构图中分割出来的部分结构图,试判断NaCl晶体结构的图象是____ 。
(5)[Cu(NH3)4]2+配离子中存在的化学键类型有___________ (填序号)。
①配位键 ②金属键 ③极性共价键 ④非极性共价键 ⑤离子键 ⑥氢键
若[Cu(NH3)4]2+具有对称的空间构型,且当[Cu(NH3)4]2+中的两个NH3被两个Cl-取代时,能得到两种不同结构的产物,则[Cu(NH3)4]2+的空间构型为____________ (填序号)。
①平面正方形 ②正四面体 ③三角锥形 ④V形
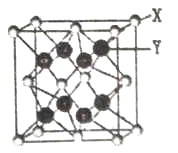
(6)X与Y可形成离子化合物,其晶胞结构如下图所示。其中X离子的配位数为_______ ,若该晶体的密度为pg·cm3, X和Y的相对原子质量分别为a和b,则晶胞中距离最近的X、Y之间的核间距离是_________ cm( 表示阿伏加德罗常数,用含p、a、b、
表示阿伏加德罗常数,用含p、a、b、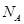 的代数式表达)。
的代数式表达)。
a.H3O+b.H2O c.NO2+d.NO2-
(2)已知FeCl3的沸点:319℃,熔点:306℃,则FeCl3的晶体类型为
(3)原子序数小于36的元素Q和T,在周期表中既处于同一周期又位于同一族,且原子序数T比Q多2。T的基态原子外围电子(价电子)排布式为
(4)右图是从NaCl或CsCl晶体结构图中分割出来的部分结构图,试判断NaCl晶体结构的图象是

(5)[Cu(NH3)4]2+配离子中存在的化学键类型有
①配位键 ②金属键 ③极性共价键 ④非极性共价键 ⑤离子键 ⑥氢键
若[Cu(NH3)4]2+具有对称的空间构型,且当[Cu(NH3)4]2+中的两个NH3被两个Cl-取代时,能得到两种不同结构的产物,则[Cu(NH3)4]2+的空间构型为
①平面正方形 ②正四面体 ③三角锥形 ④V形
(6)X与Y可形成离子化合物,其晶胞结构如下图所示。其中X离子的配位数为
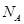 表示阿伏加德罗常数,用含p、a、b、
表示阿伏加德罗常数,用含p、a、b、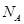 的代数式表达)。
的代数式表达)。
您最近一年使用:0次
2016-12-09更新
|
277次组卷
|
3卷引用:2015届河南省商丘市高三上学期第二次模拟理综化学试卷
9-10高二下·河南郑州·期末
解题方法
8 . 一种离子晶体的晶胞如图。其中阳离子A以 表示,阴离子B以
表示,阴离子B以 表示。
表示。

(1)每个晶胞种含A离子的数目为________ ,含B离子数目为________ 。
(2)若A的核外电子排布与Ar相同,B的电子排布与Ne相同,则该离子化合物的化学式是___________________ ;
(3)阳离子的配位数为_________ ,阴离子的配位数为________ 。
(4)已知A的离子半径为0.99×10-10m,则该晶胞的体积是_______________ m3。
 表示,阴离子B以
表示,阴离子B以 表示。
表示。
(1)每个晶胞种含A离子的数目为
(2)若A的核外电子排布与Ar相同,B的电子排布与Ne相同,则该离子化合物的化学式是
(3)阳离子的配位数为
(4)已知A的离子半径为0.99×10-10m,则该晶胞的体积是
您最近一年使用:0次



