名校
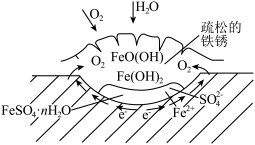
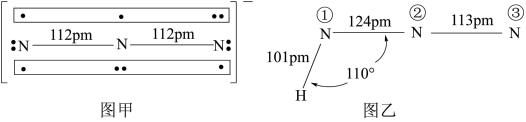
1 . 铁的化学性质比较活泼,能形成众多化合物,铁的合金是使用量最大的合金。铁制品易生锈,锈层内有硫酸盐时的腐蚀原理如图所示。 的价电子排布式为
的价电子排布式为___________ 。
(2) 的空间构型是
的空间构型是___________ ,图中属于非极性分子的是___________ (填化学式)。
(3)冰融化时需要克服的作用力类型是___________ 。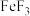 的熔点为1000℃,
的熔点为1000℃, 的熔点为200℃,则两种物质中的化学键类型
的熔点为200℃,则两种物质中的化学键类型___________ (填“相同”或“不同”)。
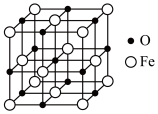
(4)铁能形成多种氧化物,其中一种氧化物的晶胞结构如图所示:___________ ,该氧化物的化学式为___________ 。
②设 表示阿伏加德罗常数的值,若该晶胞的参数为a nm,则该晶体的密度为
表示阿伏加德罗常数的值,若该晶胞的参数为a nm,则该晶体的密度为___________  (用含a、
(用含a、 的代数式表示)。
的代数式表示)。
 的价电子排布式为
的价电子排布式为(2)
 的空间构型是
的空间构型是(3)冰融化时需要克服的作用力类型是
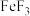 的熔点为1000℃,
的熔点为1000℃, 的熔点为200℃,则两种物质中的化学键类型
的熔点为200℃,则两种物质中的化学键类型(4)铁能形成多种氧化物,其中一种氧化物的晶胞结构如图所示:
②设
 表示阿伏加德罗常数的值,若该晶胞的参数为a nm,则该晶体的密度为
表示阿伏加德罗常数的值,若该晶胞的参数为a nm,则该晶体的密度为 (用含a、
(用含a、 的代数式表示)。
的代数式表示)。
您最近半年使用:0次
2 . 氰化钾是一种剧毒的物质,贮存和使用时必须注意安全。已知: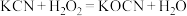 。回答下列问题:
。回答下列问题:
(1)KCN的电子式为______ 。
(2)KOCN中K、O、C、N的电负性由大到小的顺序为______ (用元素符号表示),1mol 中含有的
中含有的 键数目为
键数目为______ , 的空间结构为
的空间结构为______ 。
(3)① 与
与 相似,分子中的共价键类型为
相似,分子中的共价键类型为______ (填“ 键”或“
键”或“ 键”),
键”), 在水中的溶解度比
在水中的溶解度比 的小,其主要原因为
的小,其主要原因为______ 。
② 和
和 结构如图所示。
结构如图所示。

请说明 中
中 略大于
略大于 的原因:
的原因:______ 。
(4) 中
中 结构如图甲,
结构如图甲, 中存在两个大
中存在两个大 键可用符号
键可用符号 (3个原子共享4个电子)表示,一个
(3个原子共享4个电子)表示,一个 中键合电子(形成化学键的电子)总数为
中键合电子(形成化学键的电子)总数为______ 。叠氮酸( )结构如图乙,分子中②号N原子的杂化方式为
)结构如图乙,分子中②号N原子的杂化方式为______ ,叠氮酸( )在常温下是液体,沸点相对较高,为308.8K,主要原因是
)在常温下是液体,沸点相对较高,为308.8K,主要原因是______ 。
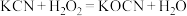 。回答下列问题:
。回答下列问题:(1)KCN的电子式为
(2)KOCN中K、O、C、N的电负性由大到小的顺序为
 中含有的
中含有的 键数目为
键数目为 的空间结构为
的空间结构为(3)①
 与
与 相似,分子中的共价键类型为
相似,分子中的共价键类型为 键”或“
键”或“ 键”),
键”), 在水中的溶解度比
在水中的溶解度比 的小,其主要原因为
的小,其主要原因为②
 和
和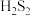 结构如图所示。
结构如图所示。
请说明
 中
中 略大于
略大于 的原因:
的原因:(4)
 中
中 结构如图甲,
结构如图甲, 中存在两个大
中存在两个大 键可用符号
键可用符号 (3个原子共享4个电子)表示,一个
(3个原子共享4个电子)表示,一个 中键合电子(形成化学键的电子)总数为
中键合电子(形成化学键的电子)总数为 )结构如图乙,分子中②号N原子的杂化方式为
)结构如图乙,分子中②号N原子的杂化方式为 )在常温下是液体,沸点相对较高,为308.8K,主要原因是
)在常温下是液体,沸点相对较高,为308.8K,主要原因是
您最近半年使用:0次
3 .  与一定量的水形成晶体
与一定量的水形成晶体 ,Q在一定条件下可转化为R:
,Q在一定条件下可转化为R:

回答下列问题:
(1)元素B位于元素周期表的第______ 周期,第______ 族。其常见化合价应为______ 价。B的原子结构示意图是______ 。
(2) 的电子式为
的电子式为______ ,每个R的阴离子中含有极性键的数目为______ 。 的形成过程,可用电子式表示为
的形成过程,可用电子式表示为______ 。上述Q和R的转化属于______ 变化(填“物理”或“化学”)。
(3)HF气体的稳定性______ HCl气体(填“>”或“<”)。已知 ,该反应的还原剂是
,该反应的还原剂是______ ,氧化产物是______ 。
(4)若不慎将KOH溶液沾到皮肤上,应立即用大量水冲洗,然后涂上1%的硼酸。已知硼酸( )在水溶液中呈现酸性的原因是:
)在水溶液中呈现酸性的原因是: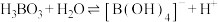 。则按照酸类物质常用的分类方法,硼酸应属于
。则按照酸类物质常用的分类方法,硼酸应属于______ 元酸。它与KOH溶液反应的离子方程式为____________ 。
 与一定量的水形成晶体
与一定量的水形成晶体 ,Q在一定条件下可转化为R:
,Q在一定条件下可转化为R:
回答下列问题:
(1)元素B位于元素周期表的第
(2)
 的电子式为
的电子式为 的形成过程,可用电子式表示为
的形成过程,可用电子式表示为(3)HF气体的稳定性
 ,该反应的还原剂是
,该反应的还原剂是(4)若不慎将KOH溶液沾到皮肤上,应立即用大量水冲洗,然后涂上1%的硼酸。已知硼酸(
 )在水溶液中呈现酸性的原因是:
)在水溶液中呈现酸性的原因是: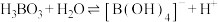 。则按照酸类物质常用的分类方法,硼酸应属于
。则按照酸类物质常用的分类方法,硼酸应属于
您最近半年使用:0次
解题方法
4 . 开发新型材料是现在科学研究的一项重要工作,科学家开发一种形状记忆陶瓷,它的主要原材料是纳米级ZrO2.用锆石ZrSiO4(含少量FeO、Al2O3、SiO2和CuO)制备纳米级ZrO2的流程设计如图:
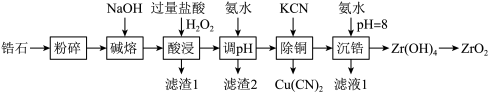
回答下列问题:
(1)锆石杂质中含锆元素,基态Cu的价电子排布式为___________ ,锆石杂质中含铁元素,已知Fe2+易被氧化为Fe3+,原因是___________ 。(从原子结构角度解释)
(2)碱熔过程中有多种物质能发生反应,写出其中一个反应方程式___________ 。
(3)“酸浸”过程中FeO发生氧化还原反应的离子方程式为___________ ,滤渣1经回收加工后有多种用途,写出其中一种___________ 。
(4)久置H2O2浓度需要标定。取xmLH2O2溶液,用amol/LCe(SO4)2溶液滴定H2O2,完全反应转化为Ce2(SO4)3时,消耗bmLCe(SO4)2溶液。则H2O2溶液的浓度为:___________ mol/L。
(5)易溶氰化物有剧毒,需对滤液1中的氰化物进行处理,选用次氯酸钠溶液在碱性条件下将其氧化,其中一种产物为空气的主要成分,写出其离子反应方程式___________ 。
(6)ZrO2的晶胞结构如图所示。
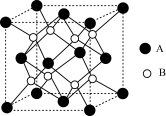
①其中B表示___________ (填O2-或Zr4+)。
②ZrO2晶胞的棱长分别为anm、anm、cnm,其晶体密度为___________ g/cm3(列算式用NA表示阿伏加德罗常数的值)。

回答下列问题:
(1)锆石杂质中含锆元素,基态Cu的价电子排布式为
(2)碱熔过程中有多种物质能发生反应,写出其中一个反应方程式
(3)“酸浸”过程中FeO发生氧化还原反应的离子方程式为
(4)久置H2O2浓度需要标定。取xmLH2O2溶液,用amol/LCe(SO4)2溶液滴定H2O2,完全反应转化为Ce2(SO4)3时,消耗bmLCe(SO4)2溶液。则H2O2溶液的浓度为:
(5)易溶氰化物有剧毒,需对滤液1中的氰化物进行处理,选用次氯酸钠溶液在碱性条件下将其氧化,其中一种产物为空气的主要成分,写出其离子反应方程式
(6)ZrO2的晶胞结构如图所示。

①其中B表示
②ZrO2晶胞的棱长分别为anm、anm、cnm,其晶体密度为
您最近半年使用:0次
2024-01-18更新
|
517次组卷
|
2卷引用:河南省商丘市宁陵县东关高中2023-2024学年高二下学期第一次月考 化学试题
名校
解题方法
5 . 我国力争在2030年前实现“碳达峰”。2060年前实现“碳中和”的目标,因此二氧化碳的固定及转化成了重要的研究课题。
Ⅰ.在 催化作用下
催化作用下 和
和 反应生成甲醇:
反应生成甲醇: ;
;
Ⅱ.新型 水介质电池放电时,温室气体
水介质电池放电时,温室气体 被转化为储能物质
被转化为储能物质 。
。
请回答下列问题:
(1)基态Cu原子的外围电子排布式为___________ ,基态O原子核外有___________ 种不同运动状态的电子。
(2)Ⅰ中涉及的 、
、 、
、 、
、 ,属于非极性分子的是
,属于非极性分子的是___________ (填化学式)。
(3) 分子中碳原子的杂化轨道类型为
分子中碳原子的杂化轨道类型为___________ ,分子中含有的 键和
键和 键数目之比为
键数目之比为___________ 。
(4) 反应中,
反应中, 的立体构型为
的立体构型为___________ , 的沸点高于
的沸点高于 的原因是
的原因是___________ 。
(5)氧化锌(ZnO),俗称锌白,是一种常用的化学添加剂,广泛地应用于塑料、硅酸盐制品、合成橡胶等产品的制作中。一种ZnO的立方晶胞如图所示。
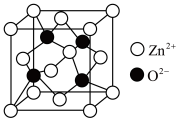
① 周围距离最近且等距的
周围距离最近且等距的 数目为
数目为___________ 。
②设晶胞边长为anm, 为阿伏加德罗常数的值,该晶体的密度为
为阿伏加德罗常数的值,该晶体的密度为___________  。
。
Ⅰ.在
 催化作用下
催化作用下 和
和 反应生成甲醇:
反应生成甲醇: ;
;Ⅱ.新型
 水介质电池放电时,温室气体
水介质电池放电时,温室气体 被转化为储能物质
被转化为储能物质 。
。请回答下列问题:
(1)基态Cu原子的外围电子排布式为
(2)Ⅰ中涉及的
 、
、 、
、 、
、 ,属于非极性分子的是
,属于非极性分子的是(3)
 分子中碳原子的杂化轨道类型为
分子中碳原子的杂化轨道类型为 键和
键和 键数目之比为
键数目之比为(4)
 反应中,
反应中, 的立体构型为
的立体构型为 的沸点高于
的沸点高于 的原因是
的原因是(5)氧化锌(ZnO),俗称锌白,是一种常用的化学添加剂,广泛地应用于塑料、硅酸盐制品、合成橡胶等产品的制作中。一种ZnO的立方晶胞如图所示。

①
 周围距离最近且等距的
周围距离最近且等距的 数目为
数目为②设晶胞边长为anm,
 为阿伏加德罗常数的值,该晶体的密度为
为阿伏加德罗常数的值,该晶体的密度为 。
。
您最近半年使用:0次
2023-07-30更新
|
888次组卷
|
4卷引用:河南省商丘市宁陵县东关高中2023-2024学年高二下学期第一次月考 化学试题
名校
6 . 该反应曾用于检测司机是否酒后驾驶:2Cr2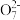 +3CH3CH2OH+16H++13H2O=4[Cr(H2O)6]3++3CH3COOH
+3CH3CH2OH+16H++13H2O=4[Cr(H2O)6]3++3CH3COOH
(1)基态Cr3+的核外电子排布式为_______ ;配合离子[Cr(H2O)6]3+中,与Cr3+形成配位键的原子是_______ (填元素符号)。
(2)CH3COOH中C原子的杂化轨道类型为_______ 和_______ ;1molCH3COOH分子中含有σ键的数目为_______ 。
(3)H2O与CH3CH2OH可以任意比例互溶,原因是_______ 、_______ (回答两点)。
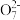 +3CH3CH2OH+16H++13H2O=4[Cr(H2O)6]3++3CH3COOH
+3CH3CH2OH+16H++13H2O=4[Cr(H2O)6]3++3CH3COOH(1)基态Cr3+的核外电子排布式为
(2)CH3COOH中C原子的杂化轨道类型为
(3)H2O与CH3CH2OH可以任意比例互溶,原因是
您最近半年使用:0次
7 . 迁移类比是化学学习过程中常用重要的方法,也是化学学科考查的常见角度与出发点。试运用所学的化学知识回答下列问题:
(1)N2和CO是等电子体,具有相似的分子结构,则CO的电子式是____ 。
(2)H2O和NH3都是含有强极性键的极性分子,纯液态时均能发生自偶电离,将金属Na投入到液氨中可以发生反应,则反应生成的含钠化合物的化学式为____ 。
(3)铍和铝两种元素在周期表中的位置处于对角线位置,性质符合对角线规则,铍和铝都是两性金属,试写出铍单质与NaOH溶液反应的化学方程式____ 。
(4)强酸制弱酸是重要的物质转化规律,已知亚硫酸酸性强于次氯酸,现向NaClO溶液中通入足量SO2,能否得到次氯酸并说明理由____ (试结合化学用语来说明)。
(5)相似相溶规律通常的说法是“极性相似的两者互溶度大”,还有一种表述:“结构相似者可能互溶”。必修二课本中在讲述乙醇性质时,说:乙醇能与水以任意比互溶。已知含碳原子数较少的RCOOH(羧酸)也易溶于水的主要原因是____ (从结构角度分析)。
(6)金属单质发生置换反应时,通常是还原性强的金属置换出还原性弱的金属。在工业制钾时,常常用金属钠与氯化钾在熔融状态下发生置换制得钾,其利用的原理是____ 。
(1)N2和CO是等电子体,具有相似的分子结构,则CO的电子式是
(2)H2O和NH3都是含有强极性键的极性分子,纯液态时均能发生自偶电离,将金属Na投入到液氨中可以发生反应,则反应生成的含钠化合物的化学式为
(3)铍和铝两种元素在周期表中的位置处于对角线位置,性质符合对角线规则,铍和铝都是两性金属,试写出铍单质与NaOH溶液反应的化学方程式
(4)强酸制弱酸是重要的物质转化规律,已知亚硫酸酸性强于次氯酸,现向NaClO溶液中通入足量SO2,能否得到次氯酸并说明理由
(5)相似相溶规律通常的说法是“极性相似的两者互溶度大”,还有一种表述:“结构相似者可能互溶”。必修二课本中在讲述乙醇性质时,说:乙醇能与水以任意比互溶。已知含碳原子数较少的RCOOH(羧酸)也易溶于水的主要原因是
(6)金属单质发生置换反应时,通常是还原性强的金属置换出还原性弱的金属。在工业制钾时,常常用金属钠与氯化钾在熔融状态下发生置换制得钾,其利用的原理是
您最近半年使用:0次
解题方法
8 . 东晋《华阳国志·南中志》卷四中已有关于白铜的记载,云南镍白铜闻名中外,曾主要用于造币,亦可用于制作仿银饰品。回答下列问题:
(1)镍元素基态原子的电子排布式为___________ ,3d能级上的未成对电子数为___________ 。
(2)硫酸镍溶于氨水形成 蓝色溶液。
蓝色溶液。
① 中
中 的空间立体构型是
的空间立体构型是___________ 。
②在 中
中 与
与 之间形成的化学键称为
之间形成的化学键称为___________ 。
③氨的沸点___________ (填“高于”或“低于”)膦( ),原因是
),原因是___________ 。氨分子中,中心原子的轨道杂化类型为___________ 。
(1)镍元素基态原子的电子排布式为
(2)硫酸镍溶于氨水形成
 蓝色溶液。
蓝色溶液。①
 中
中 的空间立体构型是
的空间立体构型是②在
 中
中 与
与 之间形成的化学键称为
之间形成的化学键称为③氨的沸点
 ),原因是
),原因是
您最近半年使用:0次
9 . 开发新型储氢材料是开发利用氢能的重要研究方向。
(1) ,是一种储氢材料,可由
,是一种储氢材料,可由 和
和 反应制得。
反应制得。
①基态 原子中,电子占据的最高能级符号为
原子中,电子占据的最高能级符号为___________ ,原子核外电子有___________ 种空间运动状态。
② 、B、H元素的电负性由大到小的排列顺序为
、B、H元素的电负性由大到小的排列顺序为___________ 。
(2)金属氢化物是具有良好发展前景的储氢材料。
① 中,离子半径:
中,离子半径:
___________ (填“>”“=”或“<”) ,原因是
,原因是___________ 。
②某储氢材料是短周期金属元素M的氢化物。M原子的部分电离能如表所示:
则M是___________ (填元素名称)。下列状态的粒子中,电离出最外层一个电子所需能量最大的是___________ (填字母)。

A. B.
B. C.
C.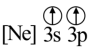 D.
D.
(3)碳有很多同素异形体, 就是其中一种,可用作储氢材料。已知金刚石为立体网状结构,其
就是其中一种,可用作储氢材料。已知金刚石为立体网状结构,其 键的键长为
键的键长为 ,
, 分子中
分子中 键键长为
键键长为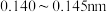 ,有同学据此认为
,有同学据此认为 的熔点高于金刚石,你认为是否正确?
的熔点高于金刚石,你认为是否正确?___________ ,阐述理由:___________ 。
(1)
 ,是一种储氢材料,可由
,是一种储氢材料,可由 和
和 反应制得。
反应制得。①基态
 原子中,电子占据的最高能级符号为
原子中,电子占据的最高能级符号为②
 、B、H元素的电负性由大到小的排列顺序为
、B、H元素的电负性由大到小的排列顺序为(2)金属氢化物是具有良好发展前景的储氢材料。
①
 中,离子半径:
中,离子半径:
 ,原因是
,原因是②某储氢材料是短周期金属元素M的氢化物。M原子的部分电离能如表所示:
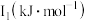 | 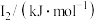 | 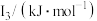 | 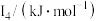 | 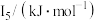 |
| 738 | 1451 | 7733 | 10540 | 13630 |
则M是

A.
 B.
B. C.
C. D.
D.
(3)碳有很多同素异形体,
 就是其中一种,可用作储氢材料。已知金刚石为立体网状结构,其
就是其中一种,可用作储氢材料。已知金刚石为立体网状结构,其 键的键长为
键的键长为 ,
, 分子中
分子中 键键长为
键键长为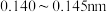 ,有同学据此认为
,有同学据此认为 的熔点高于金刚石,你认为是否正确?
的熔点高于金刚石,你认为是否正确?
您最近半年使用:0次
名校
解题方法
10 . 有A、B、C、D、E、F六种微粒,它们都含有10个电子,已知A+B=2C;A+D=E+C;2A+F=G↓;G中含有30个电子。试推断后回答:
(1)A、B、E的电子式:A________ B________ E________
(2)C、D、的化学符号:C________ D________
(1)A、B、E的电子式:A
(2)C、D、的化学符号:C
您最近半年使用:0次



