名校
1 . 中学常见的有机物:乙烷、乙烯、溴乙烷、乙醇、苯酚、乙酸、乙酸乙酯。
(1)物质结构
①7种物质的分子中只含有 键的是
键的是___________ 。
②7种物质的分子中,所有原子一定都在同一平面的物质的结构简式为___________ 。
(2)物理性质
①常温下,溴乙烷的水溶性___________ (填“大于”、“等于”或“小于”)乙醇,原因可能是___________ 。
②下列烷烃的沸点从低到高的顺序为:___________ (用字母序号表示)。
a.异丁烷 b.正丁烷 c.乙烷 d.丙烷
(3)物质转化
醇与氢卤酸反应是制备卤代烃的重要方法。实验室制备溴乙烷的反应如下:
 ①
①
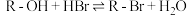 ②
②
有关数据列表如下:
①得到的溴乙烷中含有少量乙醇,为了制得纯净的溴乙烷,可用蒸馏水洗涤,分液后再加入无水 ,然后进行的实验操作是
,然后进行的实验操作是___________ (填字母序号)。
a.分液 b.蒸馏 c.萃取
②将溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物在___________ (填“上层”、“下层”或“不分层”)。
③为了检验溴乙烷中含有溴元素,通常采用的方法是:取少量溴乙烷,进行下列操作:
①加热 ②加入 溶液 ③加入稀
溶液 ③加入稀 酸化 ④加入
酸化 ④加入 溶液
溶液
下列操作顺序合理的是___________ (填字母序号)。
a.①②③④ B.②③①④ C.④①③② d.①④②③
④在制备溴乙烷时,采用边反应边蒸出产物的方法,原因是___________ 。
(4)性质比较
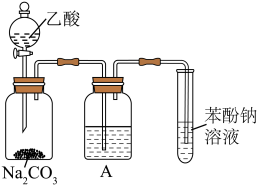
某同学用如图所示装置比较乙酸、苯酚、碳酸的酸性强弱,实验进行一段时间后,盛有苯酚钠溶液的试管中溶液变浑浊。___________ 。
② 中盛放的溶液是
中盛放的溶液是___________ 。
③苯酚钠溶液中发生反应的化学方程式为___________ 。
(1)物质结构
①7种物质的分子中只含有
 键的是
键的是②7种物质的分子中,所有原子一定都在同一平面的物质的结构简式为
(2)物理性质
①常温下,溴乙烷的水溶性
②下列烷烃的沸点从低到高的顺序为:
a.异丁烷 b.正丁烷 c.乙烷 d.丙烷
(3)物质转化
醇与氢卤酸反应是制备卤代烃的重要方法。实验室制备溴乙烷的反应如下:
 ①
①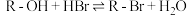 ②
②有关数据列表如下:
| 乙醇 | 溴乙烷 | |
密度/ | 0.7893 | 1.4604 |
沸点/ | 78.5 | 38.4 |
 ,然后进行的实验操作是
,然后进行的实验操作是a.分液 b.蒸馏 c.萃取
②将溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物在
③为了检验溴乙烷中含有溴元素,通常采用的方法是:取少量溴乙烷,进行下列操作:
①加热 ②加入
 溶液 ③加入稀
溶液 ③加入稀 酸化 ④加入
酸化 ④加入 溶液
溶液下列操作顺序合理的是
a.①②③④ B.②③①④ C.④①③② d.①④②③
④在制备溴乙烷时,采用边反应边蒸出产物的方法,原因是
(4)性质比较
某同学用如图所示装置比较乙酸、苯酚、碳酸的酸性强弱,实验进行一段时间后,盛有苯酚钠溶液的试管中溶液变浑浊。
②
 中盛放的溶液是
中盛放的溶液是③苯酚钠溶液中发生反应的化学方程式为
您最近半年使用:0次
名校
解题方法
2 . 硫是一种重要的非金属元素,硫及其化合物在生产生活中有广泛的应用。
(1)按照原子的核外电子排布可把元素周期表划分成5个区,硫元素位于_____ 区。
(2) 分子的空间结构为
分子的空间结构为_____ 形。
(3) 中S原子的杂化类型是
中S原子的杂化类型是_____ 杂化。由于孤电子对之间有较大斥力,因此 中的键角(
中的键角(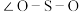 )
)_____ (填“>”或“<”) 中的键角(
中的键角(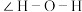 )。
)。
(1)按照原子的核外电子排布可把元素周期表划分成5个区,硫元素位于
(2)
 分子的空间结构为
分子的空间结构为(3)
 中S原子的杂化类型是
中S原子的杂化类型是 中的键角(
中的键角(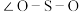 )
) 中的键角(
中的键角(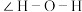 )。
)。
您最近半年使用:0次
解题方法
3 . 硼的化合物有重要应用。
(1)写出基态B的电子排布式___________ 。
(2)硼酸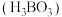 的结构如图所示。在水溶液中硼酸的电离方程式:
的结构如图所示。在水溶液中硼酸的电离方程式: ,25℃时
,25℃时 。
。
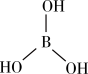
①将“ ”视为一个原子,硼酸分子的空间结构名称为
”视为一个原子,硼酸分子的空间结构名称为___________ 。
② 中,
中, 原子的杂化轨道类型为
原子的杂化轨道类型为___________ ;其中一条 键是配位键,电子对由
键是配位键,电子对由___________ 原子提供。
(3)硼砂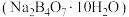 在水溶液中可以解离出等物质的量浓度的
在水溶液中可以解离出等物质的量浓度的 和
和 ,该溶液在一定温度下具有固定的pH,可作为校准pH计的标准溶液。计算常温下
,该溶液在一定温度下具有固定的pH,可作为校准pH计的标准溶液。计算常温下 硼砂溶液的
硼砂溶液的
___________ 。
(4)氨硼烷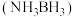 含氢量高、热稳定性好,是一种具有潜力的固体储攽材料。
含氢量高、热稳定性好,是一种具有潜力的固体储攽材料。
①氨硼烷中N为-3价,B为+3价。H、B、N的电负性由大到小依次为___________ 。
②氨硼烷在催化剂作用下水解释放氢气,用单线桥表示该反应的电子转移。

___________
③氨硼烷分子间存在“双氢键”使氨硼烷的熔点明显升高。“双氢键”能形成的原因是___________ 。
(1)写出基态B的电子排布式
(2)硼酸
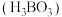 的结构如图所示。在水溶液中硼酸的电离方程式:
的结构如图所示。在水溶液中硼酸的电离方程式: ,25℃时
,25℃时 。
。
①将“
 ”视为一个原子,硼酸分子的空间结构名称为
”视为一个原子,硼酸分子的空间结构名称为②
 中,
中, 原子的杂化轨道类型为
原子的杂化轨道类型为 键是配位键,电子对由
键是配位键,电子对由(3)硼砂
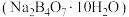 在水溶液中可以解离出等物质的量浓度的
在水溶液中可以解离出等物质的量浓度的 和
和 ,该溶液在一定温度下具有固定的pH,可作为校准pH计的标准溶液。计算常温下
,该溶液在一定温度下具有固定的pH,可作为校准pH计的标准溶液。计算常温下 硼砂溶液的
硼砂溶液的
(4)氨硼烷
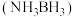 含氢量高、热稳定性好,是一种具有潜力的固体储攽材料。
含氢量高、热稳定性好,是一种具有潜力的固体储攽材料。①氨硼烷中N为-3价,B为+3价。H、B、N的电负性由大到小依次为
②氨硼烷在催化剂作用下水解释放氢气,用单线桥表示该反应的电子转移。

③氨硼烷分子间存在“双氢键”使氨硼烷的熔点明显升高。“双氢键”能形成的原因是
您最近半年使用:0次
名校
解题方法
4 . 氢能源是一种不依赖化石燃料的储量丰富的清洁能源。
(1)化石燃料中天然气的主要成分是甲烷,甲烷的结构式为___________ 。
(2)我国科学家研发了以负载氧化镍纳米晶粒的聚合物氮化碳二维纳米材料为催化剂的高效电解水制氢技术。
①Ni元素的原子序数为___________ 。
②C、N、O的电负性的由大到小的顺序是___________ 。
③为寻找更多的金属催化剂,科学家从众多金属元素中选取Co、Fe、Cu进行了相关研究,并取得了成功。选取这三种金属进行相关研究的原因可能是___________ 。
(3)开发新型储氢材料是氢能利用的重要研究方向。氨硼烷( )是一种潜在的储氢材料,可由
)是一种潜在的储氢材料,可由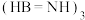 (结构为平面六元环状)通过如下反应制得:
(结构为平面六元环状)通过如下反应制得:
①从分子结构解释 、
、 、
、 的键角依次减小的原因
的键角依次减小的原因___________ 。
②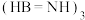 中N原子的杂化方式为
中N原子的杂化方式为___________ 。
③ 中N、B都达到稳定结构,
中N、B都达到稳定结构, 的结构式为(用→表示出配位键)
的结构式为(用→表示出配位键)___________ 。
(4)有储氢功能的铜银合金晶体具有立方堆积结构,晶胞中Cu原子位于面心,Ag原子位于顶点,氢原子位于由Cu原子与Ag原子构成的全部四面体中。
①该晶体储氢后的化学式为___________ 。
②已知: ;
; 表示阿伏加德罗常数的值。若该立方晶胞的边长为apm,忽略吸氢前后晶胞的体积变化,标准状况下氢气的密度为
表示阿伏加德罗常数的值。若该立方晶胞的边长为apm,忽略吸氢前后晶胞的体积变化,标准状况下氢气的密度为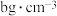 ,则该储氢材料的储氢能力为
,则该储氢材料的储氢能力为___________ (用含有a、b和 的代数式表示)。
的代数式表示)。
(1)化石燃料中天然气的主要成分是甲烷,甲烷的结构式为
(2)我国科学家研发了以负载氧化镍纳米晶粒的聚合物氮化碳二维纳米材料为催化剂的高效电解水制氢技术。
①Ni元素的原子序数为
②C、N、O的电负性的由大到小的顺序是
③为寻找更多的金属催化剂,科学家从众多金属元素中选取Co、Fe、Cu进行了相关研究,并取得了成功。选取这三种金属进行相关研究的原因可能是
(3)开发新型储氢材料是氢能利用的重要研究方向。氨硼烷(
 )是一种潜在的储氢材料,可由
)是一种潜在的储氢材料,可由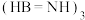 (结构为平面六元环状)通过如下反应制得:
(结构为平面六元环状)通过如下反应制得:
①从分子结构解释
 、
、 、
、 的键角依次减小的原因
的键角依次减小的原因②
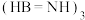 中N原子的杂化方式为
中N原子的杂化方式为③
 中N、B都达到稳定结构,
中N、B都达到稳定结构, 的结构式为(用→表示出配位键)
的结构式为(用→表示出配位键)(4)有储氢功能的铜银合金晶体具有立方堆积结构,晶胞中Cu原子位于面心,Ag原子位于顶点,氢原子位于由Cu原子与Ag原子构成的全部四面体中。
①该晶体储氢后的化学式为
②已知:
 ;
; 表示阿伏加德罗常数的值。若该立方晶胞的边长为apm,忽略吸氢前后晶胞的体积变化,标准状况下氢气的密度为
表示阿伏加德罗常数的值。若该立方晶胞的边长为apm,忽略吸氢前后晶胞的体积变化,标准状况下氢气的密度为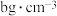 ,则该储氢材料的储氢能力为
,则该储氢材料的储氢能力为 的代数式表示)。
的代数式表示)。
您最近半年使用:0次
名校
5 . 与溶液条件相比,晶体条件下发生的反应有产物选择性高、易于分离提纯等优点。

(1)氟元素在有机晶体化学领域的研究和应用中有重要价值。
①氟元素在元素周期表中的位置为___________ ,六氟苯中碳原子的杂化方式为___________ 。
②苯环上的电子云密度:苯___________ 六氟苯(填“>”或“<”),依据电负性解释其原因:___________ 。
(2)分子间作用力影响晶体中分子的堆积方式,进而影响物质的性质和反应的选择性。
①已知:苯和六氟苯的熔点分别为5.5oC和5.2oC,将二者混合后得到的“混晶”(二者比例为1:1),其熔点上升至23.7oC。
三种晶体中的分子间作用力最大的是___________ (填“苯”、“六氟苯”或“混晶”)。
②已知:紫外光下,两个碳碳双键可加成为四元环(环丁烷)的结构。
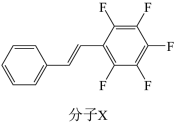
紫外光下,分子X在溶液条件下反应得到2种互为同分异构体的加成产物,在晶体条件下只能生成1种加成产物Z,推测Z的结构简式为___________ (不考虑立体异构)。
(3)A与B经以下两种途径均可获得E。

已知:―N3与―C≡CH在铜盐催化条件下可发生加成反应得到含 结构的分子。E的结构简式为
结构的分子。E的结构简式为___________ 。

(1)氟元素在有机晶体化学领域的研究和应用中有重要价值。
①氟元素在元素周期表中的位置为
②苯环上的电子云密度:苯
(2)分子间作用力影响晶体中分子的堆积方式,进而影响物质的性质和反应的选择性。
①已知:苯和六氟苯的熔点分别为5.5oC和5.2oC,将二者混合后得到的“混晶”(二者比例为1:1),其熔点上升至23.7oC。
三种晶体中的分子间作用力最大的是
②已知:紫外光下,两个碳碳双键可加成为四元环(环丁烷)的结构。
紫外光下,分子X在溶液条件下反应得到2种互为同分异构体的加成产物,在晶体条件下只能生成1种加成产物Z,推测Z的结构简式为

(3)A与B经以下两种途径均可获得E。

已知:―N3与―C≡CH在铜盐催化条件下可发生加成反应得到含
 结构的分子。E的结构简式为
结构的分子。E的结构简式为
您最近半年使用:0次
6 . NOx是汽车尾气中的主要污染物,在汽车尾气系统中装配催化转化器,可有效降低NOx的排放。
(1)当尾气中空气不足时,NOx(以NO为主)在催化转化器中被CO还原成N2排出。
①基态碳原子中,电子占据最高能级的电子云轮廓图的形状是_____ 。
②已知NO微溶于水,可溶于CS2的可能原因是_____ 。
(2)当尾气中空气过量时,催化转化器中的金属氧化物吸收NOx生成盐。其吸收能力顺序如下:12MgO<20CaO<38SrO<56BaO。研究表明:这几种元素的金属性逐渐增强,第一电离能逐渐减弱,金属氧化物对NOx的吸收能力逐渐增强。请解释这几种金属第一电离能逐渐减弱的原因是_____ 。
(3)研究TiO2作为SCR脱硝催化剂的性能时发现:在TiO2上适当掺杂不同的金属氧化物如V2O5、MnOx、Fe2O3、NiO、CuO等有利于提高催化脱硝性能。
①基态V原子的核外电子排布式为_____ 。
②若继续寻找使TiO2催化性能更好的杂金属氧化物,可以在元素周期表_____ 区寻找恰当元素(填序号)。
A.s B.p C.d D.ds
(1)当尾气中空气不足时,NOx(以NO为主)在催化转化器中被CO还原成N2排出。
①基态碳原子中,电子占据最高能级的电子云轮廓图的形状是
②已知NO微溶于水,可溶于CS2的可能原因是
(2)当尾气中空气过量时,催化转化器中的金属氧化物吸收NOx生成盐。其吸收能力顺序如下:12MgO<20CaO<38SrO<56BaO。研究表明:这几种元素的金属性逐渐增强,第一电离能逐渐减弱,金属氧化物对NOx的吸收能力逐渐增强。请解释这几种金属第一电离能逐渐减弱的原因是
(3)研究TiO2作为SCR脱硝催化剂的性能时发现:在TiO2上适当掺杂不同的金属氧化物如V2O5、MnOx、Fe2O3、NiO、CuO等有利于提高催化脱硝性能。
①基态V原子的核外电子排布式为
②若继续寻找使TiO2催化性能更好的杂金属氧化物,可以在元素周期表
A.s B.p C.d D.ds
您最近半年使用:0次
名校
解题方法
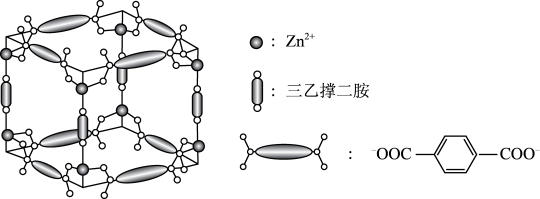
7 .  、三乙撑二胺和对苯二甲酸根离子可形成晶体M,其晶胞示意图如下。
、三乙撑二胺和对苯二甲酸根离子可形成晶体M,其晶胞示意图如下。
(1) 的价层电子排布式是
的价层电子排布式是___________ 。
(2)C、N、O的电负性从大到小 的顺序是___________ ;C、N、O的第一电离能从大到小 的顺序是___________ 。
(3)三乙撑二胺(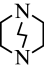 )与
)与 能形成配位键的原因是
能形成配位键的原因是___________ 。
(4)下列事实可用“水分子间存在氢键”解释的是___________ (填字母序号 )。
a.常压下,4℃时水的密度最大
b.水的沸点比硫化氢的沸点高160℃
c.水的热稳定性比硫化氢强
(5)对苯二甲酸( )中苯环上的碳原子的杂化方式为
)中苯环上的碳原子的杂化方式为___________ ,羧基上碳原子的杂化方式为___________ ,对苯二甲酸中最多有___________ 个原子共平面;酸性
___________  (填>或<),请解释原因
(填>或<),请解释原因___________ 。
(6) 、
、 、
、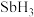 中沸点由低到高的顺序是
中沸点由低到高的顺序是_______ ,请解释原因________ 。
 、三乙撑二胺和对苯二甲酸根离子可形成晶体M,其晶胞示意图如下。
、三乙撑二胺和对苯二甲酸根离子可形成晶体M,其晶胞示意图如下。
(1)
 的价层电子排布式是
的价层电子排布式是(2)C、N、O的电负性
(3)三乙撑二胺(
 )与
)与 能形成配位键的原因是
能形成配位键的原因是(4)下列事实可用“水分子间存在氢键”解释的是
a.常压下,4℃时水的密度最大
b.水的沸点比硫化氢的沸点高160℃
c.水的热稳定性比硫化氢强
(5)对苯二甲酸(
 )中苯环上的碳原子的杂化方式为
)中苯环上的碳原子的杂化方式为
 (填>或<),请解释原因
(填>或<),请解释原因(6)
 、
、 、
、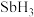 中沸点由低到高的顺序是
中沸点由低到高的顺序是
您最近半年使用:0次
22-23高三上·浙江·阶段练习
解题方法
8 . 红蓝宝石、祖母绿、金绿猫眼、钻石为举世公认的珍贵宝石。
(1)红宝石是刚玉的一种,主要成分为氧化铝( ),因含微量杂质元素铬(Cr)而呈红色。基态铬原子的简化电子排布式为
),因含微量杂质元素铬(Cr)而呈红色。基态铬原子的简化电子排布式为_______ 。
(2)祖母绿主要成分的化学式为 ,Be与Al的第一电离能大小关系为:I(Be)
,Be与Al的第一电离能大小关系为:I(Be)_______ I(Al)。Be能与NaOH溶液反应,请简单说明判断依据:_______ 。
(3)金绿猫眼主要成分的化学式为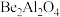 ,经碱熔酸浸可得到
,经碱熔酸浸可得到 和
和 ,
, 分子的空间构型为
分子的空间构型为_______ 。 常以二聚分子
常以二聚分子 的形式存在,分子中所有原子均达到8稳定结构,请画出
的形式存在,分子中所有原子均达到8稳定结构,请画出 的结构式并解释其形成原因:
的结构式并解释其形成原因:_______ 。
(4)钻石是经过琢磨的金刚石,金刚石熔点高于晶体硅,原因为_______ 。金刚石晶胞结构如图所示,与晶胞面心处碳原子距离最近且等距离的碳原子数为_______ 。

(1)红宝石是刚玉的一种,主要成分为氧化铝(
 ),因含微量杂质元素铬(Cr)而呈红色。基态铬原子的简化电子排布式为
),因含微量杂质元素铬(Cr)而呈红色。基态铬原子的简化电子排布式为(2)祖母绿主要成分的化学式为
 ,Be与Al的第一电离能大小关系为:I(Be)
,Be与Al的第一电离能大小关系为:I(Be)(3)金绿猫眼主要成分的化学式为
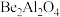 ,经碱熔酸浸可得到
,经碱熔酸浸可得到 和
和 ,
, 分子的空间构型为
分子的空间构型为 常以二聚分子
常以二聚分子 的形式存在,分子中所有原子均达到8稳定结构,请画出
的形式存在,分子中所有原子均达到8稳定结构,请画出 的结构式并解释其形成原因:
的结构式并解释其形成原因:(4)钻石是经过琢磨的金刚石,金刚石熔点高于晶体硅,原因为

您最近半年使用:0次
22-23高三上·辽宁·期中
9 . 钛是20世纪50年代发展起来的一种重要的结构金属,钛合金因具有强度高、耐蚀性好、耐热性高等特点而被广泛用于各个领域。回答下列问题:
(1)钛元素在元素周期表中的位置___________ 。
(2)二氧化钛与 (光气)、
(光气)、 (二氯亚砜)等氯化试剂反应可用于制取四氯化钛。
(二氯亚砜)等氯化试剂反应可用于制取四氯化钛。
① 的空间构型为
的空间构型为___________ , 中σ键和π键的数目比为
中σ键和π键的数目比为___________ 。
② 是
是___________ 分子。(填“极性”或“非极性”)
(3)钛的某配合物可用于催化环烯烃聚合,其结构如下图所示:
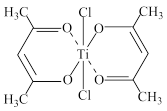
①碳原子的杂化类型有___________ 种。
②该配合物中存在的化学键有___________ (填字母)。
a.离子键 b.配位键 c.金属键 d.共价键 e.氢键
(4)氮化钛晶体的晶胞结构如图所示,该晶体结构中与N原子距离最近且相等的Ti原子有________ 个;若该晶胞的密度为 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 ,则晶胞中Ti原子与N原子的最近距离为
,则晶胞中Ti原子与N原子的最近距离为_________ pm。(用含ρ、 的代数式表示)
的代数式表示)

(1)钛元素在元素周期表中的位置
(2)二氧化钛与
 (光气)、
(光气)、 (二氯亚砜)等氯化试剂反应可用于制取四氯化钛。
(二氯亚砜)等氯化试剂反应可用于制取四氯化钛。①
 的空间构型为
的空间构型为 中σ键和π键的数目比为
中σ键和π键的数目比为②
 是
是(3)钛的某配合物可用于催化环烯烃聚合,其结构如下图所示:

①碳原子的杂化类型有
②该配合物中存在的化学键有
a.离子键 b.配位键 c.金属键 d.共价键 e.氢键
(4)氮化钛晶体的晶胞结构如图所示,该晶体结构中与N原子距离最近且相等的Ti原子有
 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 ,则晶胞中Ti原子与N原子的最近距离为
,则晶胞中Ti原子与N原子的最近距离为 的代数式表示)
的代数式表示)
您最近半年使用:0次
2022-11-16更新
|
1233次组卷
|
4卷引用:北京市海淀区2022届高三一模(结构与性质)
(已下线)北京市海淀区2022届高三一模(结构与性质)辽宁省六校2022-2023学年高三上学期期中联考化学试题山东省曹县第一中学2023届高三上学期12月月考化学试题(已下线)期中模拟预测卷01(测试范围:选择性必修2)-2022-2023学年高二化学下学期期中期末考点大串讲(人教版2019)
22-23高三上·宁夏银川·阶段练习
名校
解题方法
10 . C和Si元素在化学中占有极其重要的地位。
(1)写出Si的基态原子核外最外层电子排布式_______ ,C、O、Si三种元素的电负性由大到小的顺序为_______ 。
(2)干冰是分子晶体,其密度比冰大的原因是_______ 。SiC晶体的结构与晶体硅的相似,其中C原子的杂化方式为_______ 。
(3)氧化物XO的电子总数与SiC的相等,则X为_______ (填元素符号),XO是优良的耐高温材料,其熔点比CaO高的原因是_______ 。
(4)向盛有硫酸铜水溶液的试管中加氨水,先形成蓝色沉淀,继续加入氨水沉淀溶解,得到深蓝色透明溶液。在这个过程中先生成蓝色沉淀,后沉淀溶解的原因是:_______ 。
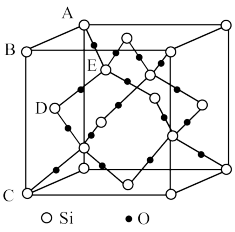
(5)下图表示的是SiO2的晶胞结构(白圈代表硅原子,黑点代表氧原子),判断在30g二氧化硅晶体中含_______ 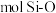 键。如果该立方体的边长为
键。如果该立方体的边长为 ,用
,用 表示阿伏加德罗常数,则SiO2晶体的密度表达式为
表示阿伏加德罗常数,则SiO2晶体的密度表达式为_______  。
。
(1)写出Si的基态原子核外最外层电子排布式
(2)干冰是分子晶体,其密度比冰大的原因是
(3)氧化物XO的电子总数与SiC的相等,则X为
(4)向盛有硫酸铜水溶液的试管中加氨水,先形成蓝色沉淀,继续加入氨水沉淀溶解,得到深蓝色透明溶液。在这个过程中先生成蓝色沉淀,后沉淀溶解的原因是:
(5)下图表示的是SiO2的晶胞结构(白圈代表硅原子,黑点代表氧原子),判断在30g二氧化硅晶体中含
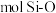 键。如果该立方体的边长为
键。如果该立方体的边长为 ,用
,用 表示阿伏加德罗常数,则SiO2晶体的密度表达式为
表示阿伏加德罗常数,则SiO2晶体的密度表达式为 。
。
您最近半年使用:0次
2022-10-30更新
|
1671次组卷
|
3卷引用:北京市海淀区2022届高三一模(结构与性质)



