名校
1 . 近年来我国科学家发现了一系列意义重大的铁系、铜系超导材料,其中一类为Fe-Sm-As-F-O组成的化合物。回答下列问题:
(1)元素As与N同族。预测As的氢化物分子的立体结构为______ ,杂化类型为______ ,其沸点比 的
的______ (填“高”或“低”),其判断理由是____________ 。
(2)黄铜是人类最早使用的合金之一,主要由Zn和Cu组成,第一电离能:
______ (填“大于”或“小于”) ,原因是
,原因是____________ 。
(3)研究发现,阳离子的颜色与未成对电子数有关。例如: 、
、 、
、 等。
等。 呈无色,其原因是
呈无色,其原因是____ 。
(1)元素As与N同族。预测As的氢化物分子的立体结构为
 的
的(2)黄铜是人类最早使用的合金之一,主要由Zn和Cu组成,第一电离能:

 ,原因是
,原因是(3)研究发现,阳离子的颜色与未成对电子数有关。例如:
 、
、 、
、 等。
等。 呈无色,其原因是
呈无色,其原因是
您最近一年使用:0次
2023-04-03更新
|
121次组卷
|
2卷引用:重庆市璧山来凤中学校2023-2024学年高二下学期3月月考化学试题
2 . Ⅰ.有机金属化合物的应用研究是目前科学研究的前沿之一,二茂铁[ ]的发现在有机金属化合物研究中具有里程碑意义,它开辟了有机金属化合物研究的新领域。二茂铁分子是一种金属有机配合物,熔点173℃,沸点249℃,100℃以上能升华;不溶于水,易溶于苯、乙醚、汽油等有机溶剂。环戊二烯和二茂铁的结构如下图所示。回答下列问题。
]的发现在有机金属化合物研究中具有里程碑意义,它开辟了有机金属化合物研究的新领域。二茂铁分子是一种金属有机配合物,熔点173℃,沸点249℃,100℃以上能升华;不溶于水,易溶于苯、乙醚、汽油等有机溶剂。环戊二烯和二茂铁的结构如下图所示。回答下列问题。
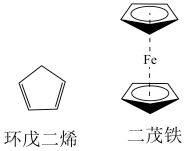
(1)环戊二烯分子中σ键和π键的个数比为_______ 。
(2)下列关于环戊二烯和二茂铁的说法正确的是_______(填字母序号)
(3)环戊二烯能使溴的四氯化碳溶液褪色。写出环戊二烯与足量溴的四氯化碳溶液反应的化学方程式_______ 。
(4)分子或离子团中的大π键可表示为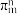 ,其中m表示参与形成大π键的原子数,n表示参与形成大π键的电子数。已知环戊二烯阴离子(
,其中m表示参与形成大π键的原子数,n表示参与形成大π键的电子数。已知环戊二烯阴离子( )的结构与苯分子相似,具有芳香性。苯分子中大π键可表示为
)的结构与苯分子相似,具有芳香性。苯分子中大π键可表示为 ,则
,则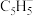 中大π键应表示为
中大π键应表示为_______ 。
Ⅱ.完成下列填空。
(5)有机物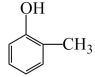 的命名为:
的命名为:_______ 。
(6)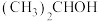 与氧气在铜催化作用下加热的化学方程式是
与氧气在铜催化作用下加热的化学方程式是_______ 。
(7)乙二醇与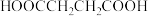 可发生缩聚反应,得到的产物结构简式为
可发生缩聚反应,得到的产物结构简式为_______ 。
 ]的发现在有机金属化合物研究中具有里程碑意义,它开辟了有机金属化合物研究的新领域。二茂铁分子是一种金属有机配合物,熔点173℃,沸点249℃,100℃以上能升华;不溶于水,易溶于苯、乙醚、汽油等有机溶剂。环戊二烯和二茂铁的结构如下图所示。回答下列问题。
]的发现在有机金属化合物研究中具有里程碑意义,它开辟了有机金属化合物研究的新领域。二茂铁分子是一种金属有机配合物,熔点173℃,沸点249℃,100℃以上能升华;不溶于水,易溶于苯、乙醚、汽油等有机溶剂。环戊二烯和二茂铁的结构如下图所示。回答下列问题。
(1)环戊二烯分子中σ键和π键的个数比为
(2)下列关于环戊二烯和二茂铁的说法正确的是_______(填字母序号)
| A.二茂铁晶体是分子晶体 |
| B.环戊烷中含有环戊二烯,可用与氢气反应除去 |
| C.环戊二烯分子中所有原子均在同一个平面上 |
| D.环戊二烯的同分异构体可能是含两个碳碳三键的炔烃 |
(4)分子或离子团中的大π键可表示为
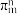 ,其中m表示参与形成大π键的原子数,n表示参与形成大π键的电子数。已知环戊二烯阴离子(
,其中m表示参与形成大π键的原子数,n表示参与形成大π键的电子数。已知环戊二烯阴离子(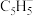 )的结构与苯分子相似,具有芳香性。苯分子中大π键可表示为
)的结构与苯分子相似,具有芳香性。苯分子中大π键可表示为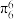 ,则
,则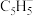 中大π键应表示为
中大π键应表示为Ⅱ.完成下列填空。
(5)有机物
 的命名为:
的命名为:(6)
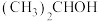 与氧气在铜催化作用下加热的化学方程式是
与氧气在铜催化作用下加热的化学方程式是(7)乙二醇与
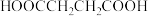 可发生缩聚反应,得到的产物结构简式为
可发生缩聚反应,得到的产物结构简式为
您最近一年使用:0次
3 . 钒(V)固氮酶种类众多,其中种结构如图所示:

(1)基态钒原子的核外电子排布式为________ ,该元素位于元素周期表的第___ 族。
(2)钒固氮酶中钒的配位原子有___ (写元素符号)。
(3)配体CH3CN中碳的杂化类型为____ 所含σ键与π键数目之比为___ 。
(4)配体CH3CN中所涉及元素的电负性由强到弱依次排序为__________ (用元素符号表示)。
(5)写出证明非金属性Cl >S的一个常见离子方程式:__________ 。

(1)基态钒原子的核外电子排布式为
(2)钒固氮酶中钒的配位原子有
(3)配体CH3CN中碳的杂化类型为
(4)配体CH3CN中所涉及元素的电负性由强到弱依次排序为
(5)写出证明非金属性Cl >S的一个常见离子方程式:
您最近一年使用:0次
2020-09-04更新
|
225次组卷
|
2卷引用:重庆市第八中学2018-2019学年高二下学期期中考试化学试题
解题方法
4 . 铝、锌、铁在人类生产和生活中有重要作用,也是人体必需的微量元素。回答下列问题:
(1)Fe2+电子排布式为___ ,Zn的基态原子能级最高的电子的电子云轮廓图形状为___ 。
(2)已知Al的第一电离能为578kJ·mol-1、Mg的第一电离能为740kJ·mol-1,请解释Mg的第一电离能比Al大的原因___ 。
(3)Zn2+可形成[Zn(NH3)6]SO4络合物,1mol[Zn(NH3)6]2+配离子中含σ键___ mol,其阴离子中心原子的杂化方式是___ ,NH3的沸点高于PH3的原因是___ 。
(4)已知Zn2+等过渡元素离子形成的水合离子的颜色如下表所示:
请根据原子结构推测Sc3+、Zn2+的水合离子为无色的原因:___ 。
(5)FeCl3中的化学键具有明显的共价性,蒸汽状态下以双聚分子存在的FeCl3的结构式为___ ,其中Fe的配位数为___ 。
(6)Fe和N可组成一种过渡金属氮化物,其晶胞如图所示。六棱柱底边边长为xcm,高为ycm,NA为阿伏加 德罗常数的值,则晶胞的密度为___ g·cm-3(列出计算式即可)。

(1)Fe2+电子排布式为
(2)已知Al的第一电离能为578kJ·mol-1、Mg的第一电离能为740kJ·mol-1,请解释Mg的第一电离能比Al大的原因
(3)Zn2+可形成[Zn(NH3)6]SO4络合物,1mol[Zn(NH3)6]2+配离子中含σ键
(4)已知Zn2+等过渡元素离子形成的水合离子的颜色如下表所示:
| 离子 | Sc3+ | Cr3+ | Fe2+ | Zn2+ |
| 水合离子的颜色 | 无色 | 绿色 | 浅绿色 | 无色 |
请根据原子结构推测Sc3+、Zn2+的水合离子为无色的原因:
(5)FeCl3中的化学键具有明显的共价性,蒸汽状态下以双聚分子存在的FeCl3的结构式为
(6)Fe和N可组成一种过渡金属氮化物,其晶胞如图所示。六棱柱底边边长为xcm,高为ycm,NA为阿伏加 德罗常数的值,则晶胞的密度为

您最近一年使用:0次
2020-06-28更新
|
1988次组卷
|
4卷引用:重庆市江津中学、实验中学等七校2020届高三下学期6月联考(三诊)理科综合化学试题
重庆市江津中学、实验中学等七校2020届高三下学期6月联考(三诊)理科综合化学试题(已下线)2021年高考化学押题预测卷(广东卷)(01)(已下线)2021年高考全国乙卷化学试题变式题2021年广东省高考化学试卷变式题11-21
名校
解题方法
5 . 钢化玻璃因其优良的性能广泛应用于日常生活,但由于制作玻璃时里面含有极少量硫化镍,使得钢化玻璃在极限条件下的使用受到限制。
(1)基态硫原子价层电子的轨道表达式 电子排布图
电子排布图 为
为__ ,基态镍原子中核外电子占据最高能层的符号为__ 。
(2)Ni(CO)4常用于制备纯镍,溶于乙醇、CCl4、苯等有机溶剂,为__ 晶体,Ni(CO)4空间构型与甲烷相同,中心原子的杂化轨道类型为__ ,写出与配体互为等电子体的阴离子__  任写一种
任写一种 。
。
(3)与硫同族的硒元素有两种常见的二元含氧酸,请比较它们酸性强弱__ >__  填化学式
填化学式 ,理由是
,理由是__ 。
(4)H2S的键角__ 填“大于”“小于”“等于”)H2O的键角,请从电负性的角度说明理由__ 。
(5)NiO与NaCl的晶胞结构相似,如图所示,阴离子采取面心立方堆积,阳离子填充在位于阴离子构成的__ 空隙中,已知Ni2+半径为69nm,O2-半径为140nm,阿伏加 德罗常数为NA,NiO晶体的密度为__ g/cm3(只列出计算式 。
。

(1)基态硫原子价层电子的轨道表达式
 电子排布图
电子排布图 为
为(2)Ni(CO)4常用于制备纯镍,溶于乙醇、CCl4、苯等有机溶剂,为
 任写一种
任写一种 。
。(3)与硫同族的硒元素有两种常见的二元含氧酸,请比较它们酸性强弱
 填化学式
填化学式 ,理由是
,理由是(4)H2S的键角
(5)NiO与NaCl的晶胞结构相似,如图所示,阴离子采取面心立方堆积,阳离子填充在位于阴离子构成的
 。
。
您最近一年使用:0次
名校
6 . X、Y、Z、M、G五种元素分属三个短周期;且原子序数依次增大。X、Z同主族;可形成离子化合物ZX;Y、M同主族;可形成MY2、MY3两种分子。
请回答下列问题:
(1)Y在元素周期表中的位置为___ 。
(2)上述元素的最高价氧化物对应的水化物酸性最强的是___ (写化学式);非金属气态氢化物还原性最强的是___ (写化学式)。
(3)Y、G的单质或两元素之间形成的化合物可作水消毒剂的有___ (写出其中两种物质的化学式)。
(4)X2M的燃烧热ΔH=-a kJ·mol-1;写出X2M燃烧反应的热化学方程式:_____ 。
(5)ZX的电子式为________ ;ZX与水反应放出气体的化学方程式为_______ 。
请回答下列问题:
(1)Y在元素周期表中的位置为
(2)上述元素的最高价氧化物对应的水化物酸性最强的是
(3)Y、G的单质或两元素之间形成的化合物可作水消毒剂的有
(4)X2M的燃烧热ΔH=-a kJ·mol-1;写出X2M燃烧反应的热化学方程式:
(5)ZX的电子式为
您最近一年使用:0次
2020-02-25更新
|
160次组卷
|
3卷引用:重庆南开中学高2022届高一化学(必修2)物质结构元素周期律专题训练
名校
解题方法
7 . 钛、铁、砷、硒、锌等元素的单质及其化合物在化工、医药、材料等领域有着广泛的应用。
(1)基态Ti原子中,最高能层电子的电子云轮廓形状为_______ ,与Ti同周期的所有过渡元素的基态原子中,最外层电子数与钛不同的元素有________ 种。
(2)铁的第三电离能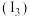 、第四电离能
、第四电离能 分别为
分别为 和
和 ,
,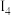 远大于
远大于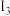 的原因是
的原因是______________________ 。
(3) 离子可用于
离子可用于 的检验,其对应的酸有两种,分别为硫氰酸
的检验,其对应的酸有两种,分别为硫氰酸 和异硫氰酸
和异硫氰酸 。
。
①写出与 互为等电子体的一种微粒
互为等电子体的一种微粒_________  分子或离子
分子或离子 ;
;
②异硫氰酸的沸点比硫氰酸沸点高的原因是_______________ 。
(4)成语“信口雌黄”中的雌黄分子式为 ,分子结构如图1所示,As原子的杂化方式为
,分子结构如图1所示,As原子的杂化方式为_______________ 。

(5)离子化合物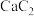 的晶胞结构如图2所示。一个晶胞含有的
的晶胞结构如图2所示。一个晶胞含有的 键有
键有__________ 个。

(6)硒化锌的晶胞结构如图所示,图中X和Y点所堆积的原子均为____________  填元素符号
填元素符号 ;该晶胞中硒原子所处空隙类型为
;该晶胞中硒原子所处空隙类型为____________  填“立方体”、“正四面体”或“正八面体”
填“立方体”、“正四面体”或“正八面体” ,该种空隙的填充率为
,该种空隙的填充率为____________ ;若该晶胞密度为 ,硒化锌的摩尔质量为
,硒化锌的摩尔质量为 。用
。用 代表阿伏加 德罗常数的数值,则晶胞参数a为
代表阿伏加 德罗常数的数值,则晶胞参数a为____________ nm。

(1)基态Ti原子中,最高能层电子的电子云轮廓形状为
(2)铁的第三电离能
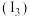 、第四电离能
、第四电离能 分别为
分别为 和
和 ,
,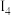 远大于
远大于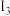 的原因是
的原因是(3)
 离子可用于
离子可用于 的检验,其对应的酸有两种,分别为硫氰酸
的检验,其对应的酸有两种,分别为硫氰酸 和异硫氰酸
和异硫氰酸 。
。①写出与
 互为等电子体的一种微粒
互为等电子体的一种微粒 分子或离子
分子或离子 ;
;②异硫氰酸的沸点比硫氰酸沸点高的原因是
(4)成语“信口雌黄”中的雌黄分子式为
 ,分子结构如图1所示,As原子的杂化方式为
,分子结构如图1所示,As原子的杂化方式为
(5)离子化合物
 的晶胞结构如图2所示。一个晶胞含有的
的晶胞结构如图2所示。一个晶胞含有的 键有
键有
(6)硒化锌的晶胞结构如图所示,图中X和Y点所堆积的原子均为
 填元素符号
填元素符号 ;该晶胞中硒原子所处空隙类型为
;该晶胞中硒原子所处空隙类型为 填“立方体”、“正四面体”或“正八面体”
填“立方体”、“正四面体”或“正八面体” ,该种空隙的填充率为
,该种空隙的填充率为 ,硒化锌的摩尔质量为
,硒化锌的摩尔质量为 。用
。用 代表阿伏加 德罗常数的数值,则晶胞参数a为
代表阿伏加 德罗常数的数值,则晶胞参数a为
您最近一年使用:0次
名校
解题方法
8 . 氟代硼酸钾(KBe2BO3F2)是激光器的核心材料,我国化学家在此领域的研究走在了世界的最前列。请回答下列问题:
(1)第一电离能介于B和N之间的第二周期的元素共有________ 种。
(2)基态K+离子电子占据最高能级的电子云轮廓图为_________ 形。
(3)BeCl2中的化学键具有明显的共价性,蒸汽状态下BeCl2以双聚分子存在,其结构式为________ ,其中Be原子的电子排布图为_________ 。
(4)四氟硼酸钠(NaBF4)是纺织工业的催化剂。其阴离子的中心原子的杂化轨道类型为_________ 。四氟硼酸钠中存在_______ (填序号):
a. 氢键 b. 范德华力 c. 离子键 d. 配位键 e. σ键 f. π键
(1)第一电离能介于B和N之间的第二周期的元素共有
(2)基态K+离子电子占据最高能级的电子云轮廓图为
(3)BeCl2中的化学键具有明显的共价性,蒸汽状态下BeCl2以双聚分子存在,其结构式为
(4)四氟硼酸钠(NaBF4)是纺织工业的催化剂。其阴离子的中心原子的杂化轨道类型为
a. 氢键 b. 范德华力 c. 离子键 d. 配位键 e. σ键 f. π键
您最近一年使用:0次
2020-01-24更新
|
1089次组卷
|
5卷引用:重庆市2022-2023学年高二下学期3月月考化学试题
名校
9 . I.有下列物质:①钠 ②金刚石 ③冰 ④Na2O2 ⑤MgCl2 ⑥氯化铵 ⑦水晶 ⑧Cl2
(1)属于原子晶体的是_________ ,属于金属晶体的是_________ 。
(2)既含有离子键又含有共价键的是_________ 。
(3)③熔化时克服作用力的有_________ 。
(4)Na2O2的电子式________________ 。
(5)②、③、⑤、⑦、⑧熔点由低到高的顺序为________________ 。
II.在生产生活以及化学科学研究中,水都有重要的作用。
(1)与H2O分子是等电子体的微粒_________ (阴离子及分子各写一个)。
(2)水分子在特定条件下容易得到一个H+,形成水合氢离子(H3O+)。下列对上述过程的描述不合理的是__________ 。
A.微粒的形状发生了改变
B.氧原子的杂化类型发生了改变
C.微粒中的键角发生了改变
D.微粒的化学性质发生了改变
(3)向CuSO4溶液中加入氨水,溶液变成深蓝色,请写出发生此变化的离子方程式______________ 。
(1)属于原子晶体的是
(2)既含有离子键又含有共价键的是
(3)③熔化时克服作用力的有
(4)Na2O2的电子式
(5)②、③、⑤、⑦、⑧熔点由低到高的顺序为
II.在生产生活以及化学科学研究中,水都有重要的作用。
(1)与H2O分子是等电子体的微粒
(2)水分子在特定条件下容易得到一个H+,形成水合氢离子(H3O+)。下列对上述过程的描述不合理的是
A.微粒的形状发生了改变
B.氧原子的杂化类型发生了改变
C.微粒中的键角发生了改变
D.微粒的化学性质发生了改变
(3)向CuSO4溶液中加入氨水,溶液变成深蓝色,请写出发生此变化的离子方程式
您最近一年使用:0次
10 . 硼酸(H3BO3)是一种片层状结构的白色晶体(下图),有油腻感,可做润滑剂。硼酸对人体受伤组织有缓和防腐作用,故可以用于医药和食品防腐等方面。回答下列问题:
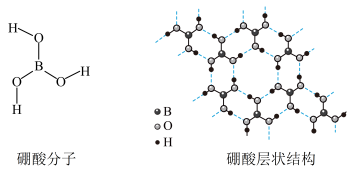
(1)B原子的结构示意图为_____________________ ;
(2)硼酸为一元弱酸,在水中电离方程式为H3BO3+H2O [B(OH)4]-+H+,写出硼酸与NaOH溶液反应的离子方程式
[B(OH)4]-+H+,写出硼酸与NaOH溶液反应的离子方程式_________________________ ;
(3)下列有关硼酸晶体的说法正确的是__________ ;
A.H3BO3分子的稳定性与氢键有关
B.含1 molH3BO3的晶体中有3 mol氢键
C.分子中B、O最外层均为8e-稳定结构
D.B原子杂化轨道的类型sp2,同层分子间的主要作用力是范德华力
(4)根据对角线规则,与B性质相似的元素是__________ 。
(5)含氧酸的通式为(HO)mROn,根据非羟基氧原子数判断,与H3BO3酸性最接近的是________ ;
A.HClO B.H4SiO4 C.H3PO4 D.HNO2
(6)一种硼酸盐的阴离子为B3O6n-,n=_____________ ;B3O6n-结构中只有一个六元环,B的空间化学环境相同,O有两种空间化学环境,画出B3O6n-的结构图(注明所带电荷数); _____________ 。

(1)B原子的结构示意图为
(2)硼酸为一元弱酸,在水中电离方程式为H3BO3+H2O
 [B(OH)4]-+H+,写出硼酸与NaOH溶液反应的离子方程式
[B(OH)4]-+H+,写出硼酸与NaOH溶液反应的离子方程式(3)下列有关硼酸晶体的说法正确的是
A.H3BO3分子的稳定性与氢键有关
B.含1 molH3BO3的晶体中有3 mol氢键
C.分子中B、O最外层均为8e-稳定结构
D.B原子杂化轨道的类型sp2,同层分子间的主要作用力是范德华力
(4)根据对角线规则,与B性质相似的元素是
(5)含氧酸的通式为(HO)mROn,根据非羟基氧原子数判断,与H3BO3酸性最接近的是
A.HClO B.H4SiO4 C.H3PO4 D.HNO2
(6)一种硼酸盐的阴离子为B3O6n-,n=
您最近一年使用:0次
2019-06-14更新
|
107次组卷
|
2卷引用:2015-2016学年重庆市第八中学高二下第三次月考化学试卷



