1 . [化学——选修3:物质结构与性质]
由H、C、O、N、S、Cu等元素能形成多种物质。这些物质有许多用途。请回答下列问题:
(1)基态Cu原子的价电子有____ 种运动状态,未成对电子占据原子轨道的形状为______ 。
(2)碳和氢形成的最简单碳正离子CH3+,其中心原子碳原子的杂化类型为___________ ,该阳离子的空间构型为___________ 。
(3)CuO在高温时分解为O2和Cu2O,请从阳离子的结构来说明在高温时,Cu2O比CuO更稳定的原因是_________________________________ 。
(4)向盛有CuSO4溶液的试管中滴加少量氨水,现象是_____ ,离子反应方程式为____ ;继续滴加氨水至过量得到深蓝色溶液。经测定深蓝色是由于存在[Cu(NH3)4]SO4。其阳离子的结构式为___________ ,中心原子的配位数为___________ 。
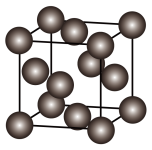
(5)金属晶体铜的晶胞如图所示。其堆积模型是___________ ,铜原子间的最短距离为apm,密度为ρg·cm-3,NA为阿伏伽德罗常数。铜的相对原子质量为___________ (用a、ρ、NA表示,写出计算式即可)。
由H、C、O、N、S、Cu等元素能形成多种物质。这些物质有许多用途。请回答下列问题:
(1)基态Cu原子的价电子有
(2)碳和氢形成的最简单碳正离子CH3+,其中心原子碳原子的杂化类型为
(3)CuO在高温时分解为O2和Cu2O,请从阳离子的结构来说明在高温时,Cu2O比CuO更稳定的原因是
(4)向盛有CuSO4溶液的试管中滴加少量氨水,现象是
(5)金属晶体铜的晶胞如图所示。其堆积模型是

您最近一年使用:0次
2019-02-26更新
|
3452次组卷
|
6卷引用:河南省郑州市六校联盟2022-2023学年高二下学期4月期中考试化学试题
河南省郑州市六校联盟2022-2023学年高二下学期4月期中考试化学试题【校级联考】四川省蓉城名校联盟2019届高三下学期第二次(2月)联考理科综合化学试题四川省泸州市泸县第一中学2018-2019学年高二下学期下学期期末模拟理综-化学试题(已下线)2021年高考全国甲卷化学试题变式题(已下线)2021年高考全国乙卷化学试题变式题2020年全国卷Ⅰ理综化学高考真题变式题
名校
2 . 前四周期原子序数依次增大的元素A、B、C、D、E中,A的基态原子核外3 个能级上有电子,且每个能级上的电子数相等,B原于核外电子有7 种不同的运动状态,C元素原于核外的M层中只有2对成对电子,D+与C2-的电子数相等,E元素位于元素周期表的ds区,且基态原子价层电子均已成对。
回答下列问题:
(1)E2+ 的价层电子排布图为_____________________ 。
(2)五种元素中第一电离能最小的是_______________ (填元素符号),CAB-离子中,A原子的杂化方式是______________________ 。
(3)AB-、D+ 和E2+三种离子组成的化学物质D2E(AB)4,其中化学键的类型有_______ ,该化合物中存在一个复杂离子,该离子的化学式为_________________ ,配位体是_____________________ 。
(4)C和E两种元素组成的一种化合物的晶胞如图所示。
①该化合物的化学式为________ ,E的配位数为______________ ,C采取_______ (填“简单立方”、“体心立方”、“六方最密”或“面心立方最密”)堆积。
②列式表示该晶体的密度:_______________ g·㎝-3。
回答下列问题:
(1)E2+ 的价层电子排布图为
(2)五种元素中第一电离能最小的是
(3)AB-、D+ 和E2+三种离子组成的化学物质D2E(AB)4,其中化学键的类型有
(4)C和E两种元素组成的一种化合物的晶胞如图所示。
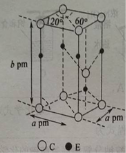
①该化合物的化学式为
②列式表示该晶体的密度:
您最近一年使用:0次
2018-01-09更新
|
243次组卷
|
2卷引用:河南省中原名校(豫南九校)2018届高三上学期第四次质量考评(期中)化学试题
名校
3 . (1)基态Fe2+离子有______ 个未成对电子,基态Ni原子的电子排布式为__________ 。
(2)用“>”或“<”填空:
(3)F2通入稀NaOH溶液中可生成OF2,OF2分子构型为_______ 。其中氧原子的杂化方式为_____ 。
(4)与H2O互为等电子体的一种阳离子为________ (填化学式);
(5)Ni能与CO形成正四面体形的配合物Ni(CO)4,1mol Ni(CO)4中含有______ molσ键。
(6)CaF2难溶于水,但可溶于含A13+的溶液中,原因是________ (用离子方程式表示)。已知AlF63+溶液中可稳定存在。
(7)ZnS在荧光体、光导体材料、涂料、颜料等行业中应用广泛。立方ZnS晶体结构如图所示,其晶胞边长为540.0 pm,密度为_______ (列式并计算),a位置S2-离子与b位置Zn2+离子之间的距离为_____ pm(列式表示)

(2)用“>”或“<”填空:
| 第一电离能 | 熔点 | 酸性 |
| Si | NaCl | H2SO4 |
(3)F2通入稀NaOH溶液中可生成OF2,OF2分子构型为
(4)与H2O互为等电子体的一种阳离子为
(5)Ni能与CO形成正四面体形的配合物Ni(CO)4,1mol Ni(CO)4中含有
(6)CaF2难溶于水,但可溶于含A13+的溶液中,原因是
(7)ZnS在荧光体、光导体材料、涂料、颜料等行业中应用广泛。立方ZnS晶体结构如图所示,其晶胞边长为540.0 pm,密度为

您最近一年使用:0次
4 . 硫化锌荧光材料的研究从1868年法国化学家Sidot发现至今已有近150年的历史。其中立方硫化锌的晶胞如图所示。请回答下列问题:
(1)锌元素在周期表中的位于第______ 周期_____ 族, 属于_____ 区;
(2)基态锌原子的价电子排布式为_________ ;
(3)一般锌元素常表现为+2 价的原因是_____ ;
(4)立方硫化锌晶体的每个晶胞中含有_____ 个锌离子, 其配位数为_____ ;含有_____ 个硫离子,其配位数为_____ ;
(5)根据神奇的“百度”显示,该晶胞的棱长a=541pm,S2-的半径约为184pm,则 Zn2+在此晶胞中的半径大约为______ pm(精确到1pm)。

(1)锌元素在周期表中的位于第
(2)基态锌原子的价电子排布式为
(3)一般锌元素常表现为+2 价的原因是
(4)立方硫化锌晶体的每个晶胞中含有
(5)根据神奇的“百度”显示,该晶胞的棱长a=541pm,S2-的半径约为184pm,则 Zn2+在此晶胞中的半径大约为
您最近一年使用:0次
5 . (1)按下列要求选择适当物质的序号填空:
A.MgCl2 B.金刚石 C.NH4Cl D. KNO3 E.干冰 F.单质碘晶体
熔化时不需破坏化学键的是________ ,熔化时需破坏共价键的是________ ;熔点最高的是________ ,熔点最低的是________ ;晶体中既有离子键又有共价键的是________ ;
(2)HCl、CS2、H2S、SO2 4种分子中的非极性分子是________ ;
(3)指出下列分子或离子的空间构型: PO43-_________ ; NO2_________ ; NO3-__________ ;
(4)按要求写出第二周期非金属元素组成的电中性分子的化学式:平面正三角形分子______ , 三角锥形分子______ , 正四面体形分子______ 。
A.MgCl2 B.金刚石 C.NH4Cl D. KNO3 E.干冰 F.单质碘晶体
熔化时不需破坏化学键的是
(2)HCl、CS2、H2S、SO2 4种分子中的非极性分子是
(3)指出下列分子或离子的空间构型: PO43-
(4)按要求写出第二周期非金属元素组成的电中性分子的化学式:平面正三角形分子
您最近一年使用:0次
名校
6 . (l)基态As原子的核外电子排布式为[Ar]______ ,有________ 个未成对电子。
(2) As与N是同主族元素,从原子结构角度分析:为什么As的最高价含氧酸H3AsO4是三元酸(含三个轻基),而N的最高价含氧酸HNO3是一元酸(只含一个烃基)______ 。
(3)比较下列氢化物的熔点和沸点,分析其变化规律及原因__________ 。
(4) Na3AsO3中Na、As、O电负性由大至小的顺序是______ 。AsO33-的空间构型为___ , AsO33-中As的杂化轨道类型为_______ 杂化。
(5)砷化稼(GaAs)为黑灰色固体,熔点为1238℃。该晶体属于___ 晶体,微粒之间存在的作用力是_________ 。
(6)图为GaAs的晶胞,原子半径相对大小是符合事实的,则白球代表____ 原子。
已知GaAs的密度为5.307g·cm3, Ga和As的相对原子质量分别为69.72、74.92,求晶胞参数a=______ pm (列出计算式即可)。
(2) As与N是同主族元素,从原子结构角度分析:为什么As的最高价含氧酸H3AsO4是三元酸(含三个轻基),而N的最高价含氧酸HNO3是一元酸(只含一个烃基)
(3)比较下列氢化物的熔点和沸点,分析其变化规律及原因
(4) Na3AsO3中Na、As、O电负性由大至小的顺序是
(5)砷化稼(GaAs)为黑灰色固体,熔点为1238℃。该晶体属于
| NH3 | PH3 | AsH3 | SbH3 | |
| 熔点/K | 195.3 | 140.5 | 156.1 | 185 |
| 沸点/K | 239.6 | 185.6 | 210.5 | 254.6 |
(6)图为GaAs的晶胞,原子半径相对大小是符合事实的,则白球代表
已知GaAs的密度为5.307g·cm3, Ga和As的相对原子质量分别为69.72、74.92,求晶胞参数a=

您最近一年使用:0次
2017-04-13更新
|
287次组卷
|
2卷引用:河南省郑州市第一中学2018届高三上学期第二次月考理综化学试题
9-10高二下·河南郑州·期末
解题方法
7 . 一种离子晶体的晶胞如图。其中阳离子A以 表示,阴离子B以
表示,阴离子B以 表示。
表示。

(1)每个晶胞种含A离子的数目为________ ,含B离子数目为________ 。
(2)若A的核外电子排布与Ar相同,B的电子排布与Ne相同,则该离子化合物的化学式是___________________ ;
(3)阳离子的配位数为_________ ,阴离子的配位数为________ 。
(4)已知A的离子半径为0.99×10-10m,则该晶胞的体积是_______________ m3。
 表示,阴离子B以
表示,阴离子B以 表示。
表示。
(1)每个晶胞种含A离子的数目为
(2)若A的核外电子排布与Ar相同,B的电子排布与Ne相同,则该离子化合物的化学式是
(3)阳离子的配位数为
(4)已知A的离子半径为0.99×10-10m,则该晶胞的体积是
您最近一年使用:0次
9-10高二下·河南郑州·期末
名校
8 . 水是生命之源,它与我们的生活密切相关。在化学实验和科学研究中,水也是一种常用的试剂。
(1)水分子中氧原子在基态时核外电子排布式为______________________________ ;
(2)写出与H2O分子互为等电子体的微粒_________________________ (填2种)。
(3)水分子在特定条件下容易得到一个H+,形成水合氢离子(H3O+)。下列对上述过程的描述不合理的是______________
(4)下列是钠、碘、金刚石、干冰、氯化钠晶体的晶胞图(未按顺序排序)。与冰的晶体类型相同的是_________ (请用相应的编号填写)

(5)在冰晶体中,每个水分子与相邻的4个水分子形成氢键(如图所示),已知冰的升华热是51 kJ/mol,除氢键外,水分子间还存在范德华力(11 kJ/mol),则冰晶体中氢键的“键能” 是_________ kJ/mol;
(6)将白色的无水CuSO4溶解于水中,溶液呈蓝色,是因为生成了一种呈蓝色的配离子。请写出生成此配离子的离子方程式:__________________________________________________________ 。
(1)水分子中氧原子在基态时核外电子排布式为
(2)写出与H2O分子互为等电子体的微粒
(3)水分子在特定条件下容易得到一个H+,形成水合氢离子(H3O+)。下列对上述过程的描述不合理的是
| A.氧原子的杂化类型发生了改变 | B.微粒的形状发生了改变 |
| C.微粒的化学性质发生了改变 | D.微粒中的键角发生了改变 |
(4)下列是钠、碘、金刚石、干冰、氯化钠晶体的晶胞图(未按顺序排序)。与冰的晶体类型相同的是

(5)在冰晶体中,每个水分子与相邻的4个水分子形成氢键(如图所示),已知冰的升华热是51 kJ/mol,除氢键外,水分子间还存在范德华力(11 kJ/mol),则冰晶体中氢键的“键能” 是
(6)将白色的无水CuSO4溶解于水中,溶液呈蓝色,是因为生成了一种呈蓝色的配离子。请写出生成此配离子的离子方程式:
您最近一年使用:0次
2014-01-09更新
|
580次组卷
|
7卷引用:2010年郑州市智林学校高二下学期期末考试化学试题
(已下线)2010年郑州市智林学校高二下学期期末考试化学试题(已下线)2010-2011学年山西省吕梁市高二下学期期中考试化学试卷(已下线)2013-2014学年四川省绵阳中学高二上学期第三次月考化学试卷(已下线)2015届安徽省滁州中学高三九月份化学月考试卷【全国百强校】内蒙古集宁一中(东校区)2017-2018学年高二下学期期中考试化学试题【市级联考】新疆维吾尔自治区乌鲁木齐市2018-2019学年高二下学期期末考试化学试题江西省井冈山市宁冈中学2021-2022学年高三下学期开学考试化学试题



