解题方法
1 . 开发新型材料是现在科学研究的一项重要工作,科学家开发一种形状记忆陶瓷,它的主要原材料是纳米级ZrO2.用锆石ZrSiO4(含少量FeO、Al2O3、SiO2和CuO)制备纳米级ZrO2的流程设计如图:
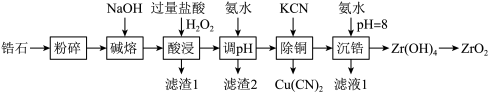
回答下列问题:
(1)锆石杂质中含锆元素,基态Cu的价电子排布式为___________ ,锆石杂质中含铁元素,已知Fe2+易被氧化为Fe3+,原因是___________ 。(从原子结构角度解释)
(2)碱熔过程中有多种物质能发生反应,写出其中一个反应方程式___________ 。
(3)“酸浸”过程中FeO发生氧化还原反应的离子方程式为___________ ,滤渣1经回收加工后有多种用途,写出其中一种___________ 。
(4)久置H2O2浓度需要标定。取xmLH2O2溶液,用amol/LCe(SO4)2溶液滴定H2O2,完全反应转化为Ce2(SO4)3时,消耗bmLCe(SO4)2溶液。则H2O2溶液的浓度为:___________ mol/L。
(5)易溶氰化物有剧毒,需对滤液1中的氰化物进行处理,选用次氯酸钠溶液在碱性条件下将其氧化,其中一种产物为空气的主要成分,写出其离子反应方程式___________ 。
(6)ZrO2的晶胞结构如图所示。
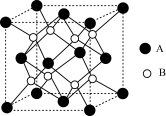
①其中B表示___________ (填O2-或Zr4+)。
②ZrO2晶胞的棱长分别为anm、anm、cnm,其晶体密度为___________ g/cm3(列算式用NA表示阿伏加德罗常数的值)。

回答下列问题:
(1)锆石杂质中含锆元素,基态Cu的价电子排布式为
(2)碱熔过程中有多种物质能发生反应,写出其中一个反应方程式
(3)“酸浸”过程中FeO发生氧化还原反应的离子方程式为
(4)久置H2O2浓度需要标定。取xmLH2O2溶液,用amol/LCe(SO4)2溶液滴定H2O2,完全反应转化为Ce2(SO4)3时,消耗bmLCe(SO4)2溶液。则H2O2溶液的浓度为:
(5)易溶氰化物有剧毒,需对滤液1中的氰化物进行处理,选用次氯酸钠溶液在碱性条件下将其氧化,其中一种产物为空气的主要成分,写出其离子反应方程式
(6)ZrO2的晶胞结构如图所示。

①其中B表示
②ZrO2晶胞的棱长分别为anm、anm、cnm,其晶体密度为
您最近一年使用:0次
2024-01-18更新
|
558次组卷
|
2卷引用:河南省商丘市宁陵县东关高中2023-2024学年高二下学期第一次月考 化学试题
名校
解题方法
2 . 我国秦俑彩绘和汉代器物上用的颜料被称为“中国蓝”、“中国紫”,近年来,人们对这些颜料的成分进行了研究,发现其成分主要为BaCuSi4O10、BaCuSi2O6。
(1)“中国蓝”、“中国紫”中均有Cun+离子,n=___________ ,基态时该阳离子的价电子排布式为___________ 。
(2)“中国蓝”的发色中心是以Cun+为中心离子的配位化合物,其中提供孤对电子的是____ 元素。
(3)已知Cu、Zn的第二电离能分别为1957.9 kJ·mol-1、1733.3 kJ·mol-1,前者高于后者的原因是________________________________________ 。
(4)铜常用作有机反应的催化剂。例如,2CH3CH2OH+O2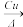 2CH3CHO+2H2O。
2CH3CHO+2H2O。
①乙醇的沸点高于乙醛,其主要原因是_________________________________ ;乙醛分子中π键与σ键的个数比为___________ 。
②乙醛分子中碳原子的杂化轨道类型是___________ 。
(5)铜的晶胞如图所示。铜银合金是优质的金属材料,其晶胞与铜晶胞类似,银位于顶点,铜位于面心。
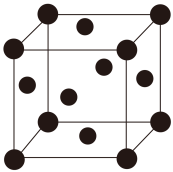
①该铜银合金的化学式是___________________ 。
②已知:该铜银晶胞参数为a cm,晶体密度为ρ g·cm-3。则阿伏加 德罗常数(NA)为_______ mol-1(用代数式表示,下同)。
③若Ag、Cu原子半径分别为b cm、c cm,则该晶胞中原子空间利用率φ为___________ 。(提示:晶胞中原子空间利用率=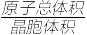 ×100%)
×100%)
(1)“中国蓝”、“中国紫”中均有Cun+离子,n=
(2)“中国蓝”的发色中心是以Cun+为中心离子的配位化合物,其中提供孤对电子的是
(3)已知Cu、Zn的第二电离能分别为1957.9 kJ·mol-1、1733.3 kJ·mol-1,前者高于后者的原因是
(4)铜常用作有机反应的催化剂。例如,2CH3CH2OH+O2
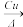 2CH3CHO+2H2O。
2CH3CHO+2H2O。①乙醇的沸点高于乙醛,其主要原因是
②乙醛分子中碳原子的杂化轨道类型是
(5)铜的晶胞如图所示。铜银合金是优质的金属材料,其晶胞与铜晶胞类似,银位于顶点,铜位于面心。

①该铜银合金的化学式是
②已知:该铜银晶胞参数为a cm,晶体密度为ρ g·cm-3。则阿伏加 德罗常数(NA)为
③若Ag、Cu原子半径分别为b cm、c cm,则该晶胞中原子空间利用率φ为
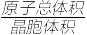 ×100%)
×100%)
您最近一年使用:0次
2020-05-28更新
|
1376次组卷
|
6卷引用:河南省原阳县第一高级中学2021-2022学年高三上学期开学适应性考试理综化学试题
3 . 东晋《华阳国志·南中志》卷四中已有关于白铜的记载,云南镍白铜(铜镍合金)闻名中外,曾主要用于造币,亦可用于制作仿银饰品。回答下列问题:
(1)镍元素基态原子的电子排布式为___________ ,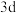 能级上的未成对电子数为
能级上的未成对电子数为________ 。
(2)硫酸镍溶于氨水形成 蓝色溶液。
蓝色溶液。
① 中阴离子的立体构型是
中阴离子的立体构型是_______ 。
②在 中
中 与
与 之间形成的化学键称为
之间形成的化学键称为__________ ,提供孤电子对的成键原子是__________ 。
③氨的沸点__________ (填“高于”或“低于”)膦( ),原因是
),原因是_____________ ;氨是__________ 分子(填“极性”或“非极性”),中心原子的轨道杂化类型为__________ 。
(1)镍元素基态原子的电子排布式为
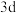 能级上的未成对电子数为
能级上的未成对电子数为(2)硫酸镍溶于氨水形成
 蓝色溶液。
蓝色溶液。①
 中阴离子的立体构型是
中阴离子的立体构型是②在
 中
中 与
与 之间形成的化学键称为
之间形成的化学键称为③氨的沸点
 ),原因是
),原因是
您最近一年使用:0次
2020-04-10更新
|
438次组卷
|
3卷引用:河南省新乡市辉县市第二高级中学2019-2020学年高二下学期期中考试化学试题
河南省新乡市辉县市第二高级中学2019-2020学年高二下学期期中考试化学试题第2章 化学键与分子间作用力——C挑战区模拟高考(鲁科版选修3)(已下线)第36讲 分子结构与性质(精练)-2021年高考化学一轮复习讲练测
4 . [化学——选修3:物质结构与性质]
由H、C、O、N、S、Cu等元素能形成多种物质。这些物质有许多用途。请回答下列问题:
(1)基态Cu原子的价电子有____ 种运动状态,未成对电子占据原子轨道的形状为______ 。
(2)碳和氢形成的最简单碳正离子CH3+,其中心原子碳原子的杂化类型为___________ ,该阳离子的空间构型为___________ 。
(3)CuO在高温时分解为O2和Cu2O,请从阳离子的结构来说明在高温时,Cu2O比CuO更稳定的原因是_________________________________ 。
(4)向盛有CuSO4溶液的试管中滴加少量氨水,现象是_____ ,离子反应方程式为____ ;继续滴加氨水至过量得到深蓝色溶液。经测定深蓝色是由于存在[Cu(NH3)4]SO4。其阳离子的结构式为___________ ,中心原子的配位数为___________ 。
(5)金属晶体铜的晶胞如图所示。其堆积模型是___________ ,铜原子间的最短距离为apm,密度为ρg·cm-3,NA为阿伏伽德罗常数。铜的相对原子质量为___________ (用a、ρ、NA表示,写出计算式即可)。
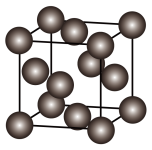
由H、C、O、N、S、Cu等元素能形成多种物质。这些物质有许多用途。请回答下列问题:
(1)基态Cu原子的价电子有
(2)碳和氢形成的最简单碳正离子CH3+,其中心原子碳原子的杂化类型为
(3)CuO在高温时分解为O2和Cu2O,请从阳离子的结构来说明在高温时,Cu2O比CuO更稳定的原因是
(4)向盛有CuSO4溶液的试管中滴加少量氨水,现象是
(5)金属晶体铜的晶胞如图所示。其堆积模型是

您最近一年使用:0次
2019-02-26更新
|
3452次组卷
|
6卷引用:河南省郑州市六校联盟2022-2023学年高二下学期4月期中考试化学试题
河南省郑州市六校联盟2022-2023学年高二下学期4月期中考试化学试题【校级联考】四川省蓉城名校联盟2019届高三下学期第二次(2月)联考理科综合化学试题四川省泸州市泸县第一中学2018-2019学年高二下学期下学期期末模拟理综-化学试题(已下线)2021年高考全国甲卷化学试题变式题(已下线)2021年高考全国乙卷化学试题变式题2020年全国卷Ⅰ理综化学高考真题变式题
名校
5 . 含氮、磷化合物在生活和生产中有许多重要用途,如:(CH3)3N、磷化硼(BP)、磷青铜(Cu3SnP)等。
回答下列问题:
(1)锡(Sn)是第五周期ⅣA元素。基态锡原子的价电子排布式为_________ ,据此推测,锡的最高正价是_________ 。
(2)与P同周期的主族元素中,电负性比P小的元素有____ 种 ,第一电离能比P大有____ 种。
(3)PH3分子的空间构型为___________ 。PH3的键角小于NH3的原因是__________ 。
(4)化合物(CH3)3N能溶于水,试解析其原因____________ 。
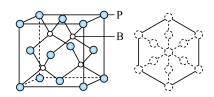
(5)磷化硼是一种耐磨涂料,它可用作金属的表面保护层。磷化硼晶体晶胞如图所示:
①在一个晶胞中磷原子空间堆积方式为________ ,磷原子的配位数为________ 。
②已知晶胞边长a pm,阿伏伽德罗常数为NA。则磷化硼晶体的密度为______ g/cm3。
③磷化硼晶胞沿着体对角线方向的投影如图,请将表示B原子的圆圈涂黑________ 。
回答下列问题:
(1)锡(Sn)是第五周期ⅣA元素。基态锡原子的价电子排布式为
(2)与P同周期的主族元素中,电负性比P小的元素有
(3)PH3分子的空间构型为
(4)化合物(CH3)3N能溶于水,试解析其原因

(5)磷化硼是一种耐磨涂料,它可用作金属的表面保护层。磷化硼晶体晶胞如图所示:
①在一个晶胞中磷原子空间堆积方式为
②已知晶胞边长a pm,阿伏伽德罗常数为NA。则磷化硼晶体的密度为
③磷化硼晶胞沿着体对角线方向的投影如图,请将表示B原子的圆圈涂黑
您最近一年使用:0次
2019-02-13更新
|
2517次组卷
|
8卷引用:河南省驻马店市新蔡县第一高级中学2021-2022学年高二下学期7月份月考化学试题
河南省驻马店市新蔡县第一高级中学2021-2022学年高二下学期7月份月考化学试题【市级联考】四川省攀枝花市2019届高三上学期第二次统考化学试题【市级联考】山东省泰安市2019届高三下学期二轮模拟考试理科综合化学试题江西省上饶市2020届第一次高考模拟考试理科综合化学试题解题达人.化学选择题(2021全国卷)精编特训06(已下线)2021年高考全国甲卷化学试题变式题2020年全国卷Ⅰ理综化学高考真题变式题(已下线)2020年海南卷化学高考真题变式题15-19
2013·河北石家庄·二模
解题方法
6 . 根据元素周期表中第四周期元素的相关知识,回答下列问题:
(1)第四周期元素的基态原子的电子排布中4s轨道上只有1个电子的元素有_______ 种;写出Cu+的核外电子排布式_______ 。
(2)按电子排布,可将周期表里的元素划分成五个区域,第四周期元素中属于s区的元素有_______ 种,属于d区的元素有_______ 种。
(3)CaO晶胞如图所示,CaO晶体中Ca2+的配位数为_______ ;CaO的焰色反应为砖红色,许多金属或它们的化合物都可以发生焰色反应,其原因是_______

(4)由叠氮化钾(KN3)热分解可得纯N2:2KN3(s)=2K(l)+3N2(g),下列有关说法正确的是_______ (填选项字母)。

A.NaN3与KN3结构类似,前者晶格能较小
B.晶体钾的晶胞结构如图所示,每个晶胞中分摊2个钾原子
C.氮的第一电离能大于氧
D.氮气常温下很稳定,是因为氮的电负性小
(5)二氧化钛(TiO2)是常用的、具有较高催化活性和稳定性的光催化剂。O2在其催化作用下,可将CN-氧化成CNO-。CN-的电子式为_______ ,CNO-的中心原子的杂化方式为_______
(6)在CrCl3溶液中,一定条件下存在组成为[CrCln(H2O)6-n]x+(n和x均为正整数)的配离子,将其通过氢离子交换树脂(R-H),可发生离子交换反应:[CrCln(H2O)6-n]x++xR-H→Rx[CrCln(H2O)6-n]+xH+。将含0.0015 mol[CrCln(H2O)6-n]x+的溶液,与R-H完全交换后,中和生成的H+需浓度为0.1200 mol·L-1 NaOH溶液25.00 mL,则该配离子的化学式为_______ 。
(1)第四周期元素的基态原子的电子排布中4s轨道上只有1个电子的元素有
(2)按电子排布,可将周期表里的元素划分成五个区域,第四周期元素中属于s区的元素有
(3)CaO晶胞如图所示,CaO晶体中Ca2+的配位数为

(4)由叠氮化钾(KN3)热分解可得纯N2:2KN3(s)=2K(l)+3N2(g),下列有关说法正确的是

A.NaN3与KN3结构类似,前者晶格能较小
B.晶体钾的晶胞结构如图所示,每个晶胞中分摊2个钾原子
C.氮的第一电离能大于氧
D.氮气常温下很稳定,是因为氮的电负性小
(5)二氧化钛(TiO2)是常用的、具有较高催化活性和稳定性的光催化剂。O2在其催化作用下,可将CN-氧化成CNO-。CN-的电子式为
(6)在CrCl3溶液中,一定条件下存在组成为[CrCln(H2O)6-n]x+(n和x均为正整数)的配离子,将其通过氢离子交换树脂(R-H),可发生离子交换反应:[CrCln(H2O)6-n]x++xR-H→Rx[CrCln(H2O)6-n]+xH+。将含0.0015 mol[CrCln(H2O)6-n]x+的溶液,与R-H完全交换后,中和生成的H+需浓度为0.1200 mol·L-1 NaOH溶液25.00 mL,则该配离子的化学式为
您最近一年使用:0次
名校
7 . 离子液体是一类具有很高应用价值的绿色溶剂和催化剂,其中的EMIM+离子由H、C、N三种元素组成,结构如图所示。回答下列问题:
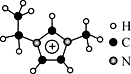
(1)碳原子价层电子的轨道表达式为__________ ,基态碳原子中,核外电子占据的最高能级的电子云轮廓图为_________ 形。
(2)根据价层电子对互斥理论,NH3、NO3-、NO2-中,中心原子价层电子对数不同于其他两种粒子的是_______ 。NH3比PH3的沸点高,原因是_________ 。
(3)氮元素的第一电离能比同周期相邻元素都大的原因是____________ 。
(4)EMIM+离子中,碳原子的杂化轨道类型为______ 。分子中的大π键可用符号 表示,其中m代表参与形成的大π键原子数,n代表参与形成的大π键电子数(如苯分子中的大π键可表示为
表示,其中m代表参与形成的大π键原子数,n代表参与形成的大π键电子数(如苯分子中的大π键可表示为 ),则EMIM+离子中的大π键应表示为
),则EMIM+离子中的大π键应表示为________ 。
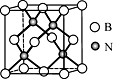
(5)立方氮化硼硬度仅次于金刚石,但热稳定性远高于金刚石,其晶胞结构如图所示。立方氮化硼属于_______ 晶体,其中硼原子的配位数为_______ 。已知:立方氮化硼密度为dg/cm3,B原子半径为xpm,N原子半径为ypm,阿伏伽德罗常数的值为NA,则该晶胞中原子的空间利用率为________ (列出化简后的计算式)。

(1)碳原子价层电子的轨道表达式为
(2)根据价层电子对互斥理论,NH3、NO3-、NO2-中,中心原子价层电子对数不同于其他两种粒子的是
(3)氮元素的第一电离能比同周期相邻元素都大的原因是
(4)EMIM+离子中,碳原子的杂化轨道类型为
 表示,其中m代表参与形成的大π键原子数,n代表参与形成的大π键电子数(如苯分子中的大π键可表示为
表示,其中m代表参与形成的大π键原子数,n代表参与形成的大π键电子数(如苯分子中的大π键可表示为 ),则EMIM+离子中的大π键应表示为
),则EMIM+离子中的大π键应表示为
(5)立方氮化硼硬度仅次于金刚石,但热稳定性远高于金刚石,其晶胞结构如图所示。立方氮化硼属于
您最近一年使用:0次
2019-01-14更新
|
1543次组卷
|
5卷引用:【全国百强校】河南省许昌高级中学2019届高三下学期复习诊断(二)化学试题
名校
8 . 开发新型储氢材料是氢能源利用的重要研究方向之一。请回答以下问题:
(1)Ti(BH4)3是一种储氢材料, 可由TiCl4和LiBH4反应制得。
①基态Ti3+的电子排布式为____________________ ;LiBH4中Li、B、H 元素的电负性由大到小的排列顺序为_________________ 。
②另有一种含钛元素的新型材料,其理论结构模型如图所示,图中虚线框内碳原子的杂化轨道类型为____________ 。

(2)氨硼烷(NH3BH3)是优良的储氢材料,少量氨硼烷可以由硼烷(B2H6)和NH3合成。
①NH3BH3中是否存在配位键__________ (填“是”或“否”);与NH3BH3互为等电子体的分子的化学式为__________ 。
②B、C、N 与O元素的第一电离能由大到小的顺序为___________________ 。
③氨硼烷在高温下释放氢后生成的立方氮化硼晶体,具有类似金刚石的结构,硬度略小于金刚石。则立方氮化硼晶体可用作___________ (选填下列字母序号)。
a.切削工具 b.钻探钻头 c.导电材料 d.耐磨材料
(3)一种有储氢功能的铜合金晶体具有面心立方最密堆积的结构,晶胞中Cu原子处于面心,Au原子处于顶点位置,氢原子可进入到由Cu原子与Au原子构成的四面体空隙中。
①若将Cu原子与Au原子等同看待,该晶体储氢后的晶胞结构与CaF2的结构相似,该晶体储氢后的化学式为________________ ;
②铜与其它许多金属及其化合物都可以发生焰色反应,其原因是_______________ 。
(4)金属氢化物也是具有良好发展前景的储氢材料。某储氢材料是短周期金属元素R的氢化物。R的部分电离能如下表所示:
①该金属元素是___________ (填元素符号)..
②若氢化物的晶胞结构如图所示(有4 个H原子位于面上,其余H原子位于晶胞内),已知该晶体的密度为ρg·cm-3,则该晶胞的体积为__________ cm3[用含ρ、NA的代数式表示(其中NA为阿伏伽德罗常数的值)]。

(1)Ti(BH4)3是一种储氢材料, 可由TiCl4和LiBH4反应制得。
①基态Ti3+的电子排布式为
②另有一种含钛元素的新型材料,其理论结构模型如图所示,图中虚线框内碳原子的杂化轨道类型为

(2)氨硼烷(NH3BH3)是优良的储氢材料,少量氨硼烷可以由硼烷(B2H6)和NH3合成。
①NH3BH3中是否存在配位键
②B、C、N 与O元素的第一电离能由大到小的顺序为
③氨硼烷在高温下释放氢后生成的立方氮化硼晶体,具有类似金刚石的结构,硬度略小于金刚石。则立方氮化硼晶体可用作
a.切削工具 b.钻探钻头 c.导电材料 d.耐磨材料
(3)一种有储氢功能的铜合金晶体具有面心立方最密堆积的结构,晶胞中Cu原子处于面心,Au原子处于顶点位置,氢原子可进入到由Cu原子与Au原子构成的四面体空隙中。
①若将Cu原子与Au原子等同看待,该晶体储氢后的晶胞结构与CaF2的结构相似,该晶体储氢后的化学式为
②铜与其它许多金属及其化合物都可以发生焰色反应,其原因是
(4)金属氢化物也是具有良好发展前景的储氢材料。某储氢材料是短周期金属元素R的氢化物。R的部分电离能如下表所示:
| I1/KJ·mol-1 | I2/KJ·mol-1 | I3/KJ·mol-1 | I4/KJ·mol-1 | I5/KJ·mol-1 |
| 738 | 1451 | 7733 | 10540 | 13630 |
①该金属元素是
②若氢化物的晶胞结构如图所示(有4 个H原子位于面上,其余H原子位于晶胞内),已知该晶体的密度为ρg·cm-3,则该晶胞的体积为

您最近一年使用:0次
2018-05-09更新
|
425次组卷
|
2卷引用:【全国百强校】河南省南阳市第一中学2017-2018学年高二下学期第四次月考化学试题
名校
9 . (1)基态Fe2+离子有______ 个未成对电子,基态Ni原子的电子排布式为__________ 。
(2)用“>”或“<”填空:
(3)F2通入稀NaOH溶液中可生成OF2,OF2分子构型为_______ 。其中氧原子的杂化方式为_____ 。
(4)与H2O互为等电子体的一种阳离子为________ (填化学式);
(5)Ni能与CO形成正四面体形的配合物Ni(CO)4,1mol Ni(CO)4中含有______ molσ键。
(6)CaF2难溶于水,但可溶于含A13+的溶液中,原因是________ (用离子方程式表示)。已知AlF63+溶液中可稳定存在。
(7)ZnS在荧光体、光导体材料、涂料、颜料等行业中应用广泛。立方ZnS晶体结构如图所示,其晶胞边长为540.0 pm,密度为_______ (列式并计算),a位置S2-离子与b位置Zn2+离子之间的距离为_____ pm(列式表示)

(2)用“>”或“<”填空:
| 第一电离能 | 熔点 | 酸性 |
| Si | NaCl | H2SO4 |
(3)F2通入稀NaOH溶液中可生成OF2,OF2分子构型为
(4)与H2O互为等电子体的一种阳离子为
(5)Ni能与CO形成正四面体形的配合物Ni(CO)4,1mol Ni(CO)4中含有
(6)CaF2难溶于水,但可溶于含A13+的溶液中,原因是
(7)ZnS在荧光体、光导体材料、涂料、颜料等行业中应用广泛。立方ZnS晶体结构如图所示,其晶胞边长为540.0 pm,密度为

您最近一年使用:0次
10 . 金属在化工生产及日常生活中有着广泛的应用,如铁、铬、镓等在现代工业中备受青睐。

(1)铬是一种硬而脆、抗腐蚀性强的金属,常招于电镀和制造特种钢。基态Cr原子中,未成对电子数有_______ 个,Cr3+的价电子排布式为________ 。
(2)Zn与Ga的第一电离能从大到小的顺序为_________ 。
(3)镓与第VA族元素可形成多种新型人工半导体材料,砷化镓(GaAs)就是其中一种,其晶体结构如图1所示(白色球代表As原子)。在GaAs晶体中,距离每个Ga原子最近的As原子有_____ 个,距离每个As原子最近的As原子有_______ 个。
(4)铁的多种化合物均为磁性材料,氮化铁是其中一种,某氮化铁的晶胞结构如图2所示,则氮化铁的化学式为______ ;设晶胞边长为acm,阿伏伽德罗常数为NA,该晶体的密度为 _____ g.cm-3 (用含a和NA的式子表示)

(1)铬是一种硬而脆、抗腐蚀性强的金属,常招于电镀和制造特种钢。基态Cr原子中,未成对电子数有
(2)Zn与Ga的第一电离能从大到小的顺序为
(3)镓与第VA族元素可形成多种新型人工半导体材料,砷化镓(GaAs)就是其中一种,其晶体结构如图1所示(白色球代表As原子)。在GaAs晶体中,距离每个Ga原子最近的As原子有
(4)铁的多种化合物均为磁性材料,氮化铁是其中一种,某氮化铁的晶胞结构如图2所示,则氮化铁的化学式为
您最近一年使用:0次



