名校
解题方法
1 . X、Y、Z、W、Q五种元素位于元素周期表前四周期,原子序数依次增大。基态X原子价电子排布式为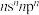 ;基态Z原子核外电子有三个能级,p电子总数与s电子总数相等;W是第三周期电负性最大的元素;基态Q原子有四个未成对电子。
;基态Z原子核外电子有三个能级,p电子总数与s电子总数相等;W是第三周期电负性最大的元素;基态Q原子有四个未成对电子。
(1)W核外电子空间运动状态共有_______ 种。
(2)阴离子 、
、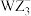 的空间构型分别是
的空间构型分别是_______ 、_______ 。
(3)基态Q原子中,核外电子占据最高能层的符号是_______ ,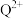 的价电子排布式为
的价电子排布式为_______ ,Q在周期表中的位置是_______ 区。
(4) 分子中各原子都满足最外层8电子结构,分子中
分子中各原子都满足最外层8电子结构,分子中 键与
键与 键数目之比为
键数目之比为_______ 。
(5)Y与W可形成化合物YW3。资料显示:Y元素电负性略大于W;YW3可溶于水发生水解反应。试判断YW3可能的水解产物为_______ (写化学式)。
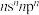 ;基态Z原子核外电子有三个能级,p电子总数与s电子总数相等;W是第三周期电负性最大的元素;基态Q原子有四个未成对电子。
;基态Z原子核外电子有三个能级,p电子总数与s电子总数相等;W是第三周期电负性最大的元素;基态Q原子有四个未成对电子。(1)W核外电子空间运动状态共有
(2)阴离子
 、
、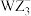 的空间构型分别是
的空间构型分别是(3)基态Q原子中,核外电子占据最高能层的符号是
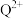 的价电子排布式为
的价电子排布式为(4)
 分子中各原子都满足最外层8电子结构,分子中
分子中各原子都满足最外层8电子结构,分子中 键与
键与 键数目之比为
键数目之比为(5)Y与W可形成化合物YW3。资料显示:Y元素电负性略大于W;YW3可溶于水发生水解反应。试判断YW3可能的水解产物为
您最近一年使用:0次
解题方法
2 . 硒是人体必需的微量元素,有无机硒和有机硒之分。
(1)硒与硫在元素周期表中的相对位置如图所示,硒在元素周期表中的位置是_______ ;硒化氢的电子式为_______ 。
(2)二硫化硒(SeS2)具有抗真菌、抗皮脂溢出作用,常用作洗发香波中的去屑剂。SeS2中硫化素的化合价为负价,请从原子结构角度解释原因:_______ 。
(3)硒与硫相似,可形成多种盐。写出含不同价态硒元素的钠盐的化学式_______ (至少两种)。
(4)一种有机硒化合物的结构简式为: ,其分子式为
,其分子式为_______ ,其分子间脱水时形成的官能团的名称是_______ 。
(5)工业上提取硒的过程如下:
第一步(未配平):X+Se+H2SO4→Na2SO4+H2SeO3+ClO2↑+H2O
已知该反应中氧化产物与还原产物的物质的量之比为1:4,则X的化学式为_______ 。
第二步:向H2SeO3溶液中通入SO2,可析出固体Se,则反应化学方程式为_______ 。
| S |
| Se |
(1)硒与硫在元素周期表中的相对位置如图所示,硒在元素周期表中的位置是
(2)二硫化硒(SeS2)具有抗真菌、抗皮脂溢出作用,常用作洗发香波中的去屑剂。SeS2中硫化素的化合价为负价,请从原子结构角度解释原因:
(3)硒与硫相似,可形成多种盐。写出含不同价态硒元素的钠盐的化学式
(4)一种有机硒化合物的结构简式为:
 ,其分子式为
,其分子式为(5)工业上提取硒的过程如下:
第一步(未配平):X+Se+H2SO4→Na2SO4+H2SeO3+ClO2↑+H2O
已知该反应中氧化产物与还原产物的物质的量之比为1:4,则X的化学式为
第二步:向H2SeO3溶液中通入SO2,可析出固体Se,则反应化学方程式为
您最近一年使用:0次
名校
解题方法
3 . 有A、B、C、D、E、F、G、H八种元素,除G、H为第四周期元素外其余均为短周期元素。A、E、G位于元素周期表的s区,B、C、D、F元素位于p区。A、G的原子外围电子层排布相同,A的原子中没有成对电子;B元素基态原子中电子占据三种能量不同的原子轨道且每种轨道中的电子总数相同;C元素原子的外围电子层排布式为nsnnpn+1;D的基态原子核外成对电子数是成单电子数的3倍;E的基态原子占据两种形状的原子轨道,且两种形状轨道中的电子总数均相同;F元素位于第三周期,且F元素的第一电离能列同周期主族元素第三高;H的原子中质子数等于B、C、F的原子中质子数之和。回答问题:
(1)B、C、D三种元素中元素的第一电离能最大的是_______ (填元素符号);
(2)由A与D形成的A2D分子空间构型是_______ 形,分子中D原子的杂化类型是_____ 杂化;
(3)由D、E、F、G形成的盐G2FD4、EFD4的共熔体在冷却时首先析出的物质是____ (写化学式),原因是________ 。
(4)元素D与H形成的常见化合物晶胞如图所示,该晶胞参数为apm,化合物的化学式为____ ,计算该晶胞密度为_____ g/cm3(写出表达式即可)。

(1)B、C、D三种元素中元素的第一电离能最大的是
(2)由A与D形成的A2D分子空间构型是
(3)由D、E、F、G形成的盐G2FD4、EFD4的共熔体在冷却时首先析出的物质是
(4)元素D与H形成的常见化合物晶胞如图所示,该晶胞参数为apm,化合物的化学式为

您最近一年使用:0次
解题方法
4 . 亚铁氰化钾(K4[Fe(CN)6])双称黄血盐,用于检验Fe3+,也用作实验的防结剂。检验三价铁发生的反应为:K4[Fe(CN)6]+FeCl3=KFe[Fe(CN)6]↓(滕氏蓝)+3KCl,回答问题:
(1)基态Fe3+电子填充的最高能级符号为___________ 。
(2)K4[Fe(CN)6]中的作用力除离子键和共价键外,还有___________ 。含有12 mol σ键的KFe[Fe(CN)6]的物质的量为___________ mol。
(3)黄血盐中N原子的杂化方式为______ ;C、N、O的第一电离能由大到小的排序为________ ,与CN-互为等电子体的分子是________ ,离子是________ 。
(4)Fe、Na、K的晶体结构如图所示。

①钠的熔点比钾更高,原因是_____________ 。
②Fe原子半径是r cm,阿伏加 德罗常数为NA,铁的相对原子质量为a,则铁单质的密度是_______ g/cm3。
(1)基态Fe3+电子填充的最高能级符号为
(2)K4[Fe(CN)6]中的作用力除离子键和共价键外,还有
(3)黄血盐中N原子的杂化方式为
(4)Fe、Na、K的晶体结构如图所示。

①钠的熔点比钾更高,原因是
②Fe原子半径是r cm,阿伏加 德罗常数为NA,铁的相对原子质量为a,则铁单质的密度是
您最近一年使用:0次
解题方法
5 . N、Cu、H、O、S、Mg是常见的六种元素。
(1)Mg位于元素周期表第_______ 周期第_______ 族;N与O的基态原子核外未成对电子个数比为_______ ;Cu的基态原子电子排布式为_______ 。
(2)用“>”或“<”填空:
碱性:Mg(OH)2_______ Cu(OH)2
第一电离能:O_______ N
熔点:MgS_______ MgO
稳定性:H2S_______ H2O
(3)Mg在空气中燃烧可微量生产氮化镁(Mg3N2),Mg3N2(S)溶于足量的稀硫酸可得到两种正盐,在25℃、101kPa下,已知该反应每消耗1molH2SO4放热akJ,则该反应的热化学方程式为_______ 。
(4)工业上采取加热条件下用氨气还原氧化铜制取铜,同时得到两种无污染的气体(或蒸汽),写出该反应的化学方程式,并标出电子转移的方向和数目_______ 。
(1)Mg位于元素周期表第
(2)用“>”或“<”填空:
碱性:Mg(OH)2
第一电离能:O
熔点:MgS
稳定性:H2S
(3)Mg在空气中燃烧可微量生产氮化镁(Mg3N2),Mg3N2(S)溶于足量的稀硫酸可得到两种正盐,在25℃、101kPa下,已知该反应每消耗1molH2SO4放热akJ,则该反应的热化学方程式为
(4)工业上采取加热条件下用氨气还原氧化铜制取铜,同时得到两种无污染的气体(或蒸汽),写出该反应的化学方程式,并标出电子转移的方向和数目
您最近一年使用:0次
2016-12-09更新
|
455次组卷
|
2卷引用:2015届安徽省安庆市高三第二次模拟考试理综化学试卷



