名校
解题方法
1 . 金属锡及其化合物在生产和科研中应用广泛。回答下列问题:
(1)某种含锡的有机金属化合物的结构如图所示。已知烷基配位体以C、N整合形式键合于Sn原子。_______ ,在周期表中的位置为_______ ,C、Si、Cl电负性由大到小的顺序为_______ 。
②该化合物中共有_______ 种杂化方式;提供电子对形成配位键的原子是_______ 。
(2)一种含锡的多元金属硫化物的晶胞结构为四方晶系,已知金属原子均呈四面体配位,晶胞棱边夹角均为90°,其结构可看作是由两个立方体A、B上下堆叠而成。如图,甲为A的体对角线投影图,乙为B的沿y轴方向的投影图。A中Fe、Sn位置互换即为B。_______ ,晶胞中Sn的配位数与Cu的配位数之比为_______ 。
②立方体A、B棱长均为a pm,以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子的分数坐标。晶胞中部分原子的分数坐标为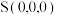 、
、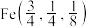 ,则晶胞中Sn原子的分数坐标为
,则晶胞中Sn原子的分数坐标为_______ ;晶胞中Sn原子和Cu原子间的最短距离为_______ pm。
(1)某种含锡的有机金属化合物的结构如图所示。已知烷基配位体以C、N整合形式键合于Sn原子。
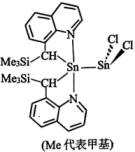
②该化合物中共有
(2)一种含锡的多元金属硫化物的晶胞结构为四方晶系,已知金属原子均呈四面体配位,晶胞棱边夹角均为90°,其结构可看作是由两个立方体A、B上下堆叠而成。如图,甲为A的体对角线投影图,乙为B的沿y轴方向的投影图。A中Fe、Sn位置互换即为B。

②立方体A、B棱长均为a pm,以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子的分数坐标。晶胞中部分原子的分数坐标为
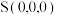 、
、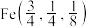 ,则晶胞中Sn原子的分数坐标为
,则晶胞中Sn原子的分数坐标为
您最近一年使用:0次
解题方法
2 . 学科融合是现代发展的大趋势,化学家利用“热电效应”理论将氮族元素、VIII族元素和稀土元素合成了具有热电效应的晶体。
(1)现代化学中,常用____ (填“原子光谱”“分子光谱”)上的特征谱线来鉴定元素,称为光谱分析。
(2)第VIII族元素中的Fe、Co、Ni都是常见金属,Fe3+比Fe2+稳定的原因是____ 。Co、Ni与NH3易形成配合物,如[Co(NH3)5H2O]Cl3和[Ni(N3)6]Cl2,配位数分别为____ 、____ ;H2O比NH3的沸点高,原因为____ 。
(3)P与Br可形成多种化合物,如图表示磷、硅、碳的四级电离变化趋势,其中表示磷元素的曲线是_____ (填标号)。PBr5为阴阳离子比为1:1的导电熔体,阴阳离子均带一个单位电荷,阴离子为单核微粒,其中P原子的杂化轨道类型为____ 。

(4)合成热电效应的一种晶体的晶胞如图所示,其中Fe原子处于Sb原子形成的八面体中心。晶胞参数为anm,NA表示阿伏加德罗常数的值,则晶体密度为____ g/cm3(用含a、NA的代数式表示)。

(1)现代化学中,常用
(2)第VIII族元素中的Fe、Co、Ni都是常见金属,Fe3+比Fe2+稳定的原因是
(3)P与Br可形成多种化合物,如图表示磷、硅、碳的四级电离变化趋势,其中表示磷元素的曲线是

(4)合成热电效应的一种晶体的晶胞如图所示,其中Fe原子处于Sb原子形成的八面体中心。晶胞参数为anm,NA表示阿伏加德罗常数的值,则晶体密度为

您最近一年使用:0次
2022-05-01更新
|
698次组卷
|
2卷引用:山东省2022届高三二轮复习联考(二)化学试题
解题方法
3 . 硼的总浓度≥0.4mol·L-1的硼酸及其盐的水溶液中不仅存在四硼酸根离子
B4O5(OH) ,还存在电荷为-1的五硼酸根离子以及电荷为-1和-2的两种三硼酸根离子。这些多硼酸根离子均由B(OH)3和B(OH)
,还存在电荷为-1的五硼酸根离子以及电荷为-1和-2的两种三硼酸根离子。这些多硼酸根离子均由B(OH)3和B(OH) 缩合而成,结构中硼原子以B-O-B的方式连接成环。
缩合而成,结构中硼原子以B-O-B的方式连接成环。
(1)上述五硼酸根离子中,所有三配位硼原子的化学环境完全相同,画出其结构示意图(不画孤对电子,羟基用-OH表达)_______ 。
(2)下图表示硼酸-硼酸盐体系在硼的总浓度为0.4mol·L-1'时,其存在形式与pH的关系。1、2、3、4分别为4种多硼酸根离子存在的区域。推出1、2、3、4分别对应的多硼酸根离子的化学式_______ 。
注:以B4O5(OH) 为范例,书写其他3种多硼酸根离子的化学式;形成这些物种的缩合反应速率几乎相同,其排列顺序不受反应速率制约;本体系中缩合反应不改变硼原子的配位数。
为范例,书写其他3种多硼酸根离子的化学式;形成这些物种的缩合反应速率几乎相同,其排列顺序不受反应速率制约;本体系中缩合反应不改变硼原子的配位数。

B4O5(OH)
 ,还存在电荷为-1的五硼酸根离子以及电荷为-1和-2的两种三硼酸根离子。这些多硼酸根离子均由B(OH)3和B(OH)
,还存在电荷为-1的五硼酸根离子以及电荷为-1和-2的两种三硼酸根离子。这些多硼酸根离子均由B(OH)3和B(OH) 缩合而成,结构中硼原子以B-O-B的方式连接成环。
缩合而成,结构中硼原子以B-O-B的方式连接成环。(1)上述五硼酸根离子中,所有三配位硼原子的化学环境完全相同,画出其结构示意图(不画孤对电子,羟基用-OH表达)
(2)下图表示硼酸-硼酸盐体系在硼的总浓度为0.4mol·L-1'时,其存在形式与pH的关系。1、2、3、4分别为4种多硼酸根离子存在的区域。推出1、2、3、4分别对应的多硼酸根离子的化学式
注:以B4O5(OH)
 为范例,书写其他3种多硼酸根离子的化学式;形成这些物种的缩合反应速率几乎相同,其排列顺序不受反应速率制约;本体系中缩合反应不改变硼原子的配位数。
为范例,书写其他3种多硼酸根离子的化学式;形成这些物种的缩合反应速率几乎相同,其排列顺序不受反应速率制约;本体系中缩合反应不改变硼原子的配位数。
您最近一年使用:0次
解题方法
4 . (1)量子化学计算预测未知化合物是现代化学的发展途径之一,有人通过计算预言铁存在四氧化物,分子构型是四面体,但该分子中铁为+6价而不是+8价,写出该分子中铁的价电子排布式_______ ,该分子中氧的化合价有_______ ,画出该分子的结构示意图_______ 。
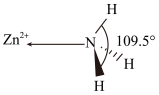
(2)NH3分子单独存在时键角为106.70º,其VSEPR模型为_______ 。下图是[Zn(NH3)6]2+离子的部分结构以及∠H-N-H的测量值,解释配合物中键角变化的原因_______ 。
(3)开夫拉是一类高强度的有机聚合物,其结构简式如下:

其中氧原子的杂化方式是_______ 。这类聚合物强度远超尼龙纤维,与钢铁近乎相同,科学研究表明其聚合物链与链之间存在苯环苯环的相互作用,除此之外还可能因为_______ 。
(4)近年来,钙钛矿太阳能电池是光电材料领域的研究热门,其晶胞结构如下图所示:
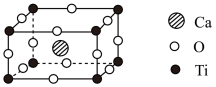
钙钛矿的化学式为_______ ,该晶胞中Ca2+与O2-的最短距离是________ cm(已知晶胞参数为anm)。
(2)NH3分子单独存在时键角为106.70º,其VSEPR模型为

(3)开夫拉是一类高强度的有机聚合物,其结构简式如下:

其中氧原子的杂化方式是
(4)近年来,钙钛矿太阳能电池是光电材料领域的研究热门,其晶胞结构如下图所示:

钙钛矿的化学式为
您最近一年使用:0次
2021-05-31更新
|
1689次组卷
|
2卷引用:四川省凉山州2021届高三第二次诊断考试理科综合化学试题
解题方法
5 . 过氧乙酸又名过醋酸 ,是重要化工原料,也是一种绿色生态杀菌剂,其制法为
,是重要化工原料,也是一种绿色生态杀菌剂,其制法为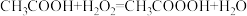 。
。
(1)某同学写出了碳原子的4种不同状态的电子排布图:
a.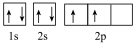 b.
b.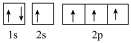
c.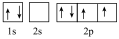 d.
d.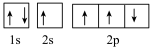
其中能量最低的是________ (填标号),电子由状态C到状态B所得到的光谱为________ 光谱(填“原子发射”或“原子吸收”)。
(2)过氧乙酸分子中C原子的杂化方式有________ 。
(3)乙酸比乙醇易电离出 的原因
的原因____________________ 。
(4)熔点:乙酸________ 硝酸(填“>”、“<”或“=”),理由_________________ 。
(5)造纸中,用 与纸浆中的过氧乙酸以及过渡金属离子反应以提高漂白效率。硼氢化钠、硼氢化铝被认为是有机化学上的“万能还原剂”。
与纸浆中的过氧乙酸以及过渡金属离子反应以提高漂白效率。硼氢化钠、硼氢化铝被认为是有机化学上的“万能还原剂”。
①两种硼氢化物的熔点如下表所示:
解释表中两种物质熔点差异的原因________ 。
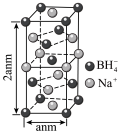
②硼氢化钠晶胞结构如图所示,该晶体中 的配位数为
的配位数为________ 。已知:硼氢化钠晶体的密度为 ,
, 代表阿伏加 德罗常数的值,则a=
代表阿伏加 德罗常数的值,则a=________ nm(用含 、
、 的最简式子表示)。
的最简式子表示)。
 ,是重要化工原料,也是一种绿色生态杀菌剂,其制法为
,是重要化工原料,也是一种绿色生态杀菌剂,其制法为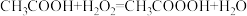 。
。(1)某同学写出了碳原子的4种不同状态的电子排布图:
a.
 b.
b.
c.
 d.
d.
其中能量最低的是
(2)过氧乙酸分子中C原子的杂化方式有
(3)乙酸比乙醇易电离出
 的原因
的原因(4)熔点:乙酸
(5)造纸中,用
 与纸浆中的过氧乙酸以及过渡金属离子反应以提高漂白效率。硼氢化钠、硼氢化铝被认为是有机化学上的“万能还原剂”。
与纸浆中的过氧乙酸以及过渡金属离子反应以提高漂白效率。硼氢化钠、硼氢化铝被认为是有机化学上的“万能还原剂”。①两种硼氢化物的熔点如下表所示:
| 硼氢化物 |  |  |
| 熔点/℃ | 400 | -64.5 |
解释表中两种物质熔点差异的原因
②硼氢化钠晶胞结构如图所示,该晶体中
 的配位数为
的配位数为 ,
, 代表阿伏加 德罗常数的值,则a=
代表阿伏加 德罗常数的值,则a= 、
、 的最简式子表示)。
的最简式子表示)。
您最近一年使用:0次
2020-06-12更新
|
1870次组卷
|
3卷引用:福建省漳州市2020届高三第三次教学质量检测理科综合化学试题
解题方法
6 . 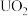 与铀氮化物是重要的核燃料,已知某温度下三碳酸铀酰铵可发生如下分解反应:
与铀氮化物是重要的核燃料,已知某温度下三碳酸铀酰铵可发生如下分解反应: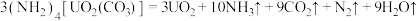 。阿伏加 德罗常数的值为
。阿伏加 德罗常数的值为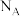 。
。
回答下列问题:
(1)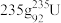 发生裂变反应:
发生裂变反应: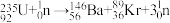 ,净产生的中子(
,净产生的中子(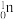 )数为
)数为________ 。基态 原子的外围电子排布式为
原子的外围电子排布式为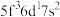 ,则处于下列状态的铀原子或离子失去一个电子所需的能量最高的为
,则处于下列状态的铀原子或离子失去一个电子所需的能量最高的为________ (填序号)。
A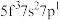 B
B 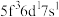 C
C  D
D 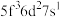
(2) 和
和 中,沸点较高的为
中,沸点较高的为________ ,与 形成的配离子稳定性较高的为
形成的配离子稳定性较高的为________ 。
(3) 中存在大
中存在大 键,形成该大
键,形成该大 键的电子数为
键的电子数为________ 。
(4)某种铀氮化物的晶体结构与 相同。
相同。 的Bom-Haber循环如图所示。
的Bom-Haber循环如图所示。
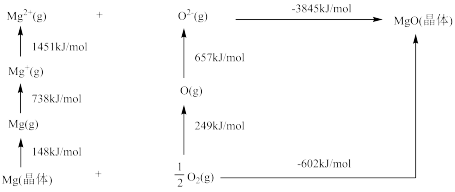
① 晶格能为
晶格能为________  。
。
② 的第二电离能大于
的第二电离能大于 的第二电离能,是由于
的第二电离能,是由于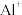 的半径较
的半径较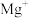 小、
小、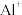 的核电荷更高以及
的核电荷更高以及_______ 。
(5)另一种铀氮化物的晶胞如下图所示, “原子”作面心立方最密堆积。
“原子”作面心立方最密堆积。
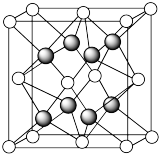
①铀元素的化合价为________ , “原子”的配位数为
“原子”的配位数为________ 。
②已知晶胞参数为 ,则晶体的密度为
,则晶体的密度为________  (列出计算式)。
(列出计算式)。
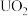 与铀氮化物是重要的核燃料,已知某温度下三碳酸铀酰铵可发生如下分解反应:
与铀氮化物是重要的核燃料,已知某温度下三碳酸铀酰铵可发生如下分解反应: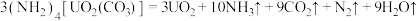 。阿伏加 德罗常数的值为
。阿伏加 德罗常数的值为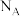 。
。回答下列问题:
(1)
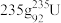 发生裂变反应:
发生裂变反应: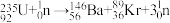 ,净产生的中子(
,净产生的中子(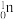 )数为
)数为 原子的外围电子排布式为
原子的外围电子排布式为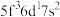 ,则处于下列状态的铀原子或离子失去一个电子所需的能量最高的为
,则处于下列状态的铀原子或离子失去一个电子所需的能量最高的为A
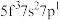 B
B 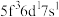 C
C  D
D 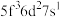
(2)
 和
和 中,沸点较高的为
中,沸点较高的为 形成的配离子稳定性较高的为
形成的配离子稳定性较高的为(3)
 中存在大
中存在大 键,形成该大
键,形成该大 键的电子数为
键的电子数为(4)某种铀氮化物的晶体结构与
 相同。
相同。 的Bom-Haber循环如图所示。
的Bom-Haber循环如图所示。
①
 晶格能为
晶格能为 。
。②
 的第二电离能大于
的第二电离能大于 的第二电离能,是由于
的第二电离能,是由于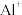 的半径较
的半径较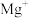 小、
小、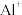 的核电荷更高以及
的核电荷更高以及(5)另一种铀氮化物的晶胞如下图所示,
 “原子”作面心立方最密堆积。
“原子”作面心立方最密堆积。
①铀元素的化合价为
 “原子”的配位数为
“原子”的配位数为②已知晶胞参数为
 ,则晶体的密度为
,则晶体的密度为 (列出计算式)。
(列出计算式)。
您最近一年使用:0次



