名校
解题方法
1 . 我国力争在2030年前实现“碳达峰”。2060年前实现“碳中和”的目标,因此二氧化碳的固定及转化成了重要的研究课题。
Ⅰ.在 催化作用下
催化作用下 和
和 反应生成甲醇:
反应生成甲醇: ;
;
Ⅱ.新型 水介质电池放电时,温室气体
水介质电池放电时,温室气体 被转化为储能物质
被转化为储能物质 。
。
请回答下列问题:
(1)基态Cu原子的外围电子排布式为___________ ,基态O原子核外有___________ 种不同运动状态的电子。
(2)Ⅰ中涉及的 、
、 、
、 、
、 ,属于非极性分子的是
,属于非极性分子的是___________ (填化学式)。
(3) 分子中碳原子的杂化轨道类型为
分子中碳原子的杂化轨道类型为___________ ,分子中含有的 键和
键和 键数目之比为
键数目之比为___________ 。
(4) 反应中,
反应中, 的立体构型为
的立体构型为___________ , 的沸点高于
的沸点高于 的原因是
的原因是___________ 。
(5)氧化锌(ZnO),俗称锌白,是一种常用的化学添加剂,广泛地应用于塑料、硅酸盐制品、合成橡胶等产品的制作中。一种ZnO的立方晶胞如图所示。
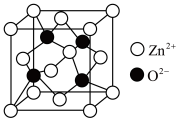
① 周围距离最近且等距的
周围距离最近且等距的 数目为
数目为___________ 。
②设晶胞边长为anm, 为阿伏加德罗常数的值,该晶体的密度为
为阿伏加德罗常数的值,该晶体的密度为___________  。
。
Ⅰ.在
 催化作用下
催化作用下 和
和 反应生成甲醇:
反应生成甲醇: ;
;Ⅱ.新型
 水介质电池放电时,温室气体
水介质电池放电时,温室气体 被转化为储能物质
被转化为储能物质 。
。请回答下列问题:
(1)基态Cu原子的外围电子排布式为
(2)Ⅰ中涉及的
 、
、 、
、 、
、 ,属于非极性分子的是
,属于非极性分子的是(3)
 分子中碳原子的杂化轨道类型为
分子中碳原子的杂化轨道类型为 键和
键和 键数目之比为
键数目之比为(4)
 反应中,
反应中, 的立体构型为
的立体构型为 的沸点高于
的沸点高于 的原因是
的原因是(5)氧化锌(ZnO),俗称锌白,是一种常用的化学添加剂,广泛地应用于塑料、硅酸盐制品、合成橡胶等产品的制作中。一种ZnO的立方晶胞如图所示。

①
 周围距离最近且等距的
周围距离最近且等距的 数目为
数目为②设晶胞边长为anm,
 为阿伏加德罗常数的值,该晶体的密度为
为阿伏加德罗常数的值,该晶体的密度为 。
。
您最近一年使用:0次
2023-07-30更新
|
931次组卷
|
4卷引用:内蒙古名校联盟2022-2023学年高二下学期期末考试化学试题
解题方法
2 . 填空。
(1)N、Al、Si、Zn四种元素中,有一种元素的电离能数据如下,则该元素是___________ (填写元素符号)。
(2)请解释 的热稳定性高于
的热稳定性高于 的原因
的原因___________ 。
(3)基态氮原子核外电子的空间运动状态有___________ 种, 的键角约为107°,推测
的键角约为107°,推测 的键角
的键角___________ 107°(填“>,<或=”)。
(4)基态硅原子价层电子轨道表示式为___________ ; 与N-甲基咪唑(分子式为:
与N-甲基咪唑(分子式为: ,结构为
,结构为 )反应可以得到一种功能性螯合物。则:C、N、H三种非金属元素的电负性由大到小的顺序是
)反应可以得到一种功能性螯合物。则:C、N、H三种非金属元素的电负性由大到小的顺序是___________ ,1个N-甲基咪唑分子中含有___________ 个 键。
键。
(5)已知周期表中存在对角相似规则,如Be与Al在周期表中处于对角线位置则化学性质相似,Be的氧化物、氢氧化物也有两性,写出Be的氢氧化物与氢氧化钠反应的化学方程式___________ 。
(1)N、Al、Si、Zn四种元素中,有一种元素的电离能数据如下,则该元素是
| 电离能 |  |  |  |  | …… |
 | 578 | 1817 | 2745 | 11575 | …… |
 的热稳定性高于
的热稳定性高于 的原因
的原因(3)基态氮原子核外电子的空间运动状态有
 的键角约为107°,推测
的键角约为107°,推测 的键角
的键角(4)基态硅原子价层电子轨道表示式为
 与N-甲基咪唑(分子式为:
与N-甲基咪唑(分子式为: ,结构为
,结构为 )反应可以得到一种功能性螯合物。则:C、N、H三种非金属元素的电负性由大到小的顺序是
)反应可以得到一种功能性螯合物。则:C、N、H三种非金属元素的电负性由大到小的顺序是 键。
键。(5)已知周期表中存在对角相似规则,如Be与Al在周期表中处于对角线位置则化学性质相似,Be的氧化物、氢氧化物也有两性,写出Be的氢氧化物与氢氧化钠反应的化学方程式
您最近一年使用:0次
2023-03-28更新
|
693次组卷
|
3卷引用:浙江省绍兴市上虞区2022-2023学年高二上学期期末教学质量调测化学试题
名校
3 . C、O、S、 、
、 、
、 等元素的单质及化合物在诸多领域都有广泛应用。回答下列问题:
等元素的单质及化合物在诸多领域都有广泛应用。回答下列问题:
(1) 元素在元素周期表的位置是
元素在元素周期表的位置是_______ ,基态 原子能量最高的电子占据的原子轨道的形状是
原子能量最高的电子占据的原子轨道的形状是_______ ,基态 原子的简化电子排布式为
原子的简化电子排布式为_______ 。
(2)基态S原子的价层电子轨道表示式为_______ , 属于
属于_______ 分子(填“极性”或“非极性”)。
(3) 的键角
的键角_______  的键角(填“>”、“<”或“=”),理由是
的键角(填“>”、“<”或“=”),理由是_______
(4)琥珀酸亚铁片是预防和治疗缺铁性贫血的常见药物,临床建议服用维生素C促进“亚铁”的吸收,避免生成 ,从结构角度来看,
,从结构角度来看, 易被氧化成
易被氧化成 的原因是
的原因是_______ 。 比
比 的离子半径小,原因是
的离子半径小,原因是_______ 。
 、
、 、
、 等元素的单质及化合物在诸多领域都有广泛应用。回答下列问题:
等元素的单质及化合物在诸多领域都有广泛应用。回答下列问题:(1)
 元素在元素周期表的位置是
元素在元素周期表的位置是 原子能量最高的电子占据的原子轨道的形状是
原子能量最高的电子占据的原子轨道的形状是 原子的简化电子排布式为
原子的简化电子排布式为(2)基态S原子的价层电子轨道表示式为
 属于
属于(3)
 的键角
的键角 的键角(填“>”、“<”或“=”),理由是
的键角(填“>”、“<”或“=”),理由是(4)琥珀酸亚铁片是预防和治疗缺铁性贫血的常见药物,临床建议服用维生素C促进“亚铁”的吸收,避免生成
 ,从结构角度来看,
,从结构角度来看, 易被氧化成
易被氧化成 的原因是
的原因是 比
比 的离子半径小,原因是
的离子半径小,原因是
您最近一年使用:0次
2023-03-05更新
|
385次组卷
|
2卷引用:黑龙江省哈尔滨师范大学附属中学2022-2023学年高二上学期期末考试化学试题
4 . 回答下列问题
(1)C、N、O、Al、Si、Cu是常见的六种元素。
①C的基态原子核外电子排布式为___________ ;
②Cu的基态原子最外层有___________ 个电子。
(2)①N、Al、Si、Zn四种元素中,有一种元素的电离能数据如下:
则该元素是___________ (填写元素符号)。
②基态锗(Ge)原子的电子排布式是___________ 。Ge的最高价氯化物的分子式是___________ 。
③Ge元素可能的性质或应用有___________ 。
A.其是一种活泼的金属元素 B.其电负性大于硫
C.其单质可作为半导体材料 D.其最高价氯化物的沸点低于其溴化物的沸点
(1)C、N、O、Al、Si、Cu是常见的六种元素。
①C的基态原子核外电子排布式为
②Cu的基态原子最外层有
(2)①N、Al、Si、Zn四种元素中,有一种元素的电离能数据如下:
| 电离能 | I1 | I2 | I3 | I4 | …… |
| In/(kJ·mol-1) | 578 | 1817 | 2745 | 11578 | …… |
②基态锗(Ge)原子的电子排布式是
③Ge元素可能的性质或应用有
A.其是一种活泼的金属元素 B.其电负性大于硫
C.其单质可作为半导体材料 D.其最高价氯化物的沸点低于其溴化物的沸点
您最近一年使用:0次
22-23高二上·浙江·期末
5 . 回答下列问题
(1)接近水的沸点的水蒸气的相对分子质量测定值比按化学式H2O计算出来的相对分子质量大一些,主要原因是_______ 。
(2)N2、O2、 F2 跟H2的反应能力依次增强,其原因是_______ 。
(3)H3O+中H-O-H的键角比H2O的_______ (填 “大”或“小”),原因为_______ 。
(4)金属镓(Ga)位于元素周期表中第4周期IIIA族,其卤化物的熔点如下表:
GaF3熔点比GaCl3熔点高很多的原因是_______ 。
(5)已知CoCl2溶液中存在平衡: (蓝色)+6H2O
(蓝色)+6H2O 
 (粉红色)+ 4Cl-,将CoCl2溶于一定浓度盐酸后得到紫色溶液,再加水稀释可得到粉红色溶液,用平衡移动理论解释加水稀释后的现象
(粉红色)+ 4Cl-,将CoCl2溶于一定浓度盐酸后得到紫色溶液,再加水稀释可得到粉红色溶液,用平衡移动理论解释加水稀释后的现象_______ 。
(1)接近水的沸点的水蒸气的相对分子质量测定值比按化学式H2O计算出来的相对分子质量大一些,主要原因是
(2)N2、O2、 F2 跟H2的反应能力依次增强,其原因是
(3)H3O+中H-O-H的键角比H2O的
(4)金属镓(Ga)位于元素周期表中第4周期IIIA族,其卤化物的熔点如下表:
| GaF3 | GaCl3 | GaBr3 | |
| 熔点/°C | > 1000 | 77.75 | 122.3 |
(5)已知CoCl2溶液中存在平衡:
 (蓝色)+6H2O
(蓝色)+6H2O 
 (粉红色)+ 4Cl-,将CoCl2溶于一定浓度盐酸后得到紫色溶液,再加水稀释可得到粉红色溶液,用平衡移动理论解释加水稀释后的现象
(粉红色)+ 4Cl-,将CoCl2溶于一定浓度盐酸后得到紫色溶液,再加水稀释可得到粉红色溶液,用平衡移动理论解释加水稀释后的现象
您最近一年使用:0次
6 . Ⅰ.有机金属化合物的应用研究是目前科学研究的前沿之一,二茂铁[ ]的发现在有机金属化合物研究中具有里程碑意义,它开辟了有机金属化合物研究的新领域。二茂铁分子是一种金属有机配合物,熔点173℃,沸点249℃,100℃以上能升华;不溶于水,易溶于苯、乙醚、汽油等有机溶剂。环戊二烯和二茂铁的结构如下图所示。回答下列问题。
]的发现在有机金属化合物研究中具有里程碑意义,它开辟了有机金属化合物研究的新领域。二茂铁分子是一种金属有机配合物,熔点173℃,沸点249℃,100℃以上能升华;不溶于水,易溶于苯、乙醚、汽油等有机溶剂。环戊二烯和二茂铁的结构如下图所示。回答下列问题。
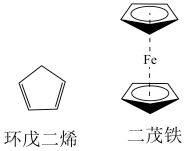
(1)环戊二烯分子中σ键和π键的个数比为_______ 。
(2)下列关于环戊二烯和二茂铁的说法正确的是_______(填字母序号)
(3)环戊二烯能使溴的四氯化碳溶液褪色。写出环戊二烯与足量溴的四氯化碳溶液反应的化学方程式_______ 。
(4)分子或离子团中的大π键可表示为 ,其中m表示参与形成大π键的原子数,n表示参与形成大π键的电子数。已知环戊二烯阴离子(
,其中m表示参与形成大π键的原子数,n表示参与形成大π键的电子数。已知环戊二烯阴离子(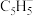 )的结构与苯分子相似,具有芳香性。苯分子中大π键可表示为
)的结构与苯分子相似,具有芳香性。苯分子中大π键可表示为 ,则
,则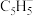 中大π键应表示为
中大π键应表示为_______ 。
Ⅱ.完成下列填空。
(5)有机物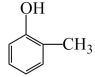 的命名为:
的命名为:_______ 。
(6)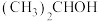 与氧气在铜催化作用下加热的化学方程式是
与氧气在铜催化作用下加热的化学方程式是_______ 。
(7)乙二醇与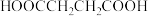 可发生缩聚反应,得到的产物结构简式为
可发生缩聚反应,得到的产物结构简式为_______ 。
 ]的发现在有机金属化合物研究中具有里程碑意义,它开辟了有机金属化合物研究的新领域。二茂铁分子是一种金属有机配合物,熔点173℃,沸点249℃,100℃以上能升华;不溶于水,易溶于苯、乙醚、汽油等有机溶剂。环戊二烯和二茂铁的结构如下图所示。回答下列问题。
]的发现在有机金属化合物研究中具有里程碑意义,它开辟了有机金属化合物研究的新领域。二茂铁分子是一种金属有机配合物,熔点173℃,沸点249℃,100℃以上能升华;不溶于水,易溶于苯、乙醚、汽油等有机溶剂。环戊二烯和二茂铁的结构如下图所示。回答下列问题。
(1)环戊二烯分子中σ键和π键的个数比为
(2)下列关于环戊二烯和二茂铁的说法正确的是_______(填字母序号)
| A.二茂铁晶体是分子晶体 |
| B.环戊烷中含有环戊二烯,可用与氢气反应除去 |
| C.环戊二烯分子中所有原子均在同一个平面上 |
| D.环戊二烯的同分异构体可能是含两个碳碳三键的炔烃 |
(4)分子或离子团中的大π键可表示为
 ,其中m表示参与形成大π键的原子数,n表示参与形成大π键的电子数。已知环戊二烯阴离子(
,其中m表示参与形成大π键的原子数,n表示参与形成大π键的电子数。已知环戊二烯阴离子(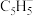 )的结构与苯分子相似,具有芳香性。苯分子中大π键可表示为
)的结构与苯分子相似,具有芳香性。苯分子中大π键可表示为 ,则
,则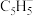 中大π键应表示为
中大π键应表示为Ⅱ.完成下列填空。
(5)有机物
 的命名为:
的命名为:(6)
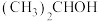 与氧气在铜催化作用下加热的化学方程式是
与氧气在铜催化作用下加热的化学方程式是(7)乙二醇与
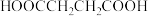 可发生缩聚反应,得到的产物结构简式为
可发生缩聚反应,得到的产物结构简式为
您最近一年使用:0次
7 . 回答下列问题:
(1)选择下列物质填空(填写序号):
①氯化钙 ②干冰 ③过氧化钠 ④氯化铵 ⑤铜晶体 ⑥氩晶体 ⑦晶体硅 ⑧石墨
固态时能导电的晶体有____ (用所给物质序号填空,下同);熔化时不破坏化学键的晶体有____ ;含有共价键的离子晶体有____ ;只由共价键构成的晶体是____ 。
(2)V原子结构示意图为:____ ,Fe2+的价电子轨道表示式为____ ;Co3+核外电子有____ 个未成对电子数。
(1)选择下列物质填空(填写序号):
①氯化钙 ②干冰 ③过氧化钠 ④氯化铵 ⑤铜晶体 ⑥氩晶体 ⑦晶体硅 ⑧石墨
固态时能导电的晶体有
(2)V原子结构示意图为:
您最近一年使用:0次
名校
8 . 已知A 、B、C、D、E为前四周期元素,其中A在宇宙中含量最高;B基态原子的3p轨道上得到1个电子后形成半充满结构;C基态原子的2p轨道上有1个电子的自旋方向与其他电子的自旋方向相反;D基态原子3d能级全空,其N能层上只有1个电子;E的原子序数等于B、D原子序数之和。回答下列问题:
(1)E在周期表中的位置是第___________ 族,属于___________ 区(填“s”、“p”或“d”)。
(2)基态C原子的价层电子轨道表示式为___________ 。
(3)基态D原子的电子排布式为___________ 。
(4)A和B形成化合物BA4的电子式为___________ 。
(5)比较第一电离能:D___________ E(填“>”、“<”或“=”, 下同);电负性:B___________ C。
(1)E在周期表中的位置是第
(2)基态C原子的价层电子轨道表示式为
(3)基态D原子的电子排布式为
(4)A和B形成化合物BA4的电子式为
(5)比较第一电离能:D
您最近一年使用:0次
2022-01-24更新
|
838次组卷
|
2卷引用:山西省太原市2021-2022学年高二上学期期末考试化学试题
名校
解题方法
9 . 近日,比亚迪宣布推出基于磷酸铁锂技术的“刀片电池”,刀片电池能量密度大,安全性高。电池的正极活性材料是LiFePO4。
(1)铁元素位于周期表第四周期第___________ 族;基态Fe2+的最外层电子排布式为 ___________ 。
(2)正极材料LiFePO4的阴离子PO 的空间构型为
的空间构型为 ___________ ,磷原子采取的杂化方式为___________ 。
(3)Fe原子或离子外围有较多能量相近的空轨道,能与SCN -、CN-、C2O 等形成配合物。
等形成配合物。
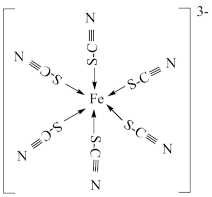
①[Fe(SCN)6]3-的结构简式如图所示,其结构中σ键和π键的个数比为___________ ;[Fe(SCN)6]3- 中含有的化学键类型是___________ (填字母) 。
a.极性共价键 b. 离子键 c.配位键 d.金属键
②K3Fe (C2O4)3·3H2O为可溶于水的晶体,某同学欲检验该晶体中Fe元素的价态,取少量晶体放入试管中,加蒸馏水使其充分溶解,再向试管中滴入几滴0.1mol·L-1KSCN溶液。
已知: i.[Fe (SCN)]2+ (aq)为血红色:
ii.25°C时,[Fe(C2O4)3]3-+SCN- [Fe(SCN)]2++3C2O
[Fe(SCN)]2++3C2O K=6. 31 × 10-17mol2·L-2上述实验方案
K=6. 31 × 10-17mol2·L-2上述实验方案___________ (填“可行”或“不可行”),并解释其原因___________ 。
(1)铁元素位于周期表第四周期第
(2)正极材料LiFePO4的阴离子PO
 的空间构型为
的空间构型为 (3)Fe原子或离子外围有较多能量相近的空轨道,能与SCN -、CN-、C2O
 等形成配合物。
等形成配合物。①[Fe(SCN)6]3-的结构简式如图所示,其结构中σ键和π键的个数比为
a.极性共价键 b. 离子键 c.配位键 d.金属键

②K3Fe (C2O4)3·3H2O为可溶于水的晶体,某同学欲检验该晶体中Fe元素的价态,取少量晶体放入试管中,加蒸馏水使其充分溶解,再向试管中滴入几滴0.1mol·L-1KSCN溶液。
已知: i.[Fe (SCN)]2+ (aq)为血红色:
ii.25°C时,[Fe(C2O4)3]3-+SCN-
 [Fe(SCN)]2++3C2O
[Fe(SCN)]2++3C2O K=6. 31 × 10-17mol2·L-2上述实验方案
K=6. 31 × 10-17mol2·L-2上述实验方案
您最近一年使用:0次
2022-01-22更新
|
801次组卷
|
3卷引用:山东省菏泽市2021-2022学年高二上学期期末教学质量检测化学试题
名校
10 . 如图所示为金属原子的四种基本堆积(分别为:简单立方堆积、六方最密堆积、面心立方最密堆积、体心立方堆积、)模型,请回答以下问题:
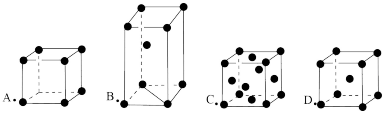
(1)图中原子堆积方式中,空间利用率最低 的是____ (在图中选择,填字母),由非密置层互相错位堆积而成的是_____ 。
(2)金属钛的晶胞为B型,其堆积方式的名称 为_____ 。
(3)某金属R的晶胞为D型,已知R原子半径为rcm,相对原子质量为M,阿佛加得德罗常数为NA,则R金属的密度____ 。(用含r、M、NA字母的式子表示)

(1)图中原子堆积方式中,空间利用率最
(2)金属钛的晶胞为B型,其堆积方式的
(3)某金属R的晶胞为D型,已知R原子半径为rcm,相对原子质量为M,阿佛加得德罗常数为NA,则R金属的密度
您最近一年使用:0次



