名校
1 . 回答下列问题
(1)铜及其化合物是化工生产、生活中常用的材料。
① 价层电子的轨道表达式为
价层电子的轨道表达式为__________ 。
② 为平面正方形结构,其中的两个
为平面正方形结构,其中的两个 被
被 取代后有两种不同的结构,画出
取代后有两种不同的结构,画出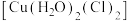 是非极性分子的结构为
是非极性分子的结构为__________ 。
③ 中
中 的键角比独立存在的
的键角比独立存在的 分子结构中的键角
分子结构中的键角__________ (填“大”“小”或“相等”)。
④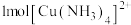 中存在
中存在__________ 个 键。
键。
(2) 常温下为无色液体,沸点42.1℃,熔点
常温下为无色液体,沸点42.1℃,熔点 ℃,难溶于水,易溶于有机溶剂。推测
℃,难溶于水,易溶于有机溶剂。推测 的晶体类型为
的晶体类型为__________ ,是__________ 分子(填“极性”或“非极性”)。
(3)氮化镓是一种新型半导体材料。晶胞结构可看作金刚石晶胞内部的碳原子被N原子代替,顶点和面心的碳原子被Ga原子代替。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标。__________ 。
②若晶胞中Ga和N原子的最近距离为a pm,阿伏加德罗常数的值为 ,则氮化镓的晶体密度为
,则氮化镓的晶体密度为__________  (列出计算表达式)。
(列出计算表达式)。
(1)铜及其化合物是化工生产、生活中常用的材料。
①
 价层电子的轨道表达式为
价层电子的轨道表达式为②
 为平面正方形结构,其中的两个
为平面正方形结构,其中的两个 被
被 取代后有两种不同的结构,画出
取代后有两种不同的结构,画出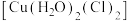 是非极性分子的结构为
是非极性分子的结构为③
 中
中 的键角比独立存在的
的键角比独立存在的 分子结构中的键角
分子结构中的键角④
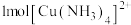 中存在
中存在 键。
键。(2)
 常温下为无色液体,沸点42.1℃,熔点
常温下为无色液体,沸点42.1℃,熔点 ℃,难溶于水,易溶于有机溶剂。推测
℃,难溶于水,易溶于有机溶剂。推测 的晶体类型为
的晶体类型为(3)氮化镓是一种新型半导体材料。晶胞结构可看作金刚石晶胞内部的碳原子被N原子代替,顶点和面心的碳原子被Ga原子代替。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标。
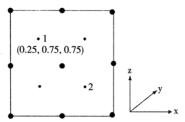
②若晶胞中Ga和N原子的最近距离为a pm,阿伏加德罗常数的值为
 ,则氮化镓的晶体密度为
,则氮化镓的晶体密度为 (列出计算表达式)。
(列出计算表达式)。
您最近半年使用:0次
名校
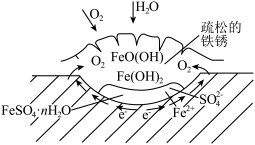
2 . 铁的化学性质比较活泼,能形成众多化合物,铁的合金是使用量最大的合金。铁制品易生锈,锈层内有硫酸盐时的腐蚀原理如图所示。 的价电子排布式为
的价电子排布式为___________ 。
(2) 的空间构型是
的空间构型是___________ ,图中属于非极性分子的是___________ (填化学式)。
(3)冰融化时需要克服的作用力类型是___________ 。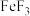 的熔点为1000℃,
的熔点为1000℃, 的熔点为200℃,则两种物质中的化学键类型
的熔点为200℃,则两种物质中的化学键类型___________ (填“相同”或“不同”)。
(4)铁能形成多种氧化物,其中一种氧化物的晶胞结构如图所示:___________ ,该氧化物的化学式为___________ 。
②设 表示阿伏加德罗常数的值,若该晶胞的参数为a nm,则该晶体的密度为
表示阿伏加德罗常数的值,若该晶胞的参数为a nm,则该晶体的密度为___________  (用含a、
(用含a、 的代数式表示)。
的代数式表示)。
 的价电子排布式为
的价电子排布式为(2)
 的空间构型是
的空间构型是(3)冰融化时需要克服的作用力类型是
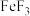 的熔点为1000℃,
的熔点为1000℃, 的熔点为200℃,则两种物质中的化学键类型
的熔点为200℃,则两种物质中的化学键类型(4)铁能形成多种氧化物,其中一种氧化物的晶胞结构如图所示:
②设
 表示阿伏加德罗常数的值,若该晶胞的参数为a nm,则该晶体的密度为
表示阿伏加德罗常数的值,若该晶胞的参数为a nm,则该晶体的密度为 (用含a、
(用含a、 的代数式表示)。
的代数式表示)。
您最近半年使用:0次
名校
3 . 配位键是一种特殊的共价键,即共用电子对由某原子单方面提供和另一缺电子的粒子结合。据此,回答下列问题:
(1)下列粒子中可能存在配位键的是___________。
(2)硼酸( )溶液呈酸性,试写出其电离方程式:
)溶液呈酸性,试写出其电离方程式:___________ 。
(3)科学家对 结构的认识经历了较为漫长的过程,最初,科学家提出了种观点:
结构的认识经历了较为漫长的过程,最初,科学家提出了种观点: 与浓
与浓 反应生成
反应生成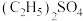 和水;
和水;
b.将制得的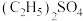 与
与 反应,只生成A和
反应,只生成A和 ;
;
c.将生成的A与 反应(已知该反应中
反应(已知该反应中 作还原剂)。
作还原剂)。
①如果 的结构如甲所示,实验c中化学反应方程式为(A写结构简式)
的结构如甲所示,实验c中化学反应方程式为(A写结构简式)___________ 。
②为了进一步确定 的结构,还需要在实验c后添加一步实验d,请设计d的实验方案:
的结构,还需要在实验c后添加一步实验d,请设计d的实验方案:___________ 。
(1)下列粒子中可能存在配位键的是___________。
A. | B. | C. | D. |
(2)硼酸(
 )溶液呈酸性,试写出其电离方程式:
)溶液呈酸性,试写出其电离方程式:(3)科学家对
 结构的认识经历了较为漫长的过程,最初,科学家提出了种观点:
结构的认识经历了较为漫长的过程,最初,科学家提出了种观点:甲: 、乙:
、乙: ,式中O→O表示配位键,在化学反应中O→O键遇到还原剂时易断裂。化学家Baeyer和Villiyer为研究
,式中O→O表示配位键,在化学反应中O→O键遇到还原剂时易断裂。化学家Baeyer和Villiyer为研究 的结构,设计并完成了下列实验:
的结构,设计并完成了下列实验:
 与浓
与浓 反应生成
反应生成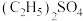 和水;
和水;b.将制得的
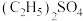 与
与 反应,只生成A和
反应,只生成A和 ;
;c.将生成的A与
 反应(已知该反应中
反应(已知该反应中 作还原剂)。
作还原剂)。①如果
 的结构如甲所示,实验c中化学反应方程式为(A写结构简式)
的结构如甲所示,实验c中化学反应方程式为(A写结构简式)②为了进一步确定
 的结构,还需要在实验c后添加一步实验d,请设计d的实验方案:
的结构,还需要在实验c后添加一步实验d,请设计d的实验方案:
您最近半年使用:0次
4 . 门捷列夫认为氮、碳、氧、氢是“四大天王”元素,它们与宇宙和生命的形成都有密切联系,可以相互结合成很多化合物。
(1)四种元素中,核外未成对电子数目相同的元素有___________ (填写元素符号,下同);四种元素的原子半径由大到小的顺序为___________ 。
(2)HCN是生命演化过程中的基础物质之一。已知HCN中C、N都满足8电子稳定结构,则HCN的电子式为___________ ;其中C、N之间的共用电子对偏向的元素是___________ ,从原子结构角度解释其原因___________ 。
(3)N2O是医学上的一-种麻醉剂,可以通过反应NH3+O2→N2O+H2O制得,配平该反应的化学方程式___________ ,若生成1.8g水,转移的电子数目为___________ 个(结构保留两位有效数字)。
(1)四种元素中,核外未成对电子数目相同的元素有
(2)HCN是生命演化过程中的基础物质之一。已知HCN中C、N都满足8电子稳定结构,则HCN的电子式为
(3)N2O是医学上的一-种麻醉剂,可以通过反应NH3+O2→N2O+H2O制得,配平该反应的化学方程式
您最近半年使用:0次
22-23高二下·浙江·期中
解题方法
5 . 小沁老师在检查同学们的笔记时,由于错误过多而火冒三丈,把红笔扔下,请你帮助她找出剩下的笔记中需要更改的内容_______ 。

A.在上图的晶胞中,原子分数坐标参数A为 ,C为
,C为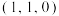 ,B为
,B为 ,则E原子的坐标为
,则E原子的坐标为
B.邻羟基苯乙醛的结构简式(虚线表示氢键):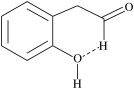
C.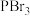 的VSEPR模型:正四面体型
的VSEPR模型:正四面体型
D.标况下 氯乙烷分子数:
氯乙烷分子数:
E.硼烷氨络合物( )的结构式:
)的结构式: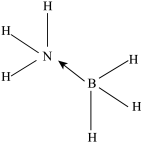

A.在上图的晶胞中,原子分数坐标参数A为
 ,C为
,C为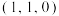 ,B为
,B为 ,则E原子的坐标为
,则E原子的坐标为
B.邻羟基苯乙醛的结构简式(虚线表示氢键):

C.
 的VSEPR模型:正四面体型
的VSEPR模型:正四面体型D.标况下
 氯乙烷分子数:
氯乙烷分子数:
E.硼烷氨络合物(
 )的结构式:
)的结构式:
您最近半年使用:0次
2023高三·全国·专题练习
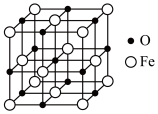
6 . FeS2晶胞为立方体,边长为 ,如图所示。
,如图所示。
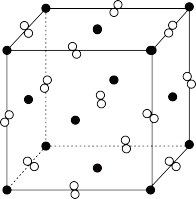
(1)①与Fe2+紧邻的阴离子个数为___________ 。
②晶胞的密度为
___________  。
。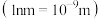
(2)以FeS2为燃料,配合FeSO4·H2O可以制备铁粉精(FexOy)和H2SO4。结合图示解释可充分实现能源和资源有效利用的原因为___________ 。

 ,如图所示。
,如图所示。
(1)①与Fe2+紧邻的阴离子个数为
②晶胞的密度为

 。
。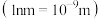
(2)以FeS2为燃料,配合FeSO4·H2O可以制备铁粉精(FexOy)和H2SO4。结合图示解释可充分实现能源和资源有效利用的原因为

您最近半年使用:0次
2023高三·全国·专题练习
7 . 回答下列问题:
(1)将白色CuSO4粉末溶解于水中,溶液呈蓝色,是因为生成了一种呈蓝色的配位数是4的配离子,请写出生成此配离子的离子方程式:________ ,蓝色溶液中的阳离子内存在的全部化学键类型有_______ 。1mol该阳离子中含σ键个数为_______ 。
(2)CuSO4•5H2O(胆矾)中含有水合铜离子而呈蓝色,写出胆矾晶体中水合铜离子的结构简式(必须将配位键表示出来):________ 。
(3)向CuSO4溶液中滴加氨水会生成蓝色沉淀,再滴加氨水到沉淀刚好全部溶解可得到深蓝色溶液,继续向其中加入极性较小的乙醇可以析出深蓝色的[Cu(NH3)4]SO4•H2O晶体。下列说法不正确的是_______ (填字母)。
a.[Cu(NH3)4]SO4的组成元素中电负性最大的是N元素
b.CuSO4晶体及[Cu(NH3)4]SO4•H2O中S原子的杂化方式均为sp3
c.[Cu(NH3)4]SO4所含有的化学键有离子键、共价键和配位键
d.NH3分子内的H-N-H键角大于H2O分子内的H-O-H键角
e.SO 的空间结构为正四面体形
的空间结构为正四面体形
f.[Cu(NH3)4]2+中,N原子是配位原子
g.NH3分子中氮原子的杂化轨道类型为sp2
(1)将白色CuSO4粉末溶解于水中,溶液呈蓝色,是因为生成了一种呈蓝色的配位数是4的配离子,请写出生成此配离子的离子方程式:
(2)CuSO4•5H2O(胆矾)中含有水合铜离子而呈蓝色,写出胆矾晶体中水合铜离子的结构简式(必须将配位键表示出来):
(3)向CuSO4溶液中滴加氨水会生成蓝色沉淀,再滴加氨水到沉淀刚好全部溶解可得到深蓝色溶液,继续向其中加入极性较小的乙醇可以析出深蓝色的[Cu(NH3)4]SO4•H2O晶体。下列说法不正确的是
a.[Cu(NH3)4]SO4的组成元素中电负性最大的是N元素
b.CuSO4晶体及[Cu(NH3)4]SO4•H2O中S原子的杂化方式均为sp3
c.[Cu(NH3)4]SO4所含有的化学键有离子键、共价键和配位键
d.NH3分子内的H-N-H键角大于H2O分子内的H-O-H键角
e.SO
 的空间结构为正四面体形
的空间结构为正四面体形f.[Cu(NH3)4]2+中,N原子是配位原子
g.NH3分子中氮原子的杂化轨道类型为sp2
您最近半年使用:0次
名校
解题方法
8 . 自然界中许多固态物质都是晶体,它们们有规则的几何外形,如晶莹的雪花、玲珑剔透的石英、棱角分明的食盐固体和许多矿石。我们的生活因此而多美丽。
(1)区分晶体和非晶体最科学的方法是_________ (填选项序号,下同)
A.比较硬度 B.对固体进行X射线衍射 C.看是否有规则的几何外形
(2)下列各组物质的晶体中,化学键类型、晶体类型都相同的是
(3)下列物质性质的变化规律,与化学键的强弱无关的是
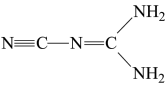
(4)某物质(结构简式如图所示)可溶于水、乙醇,熔点为209.5 ℃。下列说法不正确的是 。
(5)随着科学技术的不断进步,研究物质的手段和途径越来越多,H3、O4、C60、N 等已被发现。下列有关说法中,正确的是 。
等已被发现。下列有关说法中,正确的是 。
(1)区分晶体和非晶体最科学的方法是
A.比较硬度 B.对固体进行X射线衍射 C.看是否有规则的几何外形
(2)下列各组物质的晶体中,化学键类型、晶体类型都相同的是
| A.CO2和SO2 | B.NaCl和HCl | C.H2S和H2O | D.CF2Cl2和CH3COONa |
(3)下列物质性质的变化规律,与化学键的强弱无关的是
| A.金刚石的硬度、熔点、沸点都高于晶体硅 |
| B.Li、Na、K、Rb的熔点、沸点逐渐降低 |
| C.NaF、NaCl、NaBr、NaI的熔点依次降低 |
| D.F2、Cl2、Br2、I2的熔点、沸点逐渐升高 |
(4)某物质(结构简式如图所示)可溶于水、乙醇,熔点为209.5 ℃。下列说法不正确的是 。

| A.该物质为共价晶体 |
| B.该物质分子中含有极性共价键 |
| C.该物质分子中σ键和π键的个数比为3∶1 |
| D.该物质分子中每个原子最外层均达到8电子稳定结构 |
(5)随着科学技术的不断进步,研究物质的手段和途径越来越多,H3、O4、C60、N
 等已被发现。下列有关说法中,正确的是 。
等已被发现。下列有关说法中,正确的是 。| A.H2 与 H3 中存在氢键 | B.O2 与 O4 互为同位素 |
| C.C60 分子中有范德华力 | D.N 中含有 24 个价电子 中含有 24 个价电子 |
您最近半年使用:0次
名校
解题方法
9 . ⅤA族元素(N、P、As、Sb、Bi等)在生活中占有重要地位。请回答:
(1)叠氮酸根离子 的空间结构名称为
的空间结构名称为___________ ;中心氮原子的杂化轨道类型是___________ ;叠氮化钠 用于汽车的安全气囊中,当汽车发生剧烈碰撞时,可分解生成Na和
用于汽车的安全气囊中,当汽车发生剧烈碰撞时,可分解生成Na和 ,
, 不稳定而分解的原因是
不稳定而分解的原因是___________ 。
(2)实验室测得分子式为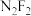 的化合物有两种不同的熔点和沸点:
的化合物有两种不同的熔点和沸点:
B的结构式为___________ 。
(3)已知P可以与Cl形成多种化合物,如: 、
、 、
、 等,下列说法
等,下列说法不正确 的是___________。
(4)Fe、Sb与O形成的某化合物晶体的晶胞如图。该化合物的化学式为___________ 。
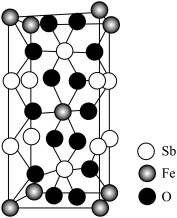
(1)叠氮酸根离子
 的空间结构名称为
的空间结构名称为 用于汽车的安全气囊中,当汽车发生剧烈碰撞时,可分解生成Na和
用于汽车的安全气囊中,当汽车发生剧烈碰撞时,可分解生成Na和 ,
, 不稳定而分解的原因是
不稳定而分解的原因是(2)实验室测得分子式为
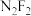 的化合物有两种不同的熔点和沸点:
的化合物有两种不同的熔点和沸点:| 熔点/℃ | 沸点/℃ | |
| A |  | 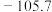 |
| B |  | 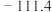 |
(3)已知P可以与Cl形成多种化合物,如:
 、
、 、
、 等,下列说法
等,下列说法A.微粒半径: |
| B.同周期中第一电离能小于P的元素有4种 |
C.根据电负性差异, 的水解产物为 的水解产物为 和 和 |
D.已知 以 以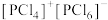 的形式存在,熔融时不导电,可推测熔融时 的形式存在,熔融时不导电,可推测熔融时 可能转化为 可能转化为 |

您最近半年使用:0次
2023-08-08更新
|
538次组卷
|
3卷引用:浙江省杭州市强基联盟2023届高三下学期2月统测化学试题
名校
解题方法
10 . 我国力争在2030年前实现“碳达峰”。2060年前实现“碳中和”的目标,因此二氧化碳的固定及转化成了重要的研究课题。
Ⅰ.在 催化作用下
催化作用下 和
和 反应生成甲醇:
反应生成甲醇: ;
;
Ⅱ.新型 水介质电池放电时,温室气体
水介质电池放电时,温室气体 被转化为储能物质
被转化为储能物质 。
。
请回答下列问题:
(1)基态Cu原子的外围电子排布式为___________ ,基态O原子核外有___________ 种不同运动状态的电子。
(2)Ⅰ中涉及的 、
、 、
、 、
、 ,属于非极性分子的是
,属于非极性分子的是___________ (填化学式)。
(3) 分子中碳原子的杂化轨道类型为
分子中碳原子的杂化轨道类型为___________ ,分子中含有的 键和
键和 键数目之比为
键数目之比为___________ 。
(4) 反应中,
反应中, 的立体构型为
的立体构型为___________ , 的沸点高于
的沸点高于 的原因是
的原因是___________ 。
(5)氧化锌(ZnO),俗称锌白,是一种常用的化学添加剂,广泛地应用于塑料、硅酸盐制品、合成橡胶等产品的制作中。一种ZnO的立方晶胞如图所示。
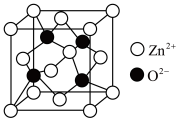
① 周围距离最近且等距的
周围距离最近且等距的 数目为
数目为___________ 。
②设晶胞边长为anm, 为阿伏加德罗常数的值,该晶体的密度为
为阿伏加德罗常数的值,该晶体的密度为___________  。
。
Ⅰ.在
 催化作用下
催化作用下 和
和 反应生成甲醇:
反应生成甲醇: ;
;Ⅱ.新型
 水介质电池放电时,温室气体
水介质电池放电时,温室气体 被转化为储能物质
被转化为储能物质 。
。请回答下列问题:
(1)基态Cu原子的外围电子排布式为
(2)Ⅰ中涉及的
 、
、 、
、 、
、 ,属于非极性分子的是
,属于非极性分子的是(3)
 分子中碳原子的杂化轨道类型为
分子中碳原子的杂化轨道类型为 键和
键和 键数目之比为
键数目之比为(4)
 反应中,
反应中, 的立体构型为
的立体构型为 的沸点高于
的沸点高于 的原因是
的原因是(5)氧化锌(ZnO),俗称锌白,是一种常用的化学添加剂,广泛地应用于塑料、硅酸盐制品、合成橡胶等产品的制作中。一种ZnO的立方晶胞如图所示。

①
 周围距离最近且等距的
周围距离最近且等距的 数目为
数目为②设晶胞边长为anm,
 为阿伏加德罗常数的值,该晶体的密度为
为阿伏加德罗常数的值,该晶体的密度为 。
。
您最近半年使用:0次
2023-07-30更新
|
888次组卷
|
4卷引用:内蒙古名校联盟2022-2023学年高二下学期期末考试化学试题



