名校
解题方法
1 . ⅤA族元素(N、P、As、Sb、Bi等)在生活中占有重要地位。请回答:
(1)叠氮酸根离子 的空间结构名称为
的空间结构名称为___________ ;中心氮原子的杂化轨道类型是___________ ;叠氮化钠 用于汽车的安全气囊中,当汽车发生剧烈碰撞时,可分解生成Na和
用于汽车的安全气囊中,当汽车发生剧烈碰撞时,可分解生成Na和 ,
, 不稳定而分解的原因是
不稳定而分解的原因是___________ 。
(2)实验室测得分子式为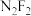 的化合物有两种不同的熔点和沸点:
的化合物有两种不同的熔点和沸点:
B的结构式为___________ 。
(3)已知P可以与Cl形成多种化合物,如: 、
、 、
、 等,下列说法
等,下列说法不正确 的是___________。
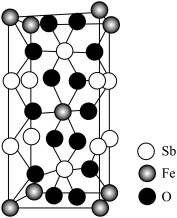
(4)Fe、Sb与O形成的某化合物晶体的晶胞如图。该化合物的化学式为___________ 。
(1)叠氮酸根离子
 的空间结构名称为
的空间结构名称为 用于汽车的安全气囊中,当汽车发生剧烈碰撞时,可分解生成Na和
用于汽车的安全气囊中,当汽车发生剧烈碰撞时,可分解生成Na和 ,
, 不稳定而分解的原因是
不稳定而分解的原因是(2)实验室测得分子式为
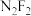 的化合物有两种不同的熔点和沸点:
的化合物有两种不同的熔点和沸点:| 熔点/℃ | 沸点/℃ | |
| A |  | 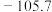 |
| B |  | 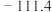 |
(3)已知P可以与Cl形成多种化合物,如:
 、
、 、
、 等,下列说法
等,下列说法A.微粒半径: |
| B.同周期中第一电离能小于P的元素有4种 |
C.根据电负性差异, 的水解产物为 的水解产物为 和 和 |
D.已知 以 以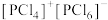 的形式存在,熔融时不导电,可推测熔融时 的形式存在,熔融时不导电,可推测熔融时 可能转化为 可能转化为 |

您最近一年使用:0次
2023-08-08更新
|
557次组卷
|
3卷引用:浙江省杭州市强基联盟2023届高三下学期2月统测化学试题
名校
解题方法
2 . 判断下列晶体类型。(填分子晶体、离子晶体、原子晶体或者金属晶体)
(1)SiI4:熔点为120.5℃,沸点为271.5℃,易水解,为___________ 。
(2)硼:熔点为2300℃,沸点为2550℃,硬度大,为___________ 。
(3)硒:熔点为217℃,沸点为685℃,溶于氯仿,为___________ 。
(4)锑:熔点为630.74℃,沸点为1750℃,可导电,为___________ 。
(1)SiI4:熔点为120.5℃,沸点为271.5℃,易水解,为
(2)硼:熔点为2300℃,沸点为2550℃,硬度大,为
(3)硒:熔点为217℃,沸点为685℃,溶于氯仿,为
(4)锑:熔点为630.74℃,沸点为1750℃,可导电,为
您最近一年使用:0次
2021-06-10更新
|
407次组卷
|
4卷引用:人教版高中化学选修三:3.3金属晶体(第1课时)(同步训练)
解题方法
3 . 用以下微粒的化学符号回答下列问题:
① ②
②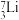 ③
③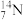 ④
④ ⑤
⑤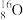 ⑥
⑥ ⑦
⑦ ⑧
⑧ ⑨
⑨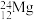
(1)上述微粒共涉及__________ (填数字)种元素。
(2)互为同位素的核素是__________ 。
(3)上述微粒中,中子数相同的核素为__________ 和__________ ,__________ 和__________ .
①
 ②
②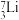 ③
③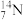 ④
④ ⑤
⑤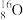 ⑥
⑥ ⑦
⑦ ⑧
⑧ ⑨
⑨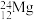
(1)上述微粒共涉及
(2)互为同位素的核素是
(3)上述微粒中,中子数相同的核素为
您最近一年使用:0次
4 . 下表是元素周期表的一部分,表中每一序号分别代表一种元素。

(1)元素⑥的元素名称是__ 。元素⑤位于元素周期表__ 区。
(2)元素①原子的价电子数是__ 。元素⑨在元素周期表的第四周期第__ 族。
(3)在元素①、②、③中,非金属性最强的是__ (用所对应的元素符号表示,下同),第一电离能最大的是__ 。元素③、⑦、⑧的简单离子的半径由大到小的顺序为__ (请填序号,不要加任何连接符号)。
(4)元素⑩的单质可能具有的性质是__ (填字母)。
a.能导电导热 b.能与稀盐酸反应生成氢气 c.其晶体属离子晶体
(5)在元素④、⑤、⑥的最高价氧化物中,具有两性的是__ (填化学式)。
在元素①~⑩的最高价氧化物的水化物中,酸性最强的是__ (填化学式)。
(6)元素⑨原子的外围电子排布为__ 。

(1)元素⑥的元素名称是
(2)元素①原子的价电子数是
(3)在元素①、②、③中,非金属性最强的是
(4)元素⑩的单质可能具有的性质是
a.能导电导热 b.能与稀盐酸反应生成氢气 c.其晶体属离子晶体
(5)在元素④、⑤、⑥的最高价氧化物中,具有两性的是
在元素①~⑩的最高价氧化物的水化物中,酸性最强的是
(6)元素⑨原子的外围电子排布为
您最近一年使用:0次



