解题方法
1 . 硼的总浓度≥0.4mol·L-1的硼酸及其盐的水溶液中不仅存在四硼酸根离子
B4O5(OH) ,还存在电荷为-1的五硼酸根离子以及电荷为-1和-2的两种三硼酸根离子。这些多硼酸根离子均由B(OH)3和B(OH)
,还存在电荷为-1的五硼酸根离子以及电荷为-1和-2的两种三硼酸根离子。这些多硼酸根离子均由B(OH)3和B(OH) 缩合而成,结构中硼原子以B-O-B的方式连接成环。
缩合而成,结构中硼原子以B-O-B的方式连接成环。
(1)上述五硼酸根离子中,所有三配位硼原子的化学环境完全相同,画出其结构示意图(不画孤对电子,羟基用-OH表达)_______ 。
(2)下图表示硼酸-硼酸盐体系在硼的总浓度为0.4mol·L-1'时,其存在形式与pH的关系。1、2、3、4分别为4种多硼酸根离子存在的区域。推出1、2、3、4分别对应的多硼酸根离子的化学式_______ 。
注:以B4O5(OH) 为范例,书写其他3种多硼酸根离子的化学式;形成这些物种的缩合反应速率几乎相同,其排列顺序不受反应速率制约;本体系中缩合反应不改变硼原子的配位数。
为范例,书写其他3种多硼酸根离子的化学式;形成这些物种的缩合反应速率几乎相同,其排列顺序不受反应速率制约;本体系中缩合反应不改变硼原子的配位数。

B4O5(OH)
 ,还存在电荷为-1的五硼酸根离子以及电荷为-1和-2的两种三硼酸根离子。这些多硼酸根离子均由B(OH)3和B(OH)
,还存在电荷为-1的五硼酸根离子以及电荷为-1和-2的两种三硼酸根离子。这些多硼酸根离子均由B(OH)3和B(OH) 缩合而成,结构中硼原子以B-O-B的方式连接成环。
缩合而成,结构中硼原子以B-O-B的方式连接成环。(1)上述五硼酸根离子中,所有三配位硼原子的化学环境完全相同,画出其结构示意图(不画孤对电子,羟基用-OH表达)
(2)下图表示硼酸-硼酸盐体系在硼的总浓度为0.4mol·L-1'时,其存在形式与pH的关系。1、2、3、4分别为4种多硼酸根离子存在的区域。推出1、2、3、4分别对应的多硼酸根离子的化学式
注:以B4O5(OH)
 为范例,书写其他3种多硼酸根离子的化学式;形成这些物种的缩合反应速率几乎相同,其排列顺序不受反应速率制约;本体系中缩合反应不改变硼原子的配位数。
为范例,书写其他3种多硼酸根离子的化学式;形成这些物种的缩合反应速率几乎相同,其排列顺序不受反应速率制约;本体系中缩合反应不改变硼原子的配位数。
您最近一年使用:0次
名校
解题方法
2 . 有A、B、C、D、E、F、G、H八种元素,除G、H为第四周期元素外其余均为短周期元素。A、E、G位于元素周期表的s区,B、C、D、F元素位于p区。A、G的原子外围电子层排布相同,A的原子中没有成对电子;B元素基态原子中电子占据三种能量不同的原子轨道且每种轨道中的电子总数相同;C元素原子的外围电子层排布式为nsnnpn+1;D的基态原子核外成对电子数是成单电子数的3倍;E的基态原子占据两种形状的原子轨道,且两种形状轨道中的电子总数均相同;F元素位于第三周期,且F元素的第一电离能列同周期主族元素第三高;H的原子中质子数等于B、C、F的原子中质子数之和。回答问题:
(1)B、C、D三种元素中元素的第一电离能最大的是_______ (填元素符号);
(2)由A与D形成的A2D分子空间构型是_______ 形,分子中D原子的杂化类型是_____ 杂化;
(3)由D、E、F、G形成的盐G2FD4、EFD4的共熔体在冷却时首先析出的物质是____ (写化学式),原因是________ 。
(4)元素D与H形成的常见化合物晶胞如图所示,该晶胞参数为apm,化合物的化学式为____ ,计算该晶胞密度为_____ g/cm3(写出表达式即可)。

(1)B、C、D三种元素中元素的第一电离能最大的是
(2)由A与D形成的A2D分子空间构型是
(3)由D、E、F、G形成的盐G2FD4、EFD4的共熔体在冷却时首先析出的物质是
(4)元素D与H形成的常见化合物晶胞如图所示,该晶胞参数为apm,化合物的化学式为

您最近一年使用:0次
解题方法
3 . 亚铁氰化钾(K4[Fe(CN)6])双称黄血盐,用于检验Fe3+,也用作实验的防结剂。检验三价铁发生的反应为:K4[Fe(CN)6]+FeCl3=KFe[Fe(CN)6]↓(滕氏蓝)+3KCl,回答问题:
(1)基态Fe3+电子填充的最高能级符号为___________ 。
(2)K4[Fe(CN)6]中的作用力除离子键和共价键外,还有___________ 。含有12 mol σ键的KFe[Fe(CN)6]的物质的量为___________ mol。
(3)黄血盐中N原子的杂化方式为______ ;C、N、O的第一电离能由大到小的排序为________ ,与CN-互为等电子体的分子是________ ,离子是________ 。
(4)Fe、Na、K的晶体结构如图所示。

①钠的熔点比钾更高,原因是_____________ 。
②Fe原子半径是r cm,阿伏加 德罗常数为NA,铁的相对原子质量为a,则铁单质的密度是_______ g/cm3。
(1)基态Fe3+电子填充的最高能级符号为
(2)K4[Fe(CN)6]中的作用力除离子键和共价键外,还有
(3)黄血盐中N原子的杂化方式为
(4)Fe、Na、K的晶体结构如图所示。

①钠的熔点比钾更高,原因是
②Fe原子半径是r cm,阿伏加 德罗常数为NA,铁的相对原子质量为a,则铁单质的密度是
您最近一年使用:0次
解题方法
4 . 过氧乙酸又名过醋酸 ,是重要化工原料,也是一种绿色生态杀菌剂,其制法为
,是重要化工原料,也是一种绿色生态杀菌剂,其制法为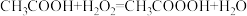 。
。
(1)某同学写出了碳原子的4种不同状态的电子排布图:
a.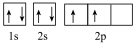 b.
b.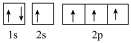
c.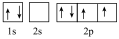 d.
d.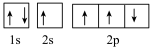
其中能量最低的是________ (填标号),电子由状态C到状态B所得到的光谱为________ 光谱(填“原子发射”或“原子吸收”)。
(2)过氧乙酸分子中C原子的杂化方式有________ 。
(3)乙酸比乙醇易电离出 的原因
的原因____________________ 。
(4)熔点:乙酸________ 硝酸(填“>”、“<”或“=”),理由_________________ 。
(5)造纸中,用 与纸浆中的过氧乙酸以及过渡金属离子反应以提高漂白效率。硼氢化钠、硼氢化铝被认为是有机化学上的“万能还原剂”。
与纸浆中的过氧乙酸以及过渡金属离子反应以提高漂白效率。硼氢化钠、硼氢化铝被认为是有机化学上的“万能还原剂”。
①两种硼氢化物的熔点如下表所示:
解释表中两种物质熔点差异的原因________ 。
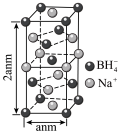
②硼氢化钠晶胞结构如图所示,该晶体中 的配位数为
的配位数为________ 。已知:硼氢化钠晶体的密度为 ,
, 代表阿伏加 德罗常数的值,则a=
代表阿伏加 德罗常数的值,则a=________ nm(用含 、
、 的最简式子表示)。
的最简式子表示)。
 ,是重要化工原料,也是一种绿色生态杀菌剂,其制法为
,是重要化工原料,也是一种绿色生态杀菌剂,其制法为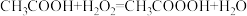 。
。(1)某同学写出了碳原子的4种不同状态的电子排布图:
a.
 b.
b.
c.
 d.
d.
其中能量最低的是
(2)过氧乙酸分子中C原子的杂化方式有
(3)乙酸比乙醇易电离出
 的原因
的原因(4)熔点:乙酸
(5)造纸中,用
 与纸浆中的过氧乙酸以及过渡金属离子反应以提高漂白效率。硼氢化钠、硼氢化铝被认为是有机化学上的“万能还原剂”。
与纸浆中的过氧乙酸以及过渡金属离子反应以提高漂白效率。硼氢化钠、硼氢化铝被认为是有机化学上的“万能还原剂”。①两种硼氢化物的熔点如下表所示:
| 硼氢化物 |  |  |
| 熔点/℃ | 400 | -64.5 |
解释表中两种物质熔点差异的原因
②硼氢化钠晶胞结构如图所示,该晶体中
 的配位数为
的配位数为 ,
, 代表阿伏加 德罗常数的值,则a=
代表阿伏加 德罗常数的值,则a= 、
、 的最简式子表示)。
的最简式子表示)。
您最近一年使用:0次
2020-06-12更新
|
1870次组卷
|
3卷引用:福建省漳州市2020届高三第三次教学质量检测理科综合化学试题
解题方法
5 .  与铀氮化物是重要的核燃料,已知某温度下三碳酸铀酰铵可发生如下分解反应:
与铀氮化物是重要的核燃料,已知某温度下三碳酸铀酰铵可发生如下分解反应: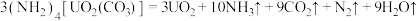 。阿伏加 德罗常数的值为
。阿伏加 德罗常数的值为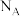 。
。
回答下列问题:
(1)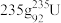 发生裂变反应:
发生裂变反应: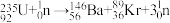 ,净产生的中子(
,净产生的中子(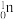 )数为
)数为________ 。基态 原子的外围电子排布式为
原子的外围电子排布式为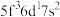 ,则处于下列状态的铀原子或离子失去一个电子所需的能量最高的为
,则处于下列状态的铀原子或离子失去一个电子所需的能量最高的为________ (填序号)。
A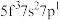 B
B 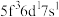 C
C  D
D 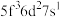
(2) 和
和 中,沸点较高的为
中,沸点较高的为________ ,与 形成的配离子稳定性较高的为
形成的配离子稳定性较高的为________ 。
(3) 中存在大
中存在大 键,形成该大
键,形成该大 键的电子数为
键的电子数为________ 。
(4)某种铀氮化物的晶体结构与 相同。
相同。 的Bom-Haber循环如图所示。
的Bom-Haber循环如图所示。
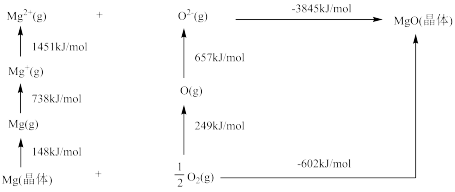
① 晶格能为
晶格能为________  。
。
② 的第二电离能大于
的第二电离能大于 的第二电离能,是由于
的第二电离能,是由于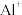 的半径较
的半径较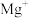 小、
小、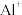 的核电荷更高以及
的核电荷更高以及_______ 。
(5)另一种铀氮化物的晶胞如下图所示, “原子”作面心立方最密堆积。
“原子”作面心立方最密堆积。
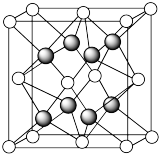
①铀元素的化合价为________ , “原子”的配位数为
“原子”的配位数为________ 。
②已知晶胞参数为 ,则晶体的密度为
,则晶体的密度为________  (列出计算式)。
(列出计算式)。
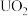 与铀氮化物是重要的核燃料,已知某温度下三碳酸铀酰铵可发生如下分解反应:
与铀氮化物是重要的核燃料,已知某温度下三碳酸铀酰铵可发生如下分解反应: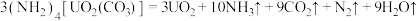 。阿伏加 德罗常数的值为
。阿伏加 德罗常数的值为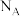 。
。回答下列问题:
(1)
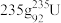 发生裂变反应:
发生裂变反应: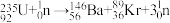 ,净产生的中子(
,净产生的中子(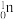 )数为
)数为 原子的外围电子排布式为
原子的外围电子排布式为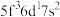 ,则处于下列状态的铀原子或离子失去一个电子所需的能量最高的为
,则处于下列状态的铀原子或离子失去一个电子所需的能量最高的为A
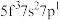 B
B 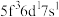 C
C  D
D 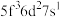
(2)
 和
和 中,沸点较高的为
中,沸点较高的为 形成的配离子稳定性较高的为
形成的配离子稳定性较高的为(3)
 中存在大
中存在大 键,形成该大
键,形成该大 键的电子数为
键的电子数为(4)某种铀氮化物的晶体结构与
 相同。
相同。 的Bom-Haber循环如图所示。
的Bom-Haber循环如图所示。
①
 晶格能为
晶格能为 。
。②
 的第二电离能大于
的第二电离能大于 的第二电离能,是由于
的第二电离能,是由于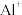 的半径较
的半径较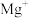 小、
小、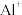 的核电荷更高以及
的核电荷更高以及(5)另一种铀氮化物的晶胞如下图所示,
 “原子”作面心立方最密堆积。
“原子”作面心立方最密堆积。
①铀元素的化合价为
 “原子”的配位数为
“原子”的配位数为②已知晶胞参数为
 ,则晶体的密度为
,则晶体的密度为 (列出计算式)。
(列出计算式)。
您最近一年使用:0次
解题方法
6 . N、Cu、H、O、S、Mg是常见的六种元素。
(1)Mg位于元素周期表第_______ 周期第_______ 族;N与O的基态原子核外未成对电子个数比为_______ ;Cu的基态原子电子排布式为_______ 。
(2)用“>”或“<”填空:
碱性:Mg(OH)2_______ Cu(OH)2
第一电离能:O_______ N
熔点:MgS_______ MgO
稳定性:H2S_______ H2O
(3)Mg在空气中燃烧可微量生产氮化镁(Mg3N2),Mg3N2(S)溶于足量的稀硫酸可得到两种正盐,在25℃、101kPa下,已知该反应每消耗1molH2SO4放热akJ,则该反应的热化学方程式为_______ 。
(4)工业上采取加热条件下用氨气还原氧化铜制取铜,同时得到两种无污染的气体(或蒸汽),写出该反应的化学方程式,并标出电子转移的方向和数目_______ 。
(1)Mg位于元素周期表第
(2)用“>”或“<”填空:
碱性:Mg(OH)2
第一电离能:O
熔点:MgS
稳定性:H2S
(3)Mg在空气中燃烧可微量生产氮化镁(Mg3N2),Mg3N2(S)溶于足量的稀硫酸可得到两种正盐,在25℃、101kPa下,已知该反应每消耗1molH2SO4放热akJ,则该反应的热化学方程式为
(4)工业上采取加热条件下用氨气还原氧化铜制取铜,同时得到两种无污染的气体(或蒸汽),写出该反应的化学方程式,并标出电子转移的方向和数目
您最近一年使用:0次
2016-12-09更新
|
455次组卷
|
2卷引用:2015届安徽省安庆市高三第二次模拟考试理综化学试卷
10-11高三上·全国·单元测试
7 . 硼酸晶体成片状,有滑腻感,可作润滑剂,硼酸分子结构可表示为 。硼酸对人体的受伤组织有缓和的防腐作用,故可用于医药和食品防腐等方面
。硼酸对人体的受伤组织有缓和的防腐作用,故可用于医药和食品防腐等方面
(1)根据以上所述可知硼酸应属于___________ 。
A.强酸 B.中强酸 C.弱酸
(2)研究表明:在大多数情况下,元素的原子在形成分子或离子时,其最外电子层具有达到8电子稳定结构的趋势。在硼酸分子中,最外层达到8个电子稳定结构的原子有___________ 个。
(3)硼酸和甲醇在浓硫酸存在的条件下,可生成挥发性硼酸三甲酯,试写出硼酸完全酯化的化学方程式(注明反应条件)___________ 。
(4)已知硼酸0.01mol可被20mL 0.5mol·L-1 NaOH溶液恰好完全中和,据此推测:硼酸在水中显酸性的原因是(写电离方程式)___________ 。
 。硼酸对人体的受伤组织有缓和的防腐作用,故可用于医药和食品防腐等方面
。硼酸对人体的受伤组织有缓和的防腐作用,故可用于医药和食品防腐等方面(1)根据以上所述可知硼酸应属于
A.强酸 B.中强酸 C.弱酸
(2)研究表明:在大多数情况下,元素的原子在形成分子或离子时,其最外电子层具有达到8电子稳定结构的趋势。在硼酸分子中,最外层达到8个电子稳定结构的原子有
(3)硼酸和甲醇在浓硫酸存在的条件下,可生成挥发性硼酸三甲酯,试写出硼酸完全酯化的化学方程式(注明反应条件)
(4)已知硼酸0.01mol可被20mL 0.5mol·L-1 NaOH溶液恰好完全中和,据此推测:硼酸在水中显酸性的原因是(写电离方程式)
您最近一年使用:0次



