名校
解题方法
1 .  、
、 均为短周期元素,且
均为短周期元素,且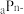 比
比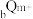 的电子层数多,下列说法正确的是( )
的电子层数多,下列说法正确的是( )
 、
、 均为短周期元素,且
均为短周期元素,且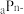 比
比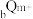 的电子层数多,下列说法正确的是( )
的电子层数多,下列说法正确的是( )A. 可能是第一周期元素 可能是第一周期元素 | B. 和 和 —定位于相邻的两个周期 —定位于相邻的两个周期 |
C. 一定比 一定比 小 小 | D.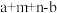 的值一定为8 的值一定为8 |
您最近一年使用:0次
2020-09-06更新
|
977次组卷
|
3卷引用:人教版(2019)高一必修第一册第四章 物质结构 元素周期律 第一节 原子结构与元素周期表 易错疑难集训(一)
人教版(2019)高一必修第一册第四章 物质结构 元素周期律 第一节 原子结构与元素周期表 易错疑难集训(一)(已下线)练习12 原子结构与元素的性质-2020-2021学年【补习教材·寒假作业】高二化学(人教版2019)江西省井冈山大学附属中学2021-2022学年高二上学期开学考试化学(理科)试题
13-14高一·全国·课时练习
名校
解题方法
2 . 下表为元素周期表的一部分,请参照元素①~⑧在表中的位置,用化学用语回答下列问题:
(1)④、⑤、⑥的原子半径由大到小的顺序是________ 。
(2)②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是________ 。
(3)①、④、⑤、⑧中的某些元素可形成既含离子键又含极性共价键的化合物,写出其中一种化合物的电子式:________ 。
(4)由表中两种元素的原子按1∶1组成的常见液态化合物的稀溶液易被催化分解,可使用的催化剂为(填序号)________ 。
A.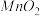 B.
B.
C. D.
D.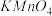
| 周期 | ⅠA | 0 | ||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ |
(2)②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是
(3)①、④、⑤、⑧中的某些元素可形成既含离子键又含极性共价键的化合物,写出其中一种化合物的电子式:
(4)由表中两种元素的原子按1∶1组成的常见液态化合物的稀溶液易被催化分解,可使用的催化剂为(填序号)
A.
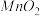 B.
B.
C.
 D.
D.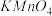
您最近一年使用:0次
2019-08-20更新
|
165次组卷
|
7卷引用:2014年高一化学人教版必修2 模块水平检测1练习卷
(已下线)2014年高一化学人教版必修2 模块水平检测1练习卷(已下线)2013-2014山东省淄博市高一下学期期末考试化学试卷2015-2016学年河北省秦皇岛市卢龙县高一下学期期中考试化学试卷2015-2016学年山西省长治一中高一平行班下期中化学试卷云南省峨山彝族自治县第一中学2017-2018学年高二上学期期末市统测模拟考化学试题百所名校联考-必修二模块综合检测山东省泰安市新泰市第二中学2019-2020学年高一下学期期中考试化学试题
3 . 下列说法正确的是
| A.氢原子的电子云图中小黑点的疏密表示电子在核外单位体积内出现机会的多少 |
| B.最外层电子数为ns2的元素都在元素周期表第2列 |
C.处于最低能量的原子叫做基态原子,1s22s22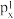 →1s22s22 →1s22s22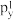 过程中形成的是发射光谱 过程中形成的是发射光谱 |
| D.已知某元素+3价离子的电子排布式为1s22s22p63s23p63d5,该元素位于周期表中的第四周期第VIII族位置,属于ds区 |
您最近一年使用:0次
2019-07-15更新
|
2342次组卷
|
7卷引用:宁夏银川一中2018-2019学年高二下学期期末考试化学试题
4 . 科学家根据元素周期律和原子结构理论预测,原子序数为114的元素位于第七周期ⅣA族,称为类铅元素。下面关于它的原子结构和性质预测正确的是
| A.类铅元素原子的最外层电子数为6 |
| B.它的最高价氧化物水化物的碱性比铅的最高价氧化物水化物的碱性弱 |
| C.它的金属性比铅强 |
| D.它的原子半径比铅小 |
您最近一年使用:0次
2019-06-06更新
|
1014次组卷
|
4卷引用:湖南省张家界市慈利县2018-2019学年高一第二学期期中检测化学试题
真题
名校
5 . 2019年是门捷列夫提出元素周期表150周年。根据元素周期律和元素周期表,下列推断不合理 的是
| A.第35号元素的单质在常温常压下是液体 |
| B.位于第四周期第ⅤA族的元素为非金属元素 |
| C.第84号元素的最高化合价是+7 |
| D.第七周期0族元素的原子序数为118 |
您最近一年使用:0次
2019-04-12更新
|
8270次组卷
|
38卷引用:2019年4月浙江省普通高校招生选考科目考试化学试题
2019年4月浙江省普通高校招生选考科目考试化学试题安徽省阜阳市第三中学2018-2019学年高一下学期第二次调研考试化学试题(已下线)专题06 物质结构 元素周期律——2019年高考真题和模拟题化学分项汇编浙江省瑞安市上海新纪元高级中学2019-2020学年高一(7-10)班下学期期初考试化学试题河北省正定中学2019-2020学年高一3月月考化学试题河北省承德市第一中学2019-2020学年高一下学期3月疫情期间直播课堂检测化学试题甘肃省天水市第一中学2020届高三上学期第五次(期末)考试化学试题(已下线)【南昌新东方】2019 新建一中 高三期中 015(已下线)专题5.2 元素周期律和元素周期表(讲)——2020年高考化学一轮复习讲练测(已下线)专题5.2 元素周期律和元素周期表(练)——2020年高考化学一轮复习讲练测苏教版(2020)高一必修第一册专题5 总结检测人教版(2019)高一必修第一册第四章 物质结构 元素周期律 高考挑战区人教版(2019)高一必修第一册 第四章素养检测鲁科版(2019)高一必修第二册 第1章 原子结构 元素周期律第2节 元素周期律和元素周期表 方法帮 高考帮(已下线)第18讲 元素周期律和元素周期表(精讲)——2021年高考化学一轮复习讲练测高一必修第一册(苏教2019)专题5 第一单元 元素周期律和元素周期表3河北省石家庄市第二十三中学2020-2021学年高一上学期12月阶段考试化学试题(已下线)练习9 元素周期表-2020-2021学年【补习教材·寒假作业】高一化学(人教版)(已下线)第一章 原子结构与性质【过关测试提高卷】-2020-2021学年高二化学单元复习(新教材人教版选择性必修2)(已下线)解密05 物质结构元素周期律(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)(已下线)解密05 物质结构元素周期律(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(已下线)考点07 元素周期律和元素周期表-备战2022年高考化学一轮复习考点帮(浙江专用)(已下线)第14讲 元素周期律和元素周期表(讲)— 2022年高考化学一轮复习讲练测(新教材新高考)吉林省延边第二中学2020-2021学年高二下学期第一次考试月考化学试题(已下线)专题07.物质结构 元素周期律-十年(2012-2021)高考化学真题分项汇编(浙江专用)河北省石家庄市第二十三中学2020-2021学年高一上学期第三次月考化学试题(已下线)第五单元 物质结构与元素周期律(B卷 真题滚动练)-2022年高考化学一轮复习单元滚动双测卷(新高考地区专用)(已下线)解密05 物质结构 元素周期律(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)(已下线)解密05 物质结构 元素周期律(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(浙江专用)(已下线)专题04 物质结构与元素周期律—2022年高考化学二轮复习讲练测(全国版)-练习(已下线)第14讲 元素周期律和元素周期表(讲)-2023年高考化学一轮复习讲练测(新教材新高考)(已下线)第14讲 元素周期律和元素周期表(练)-2023年高考化学一轮复习讲练测(新教材新高考)湖北省华中师范大学第一附属中学2022-2023学年高二上学期期中考试化学试题第一章 原子结构与性质(B卷·能力提升练)-2022-2023学年高二化学分层训练AB卷(人教版2019选择性必修2)(已下线)专题07 元素周期表与元素周期律云南省楚雄彝族自治州民族中学2022-2023学年高二下学期5月月考化学试题(已下线)2019年高考浙江卷化学试题变式题(单选题11-15)宁夏石嘴山市第三中学2023-2024学年高二下学期3月月考化学试题
名校
6 . A、B属于短周期中不同主族的元素,A、B原子的最外层电子中,成对电子和未成对电子占据的轨道数相等,若 A 元素的原子序数为 a,则 B 元素的原子序数可能为( )
| A.a-4 | B.a-5 | C.a-6 | D.a+4 |
您最近一年使用:0次
2019-04-09更新
|
397次组卷
|
3卷引用:【全国百强校】山西省实验中学2018-2019学年高二下学期第一次月考化学试题
名校
7 . 下列说法正确的是
| A.元素周期表每一周期元素原子的最外层电子排布均是从ns1 过渡到ns2np6 |
| B.所有的非金属元素都分布在p区 |
| C.原子核外电子排布式为1s2的原子与原子核外电子排布式为1s22s2的原子的化学性质相似 |
| D.元素周期表中ⅢB到ⅡB的10个纵行的元素都是金属,所以统称过渡金属元素 |
您最近一年使用:0次
2017-11-01更新
|
1501次组卷
|
5卷引用:福建省福州市八县(市)协作校2016-2017学年高二下学期期中考试化学试题
福建省福州市八县(市)协作校2016-2017学年高二下学期期中考试化学试题福建省晋江市季延中学2017-2018学年高二上学期期中考试(理)化学试题黑龙江省哈尔滨市第六中学2017-2018学年高二上学期期末考试化学试题安徽省安庆市太湖县太湖中学2019-2020学年高二下学期3月线上考试化学试题(已下线)第一章 原子结构与性质【过关测试提高卷】-2020-2021学年高二化学单元复习(新教材人教版选择性必修2)
8 . 短周期元素W、X、Y和Z在周期表中的相对位置如表所示,这四种元素原子的最外层电子数之和为21。下列关系正确的是
| W | X | |||
| Y | Z |
| A.氢化物沸点:W < Z | B.氧化物对应水化物的酸性:Y > W |
| C.化合物熔点:Y2X3 < YZ3 | D.简单离子的半径:Y < X |
您最近一年使用:0次
2017-08-08更新
|
10749次组卷
|
52卷引用:2017年全国普通高等学校招生统一考试理综化学(新课标Ⅲ卷精编版)
2017年全国普通高等学校招生统一考试理综化学(新课标Ⅲ卷精编版)四川省双流中学2017-2018学年高二上学期开学考试化学试题四川省新津中学2018届高三上学期入学考试化学试题黑龙江省哈尔滨市第十八中学2018届高三第一次月考化学试题广西柳州市城中区第二中学2016-2017学年高一下学期期末考试化学试题河南省林州市第一中学2018届高三10月调研化学试题2017-2018学年人教版高中化学必修2单元测试题 第1章 物质结构 元素周期律(已下线)狂刷05 元素周期表和元素周期律的应用—《小题狂刷》2017-2018学年高一化学人教必修2陕西省西安市铁一中2017-2018学年高一下学期期中考试化学试题(已下线)《考前20天终极攻略》-5月19日 物质结构 元素周期律(已下线)解密07 物质结构和元素周期律(教师版)——备战2018年高考化学之高频考点解密【全国百强校】四川省雅安中学2018-2019学年高一上学期开学考试化学试题【全国百强校】四川省雅安市雅安中学2018-2019学年高二上学期期中考试化学试题(已下线)2019高考备考二轮复习精品资料-专题7 物质结构与元素周期律(教学案)【全国百强校】江西省南昌市第十中学2019届高三上学期期末考试理科综合化学试题(已下线)考点07 元素周期律和元素周期表——备战2019年浙江新高考化学考点吉林省长春市德惠市实验中学2018-2019学年高一下学期期初检测化学试题【全国百强校】江西省南昌市第二中学2018-2019学年高一下学期第二次月考化学试题步步为赢 高一化学暑假作业:作业十九 综合评估百所名校联考-物质结构 元素周期律四川省广安第二中学校2017-2018学年高二下学期第一次月考化学试题(已下线)专题八 物质结构与元素周期律(真题汇编)-2020年高考二轮模块化复习之《化学基本原理》名师讲案与提分特训黑龙江省鸡西市鸡东县第二中学2019-2020学年高一下学期线上考试化学试题湖南长沙长郡中学2020届高三2月份网络教学质量监测卷理综化学试题四川省武胜烈面中学校2019-2020学年高二下学期期中考试化学试题黑龙江省大庆市第四中学2019-2020学年高二下学期第一次月考化学试题安徽省安庆市第一中学2019-2020学年高一下学期月考化学试题(已下线)5.1.1 元素周期律练习(1)——《高中新教材同步备课》(苏教版 必修第一册)黑龙江省哈尔滨师范大学附属中学2020-2021学年高二上学期开学考试化学试题苏教版(2020)高一必修第一册专题5 总结检测人教版(2019)高一必修第一册 第四章素养检测安徽省霍邱县第二中学2019-2020学年高一下学期段考化学试题(已下线)福建省泉州市泉港区第一中学2018-2019学年高二年级下学期期中考化学试题安徽省阜阳市第十一中学2019-2020学年高一下学期期中考试化学试题(已下线)第4章 章末检测-2020-2021学年高一化学同步课堂帮帮帮(人教版2019必修第一册)专题5 第一单元综合拔高练-高中化学苏教2019版必修第一册云南省保山第九中学2021届高三上学期开学考试化学试题(已下线)小题13 元素周期表、律(根据元素周期表片段推断) ——备战2021年高考化学经典小题考前必刷(全国通用)(已下线)【浙江新东方】双师208高一下(已下线)考点07 元素周期律和元素周期表-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点07 元素周期律和元素周期表-备战2022年高考化学一轮复习考点帮(浙江专用)四川省汉源县第二中学2019-2020学年高二下学期第二次月考化学试题宁夏银川市第六中学2021-2022学年高三上学期第一次月考(9月)化学试题河南省南阳市第一中学校2021-2022学年高一下学期第三次月考化学试题云南省丽江市第一高级中学2021-2022学年高二下学期4月月考化学试题(已下线)考点07 元素周期律和元素周期表-备战2023年高考化学一轮复习考点帮(全国通用)第四章 物质结构 元素周期律 本章复习提升(已下线)4.2元素周期律-同步学习必备知识四川省广元市八二一中学2021-2022学年高一下学期期中考试化学试题新疆维吾尔自治区喀什市喀什第二中学2022-2023学年高三上学期网上11月月考化学试题(已下线)题型76 通过元素周期表考查元素周期律四川省仁寿第一中学校南校区2022—2023学年高二下学期3月月考化学试题
9 . 下列说法不正确 的是
| A.某外围电子排布为4f75d16s2基态原子,该元素位于周期表中第六周期第ⅢB族 |
| B.在元素周期表中,s区,d区和ds区的元素都是金属元素 |
C.当碳原子的核外电子排布由 转变为 转变为 时,释放能量,由激发态转化成基态 时,释放能量,由激发态转化成基态 |
| D.非金属元素形成的共价化合物中,原子的最外层电子数不一定是2或8 |
您最近一年使用:0次
2017-05-05更新
|
2903次组卷
|
10卷引用:福建省三明市第一中学2016-2017学年高二下学期半期考试化学试题
福建省三明市第一中学2016-2017学年高二下学期半期考试化学试题新疆维吾尔自治区伊犁哈萨克自治州奎屯市第一高级中学2019-2020学年高二期末考试试题山东省德州一中2021届高三10月月考化学试题湖北省石首市第一中学2019-2020学年高二下学期摸底考试化学试题(已下线)第一章 原子结构与性质【过关测试提高卷】-2020-2021学年高二化学单元复习(新教材人教版选择性必修2)(已下线)第30讲 原子结构与性质(练) — 2022年高考化学一轮复习讲练测(新教材新高考)(已下线)押新高考卷08题 物质结构与性质-备战2022年高考化学临考题号押题(新高考通版)广东省东莞市东华高级中学2021-2022学年高二下学期月考化学试题(已下线)专题33 物质结构与性质基础-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)第一章 原子结构与性质(B卷·能力提升练)-2022-2023学年高二化学分层训练AB卷(人教版2019选择性必修2)
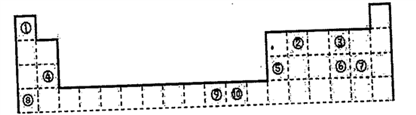
10 . 下表为长式周期表的一部分,其中的编号代表对应的元素。
(1)写出元素⑤的原子轨道表示式______________ 。
(2)写出元素⑨的基态原子的价电子排布式_________ 。
(3)表中属于ds区的元素是_________ (填编号)
(4)元素⑩形成的单质是由____ 键形成的晶体,该晶体采取的堆积方式是_______ ,晶体中⑩元素原子的配位数是_________ 。
(5)元素④、⑤、⑥、⑦的离子半径由小到大的顺序是_______ (用离子符号表示)
(6)写出元素①和元素⑧形成化合物的电子式_________________ 。
(7)元素⑨与⑩的第二电离能分别为:I⑨=1753kJ/mol,I⑩=1959kJ/mol,第二电离能I⑨⑩的原因是____________________________ 。
(8)科学家发现,②、④、⑨三种元素的原子形成的晶体具有超导性,其晶胞的结构特点如下图所示(图中②、④、⑨分别位于晶胞的体心、顶点、面心),则该化合物的化学式为______ (用对应的元素符号表示)。
(1)写出元素⑤的原子轨道表示式
(2)写出元素⑨的基态原子的价电子排布式
(3)表中属于ds区的元素是
(4)元素⑩形成的单质是由
(5)元素④、⑤、⑥、⑦的离子半径由小到大的顺序是
(6)写出元素①和元素⑧形成化合物的电子式
(7)元素⑨与⑩的第二电离能分别为:I⑨=1753kJ/mol,I⑩=1959kJ/mol,第二电离能I⑨⑩的原因是
(8)科学家发现,②、④、⑨三种元素的原子形成的晶体具有超导性,其晶胞的结构特点如下图所示(图中②、④、⑨分别位于晶胞的体心、顶点、面心),则该化合物的化学式为
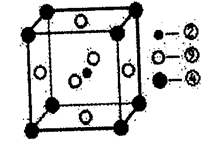
您最近一年使用:0次
2017-04-26更新
|
363次组卷
|
2卷引用:河南省郑州市八校2016-2017学年高二下学期期中联考化学试题



