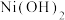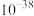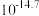解题方法
1 . 某工厂采用如下工艺处理镍钴矿硫酸浸取液(含 、
、 、
、 、
、 、
、 、
、 )实现镍、钴、镁元素的回收。
)实现镍、钴、镁元素的回收。 )的电离第一步完全,第二步微弱。
)的电离第一步完全,第二步微弱。
2.25℃时,相关物质的 如下:
如下:
回答下列问题:
(1)Ni属于元素周期表的________ 区。
(2)混合气在“氧化”中,产生 ,其中S的化合价为
,其中S的化合价为________ 。
(3)“滤渣”的成分之一是软锰矿的主要成分,由 氧化产生,该反应的离子方程式为
氧化产生,该反应的离子方程式为________ ;其可用于实验室制取氯气,该反应的离子方程式为________ 。
(4)若使 沉淀完全(浓度
沉淀完全(浓度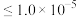 ),需调节pH不低于
),需调节pH不低于________ 。
(5)上述表格中a________ b(填“大于”、“小于”或“无法确定”)。
(6)“沉钴镍”后需将钴镍渣洗涤干净,实验室检验其是否洗净的方法是________ 。
(7)滤液2中含有的金属阳离子是________ 。
 、
、 、
、 、
、 、
、 、
、 )实现镍、钴、镁元素的回收。
)实现镍、钴、镁元素的回收。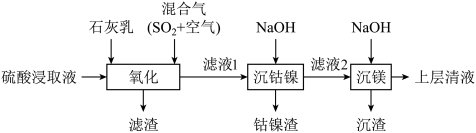
 )的电离第一步完全,第二步微弱。
)的电离第一步完全,第二步微弱。2.25℃时,相关物质的
 如下:
如下:物质 |
|
|
|
|
|
|
| a | b |
(1)Ni属于元素周期表的
(2)混合气在“氧化”中,产生
 ,其中S的化合价为
,其中S的化合价为(3)“滤渣”的成分之一是软锰矿的主要成分,由
 氧化产生,该反应的离子方程式为
氧化产生,该反应的离子方程式为(4)若使
 沉淀完全(浓度
沉淀完全(浓度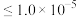 ),需调节pH不低于
),需调节pH不低于(5)上述表格中a
(6)“沉钴镍”后需将钴镍渣洗涤干净,实验室检验其是否洗净的方法是
(7)滤液2中含有的金属阳离子是
您最近一年使用:0次
名校
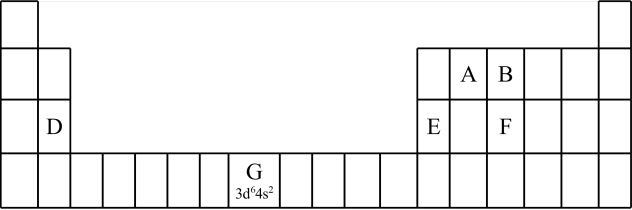
2 . 1869年,俄国化学家门捷列夫提出了元素周期律,并在此基础上发表了第一张元素周期表。为了纪念元素周期表诞生150年,联合国将2019年定为“国际化学元素周期表年”,并认为元素周期表是“科学共同的语言”。
(1)认识元素周期表的结构:___________ 区。
②2017年5月9日我国发布了113号 、115号
、115号 、117号
、117号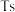 、118号
、118号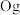 四种元素,则下列说法正确的是
四种元素,则下列说法正确的是___________ (填字母序号)。
a.113号元素在周期表中的位置是第七周期 族
族
b.117号元素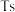 位于金属与非金属分界线上,属于准金属,可能是半导体
位于金属与非金属分界线上,属于准金属,可能是半导体
c.这四种元素都是主族元素
d.最高价氧化物的水化物的碱性:
(2)认识原子结构与元素周期表的关系:见表中元素 的信息,其中 “
的信息,其中 “ ”称为该元素原子的
”称为该元素原子的___________ ,该元素 能层上具有
能层上具有___________ 种不同运动状态的电子。
(3)认识元素周期律及其应用:
①第三周期元素的第一电离能:D_______ E(填“>” “<”或“=”)。
②气态氢化物的沸点:B_____ F (填“>”“<”或“=”),理由是___________ 。B的另一种氢化物可以作为火箭推进剂的燃料之一,其电子式为___________ 。
(1)认识元素周期表的结构:
②2017年5月9日我国发布了113号
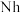 、115号
、115号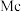 、117号
、117号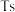 、118号
、118号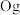 四种元素,则下列说法正确的是
四种元素,则下列说法正确的是a.113号元素在周期表中的位置是第七周期
 族
族b.117号元素
 位于金属与非金属分界线上,属于准金属,可能是半导体
位于金属与非金属分界线上,属于准金属,可能是半导体c.这四种元素都是主族元素
d.最高价氧化物的水化物的碱性:

(2)认识原子结构与元素周期表的关系:见表中元素
 的信息,其中 “
的信息,其中 “ ”称为该元素原子的
”称为该元素原子的 能层上具有
能层上具有(3)认识元素周期律及其应用:
①第三周期元素的第一电离能:D
②气态氢化物的沸点:B
您最近一年使用:0次
2024-04-26更新
|
46次组卷
|
2卷引用:安徽省淮南第二中学2023-2024学年高二下学期期中测试化学试题
解题方法
3 . 尿素还原法合成溴化锂,设备简单、产品质量好、无有毒气体排放、生产成本低。下图是制备无水溴化锂的工艺路线:
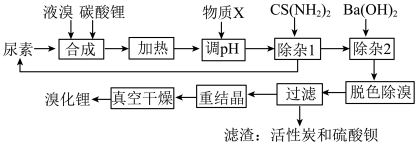
回答下列问题:
(1)Br位于周期表第________ 周期________ 族。
(2)常用焰色试验鉴别碳酸锂,火焰呈现________ 色。
(3)在溶解槽中,边搅拌边分次少量地将细粉末状的碳酸锂溶解于冷的溴水中至饱和为止,选用“冷”的溴水溶解碳酸锂的主要原因________ 。
(4)合成溴化锂的主要化学方程式________ 。
(5)合成时加入液溴会使pH降低,实际生产时需维持pH为4-5,为调节pH为4-5,从生产实际出发物质X最佳为________ 。
(6)加热体系的温度超过80℃会发生副反应:
3Br2+3H2O=5HBr+HBrO3
3HBrO=2HBr+HBrO3
Li2CO3+2HBrO3=2LiBrO3+H2O+CO2↑
还原溴酸锂需要选用硫脲,“除杂1”所发生的化学方程式是________ 。
(7)重结晶的操作为________ 。

温度(℃) | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 |
碳酸锂溶解度(g) | 1.51 | 1.43 | 1.33 | 1.26 | 1.17 | 1.08 | 1.01 | 0.85 | 0.72 |
(1)Br位于周期表第
(2)常用焰色试验鉴别碳酸锂,火焰呈现
(3)在溶解槽中,边搅拌边分次少量地将细粉末状的碳酸锂溶解于冷的溴水中至饱和为止,选用“冷”的溴水溶解碳酸锂的主要原因
(4)合成溴化锂的主要化学方程式
(5)合成时加入液溴会使pH降低,实际生产时需维持pH为4-5,为调节pH为4-5,从生产实际出发物质X最佳为
(6)加热体系的温度超过80℃会发生副反应:
3Br2+3H2O=5HBr+HBrO3
3HBrO=2HBr+HBrO3
Li2CO3+2HBrO3=2LiBrO3+H2O+CO2↑
还原溴酸锂需要选用硫脲,“除杂1”所发生的化学方程式是
(7)重结晶的操作为
您最近一年使用:0次
2024-04-02更新
|
331次组卷
|
2卷引用:2024届湖北省十一校高三下学期第二次联考化学试卷
名校
解题方法
4 . 氧族元素Se(硒)及其化合物有着广泛应用价值。
(1)Na2SeSO3(硒代硫酸钠,其中SeSO 可看作是SO
可看作是SO 中的一个O原子被Se原子取代的产物)在某些肿瘤治疗中能够提高治愈率。其制备和转化关系如下:
中的一个O原子被Se原子取代的产物)在某些肿瘤治疗中能够提高治愈率。其制备和转化关系如下:
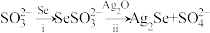
①按照核外电子排布,可把元素周期表划分为5个区。Se位于元素周期表___________ 区。
②SeSO 的空间结构是
的空间结构是___________ 。
③过程ii中SeSO 一定断裂的化学键是
一定断裂的化学键是___________ 。
(2)非铅双钙钛矿材料[(NH4)2SeBr6]有望大规模应用于太阳能电池。一定压力下合成的[(NH4)2SeBr6]晶体的晶胞结构如下图,其中[SeBr6]2-位于正方体的顶点和面心。

①比较Se原子和Br原子的第一电离能大小,并从原子结构的角度说明理由___________ 。
②NH 中H—N—H键角
中H—N—H键角___________ (填“>”或“<”)NH3中H—N—H键角。
③ 一定压力下形成的[(NH4)2SeBr6]晶胞形状为正方体,边长为a nm。已知[(NH4)2SeBr6]的摩尔质量是M g·mol-1,阿伏伽德罗常数为NA,该晶体密度为___________ g·cm-3。(1nm=10-7cm)
(3)Cu2-xSe是一种钠离子电池的正极材料,充、放电过程中正极材料立方晶胞(示意图)的组成变化如下图所示(晶胞内未标出因放电产生的0价Cu原子)。
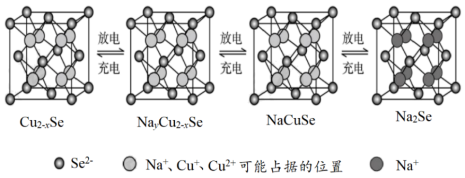
每个Na2Se晶胞完全转化为Cu2-xSe晶胞,转移电子数为___________ 。
(1)Na2SeSO3(硒代硫酸钠,其中SeSO
 可看作是SO
可看作是SO 中的一个O原子被Se原子取代的产物)在某些肿瘤治疗中能够提高治愈率。其制备和转化关系如下:
中的一个O原子被Se原子取代的产物)在某些肿瘤治疗中能够提高治愈率。其制备和转化关系如下: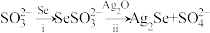
①按照核外电子排布,可把元素周期表划分为5个区。Se位于元素周期表
②SeSO
 的空间结构是
的空间结构是③过程ii中SeSO
 一定断裂的化学键是
一定断裂的化学键是(2)非铅双钙钛矿材料[(NH4)2SeBr6]有望大规模应用于太阳能电池。一定压力下合成的[(NH4)2SeBr6]晶体的晶胞结构如下图,其中[SeBr6]2-位于正方体的顶点和面心。

①比较Se原子和Br原子的第一电离能大小,并从原子结构的角度说明理由
②NH
 中H—N—H键角
中H—N—H键角③ 一定压力下形成的[(NH4)2SeBr6]晶胞形状为正方体,边长为a nm。已知[(NH4)2SeBr6]的摩尔质量是M g·mol-1,阿伏伽德罗常数为NA,该晶体密度为
(3)Cu2-xSe是一种钠离子电池的正极材料,充、放电过程中正极材料立方晶胞(示意图)的组成变化如下图所示(晶胞内未标出因放电产生的0价Cu原子)。

每个Na2Se晶胞完全转化为Cu2-xSe晶胞,转移电子数为
您最近一年使用:0次
2024-02-23更新
|
428次组卷
|
3卷引用:北京师范大学附属中学2023-2024学年高三下学期开学考化学试题
5 . 某科研小组采用如下方案回收一种光盘金属层中的少量Ag(金属层中其他金属含量过低,对实验的影响可忽略):
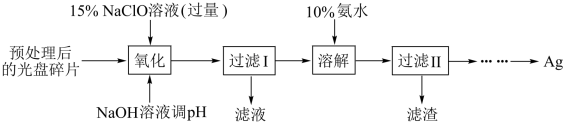
已知:①NaClO溶液与Ag反应的产物为AgCl、NaOH和
②NaClO溶液在受热或酸性条件下易分解: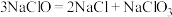
③铜和银是同族相邻元素
请回答下列问题:
(1)“氧化”阶段需在80℃条件下进行,适宜的加热方式为_____ ;
(2)银元素位于元素周期表的第_____ 周期第_____ 族,属于_____ 区;
(3)“溶解”阶段中发生的反应的离子方程式为_____ ;
(4)为提高Ag的回收率,需对“过滤Ⅱ”的滤渣进行洗涤,并将洗涤液合并入_____ ;
(5)若省略“过滤Ⅰ”,直接向冷却后的反应容器中滴加10%氨水,则需要增加氨水的用量,除因过量NaClO与 反应外(该条件下
反应外(该条件下 与
与 不反应),还因为
不反应),还因为_____ 。

已知:①NaClO溶液与Ag反应的产物为AgCl、NaOH和

②NaClO溶液在受热或酸性条件下易分解:
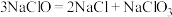
③铜和银是同族相邻元素
请回答下列问题:
(1)“氧化”阶段需在80℃条件下进行,适宜的加热方式为
(2)银元素位于元素周期表的第
(3)“溶解”阶段中发生的反应的离子方程式为
(4)为提高Ag的回收率,需对“过滤Ⅱ”的滤渣进行洗涤,并将洗涤液合并入
(5)若省略“过滤Ⅰ”,直接向冷却后的反应容器中滴加10%氨水,则需要增加氨水的用量,除因过量NaClO与
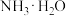 反应外(该条件下
反应外(该条件下 与
与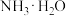 不反应),还因为
不反应),还因为
您最近一年使用:0次
解题方法
6 . 砷 在元素周期表中与氮同主族,砷及其化合物被运用在农药、医药和染料等领域中。某含砷工业废水经处理可转化为粗
在元素周期表中与氮同主族,砷及其化合物被运用在农药、医药和染料等领域中。某含砷工业废水经处理可转化为粗 ,流程如下:
,流程如下:
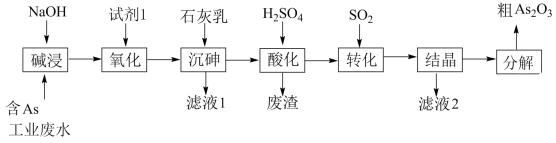
已知:
①含 工业废水主要以亚砷酸(
工业废水主要以亚砷酸( )形式存在,
)形式存在, 为三元弱酸,受热分解为
为三元弱酸,受热分解为 ;
;
② 微溶于水,
微溶于水, 难溶于水。
难溶于水。
回答下列问题:
(1)砷元素在元素周期表中的位置为_______ 。
(2)“碱浸”中发生反应的离子方程式为_______ 。
(3)从绿色化学角度考虑,“试剂1”可以选择_______ (填化学式)。
(4)“沉砷”在流程中的目的是_______ ;“沉砷”的最佳温度是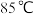 ,温度高于
,温度高于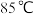 时,随温度升高转化率下降,可能的原因是
时,随温度升高转化率下降,可能的原因是_______ 。
(5)“废渣”的主要成分是_______ ,“转化”中发生反应的化学方程式为_______ 。
(6)从综合利用的角度考虑“滤液2”可返回_______ 步骤中循环再利用。
 在元素周期表中与氮同主族,砷及其化合物被运用在农药、医药和染料等领域中。某含砷工业废水经处理可转化为粗
在元素周期表中与氮同主族,砷及其化合物被运用在农药、医药和染料等领域中。某含砷工业废水经处理可转化为粗 ,流程如下:
,流程如下:
已知:
①含
 工业废水主要以亚砷酸(
工业废水主要以亚砷酸( )形式存在,
)形式存在, 为三元弱酸,受热分解为
为三元弱酸,受热分解为 ;
;②
 微溶于水,
微溶于水, 难溶于水。
难溶于水。回答下列问题:
(1)砷元素在元素周期表中的位置为
(2)“碱浸”中发生反应的离子方程式为
(3)从绿色化学角度考虑,“试剂1”可以选择
(4)“沉砷”在流程中的目的是
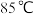 ,温度高于
,温度高于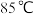 时,随温度升高转化率下降,可能的原因是
时,随温度升高转化率下降,可能的原因是(5)“废渣”的主要成分是
(6)从综合利用的角度考虑“滤液2”可返回
您最近一年使用:0次
7 . 已知第四周期过渡金属元素M,其六氨合M盐与氨化钾溶液在液氨中反应生成棕色非晶态的A[含三种元素,其中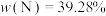 ],它能溶解在过量氨化钾溶液中,可能生成了一双核络合阴离子B[带三个负电荷,含三种元素,其中
],它能溶解在过量氨化钾溶液中,可能生成了一双核络合阴离子B[带三个负电荷,含三种元素,其中 ]。A在高压釜中与硝酸铵溶液一起加热至100℃则又再生成六氨合M盐(Ⅰ)。在室温下A缓慢释放出氨气并生成MN(Ⅱ)。
]。A在高压釜中与硝酸铵溶液一起加热至100℃则又再生成六氨合M盐(Ⅰ)。在室温下A缓慢释放出氨气并生成MN(Ⅱ)。
(1)请计算推断出M______ 、A______ 、B______ ;
(2)写出反应方程式(Ⅰ)______ 、(Ⅱ)______ 。(提示:可以从最简单的情况开始考虑)
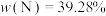 ],它能溶解在过量氨化钾溶液中,可能生成了一双核络合阴离子B[带三个负电荷,含三种元素,其中
],它能溶解在过量氨化钾溶液中,可能生成了一双核络合阴离子B[带三个负电荷,含三种元素,其中 ]。A在高压釜中与硝酸铵溶液一起加热至100℃则又再生成六氨合M盐(Ⅰ)。在室温下A缓慢释放出氨气并生成MN(Ⅱ)。
]。A在高压釜中与硝酸铵溶液一起加热至100℃则又再生成六氨合M盐(Ⅰ)。在室温下A缓慢释放出氨气并生成MN(Ⅱ)。(1)请计算推断出M
(2)写出反应方程式(Ⅰ)
您最近一年使用:0次
真题
解题方法
8 .  是生产多晶硅的副产物。利用
是生产多晶硅的副产物。利用 对废弃的锂电池正极材料
对废弃的锂电池正极材料 进行氯化处理以回收Li、Co等金属,工艺路线如下:
进行氯化处理以回收Li、Co等金属,工艺路线如下:
(1)Co位于元素周期表第_______ 周期,第_______ 族。
(2)烧渣是LiCl、 和
和 的混合物,“500℃焙烧”后剩余的
的混合物,“500℃焙烧”后剩余的 应先除去,否则水浸时会产生大量烟雾,用化学方程式表示其原因
应先除去,否则水浸时会产生大量烟雾,用化学方程式表示其原因_______ 。
(3)鉴别洗净的“滤饼3”和固体 常用方法的名称是
常用方法的名称是_______ 。
(4)已知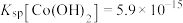 ,若“沉钴过滤”的pH控制为10.0,则溶液中
,若“沉钴过滤”的pH控制为10.0,则溶液中 浓度为
浓度为_______  。“850℃煅烧”时的化学方程式为
。“850℃煅烧”时的化学方程式为_______ 。
(5)导致 比
比 易水解的因素有
易水解的因素有_______ (填标号)。
a.Si-Cl键极性更大 b.Si的原子半径更大
c.Si-Cl键键能更大 d.Si有更多的价层轨道
 是生产多晶硅的副产物。利用
是生产多晶硅的副产物。利用 对废弃的锂电池正极材料
对废弃的锂电池正极材料 进行氯化处理以回收Li、Co等金属,工艺路线如下:
进行氯化处理以回收Li、Co等金属,工艺路线如下: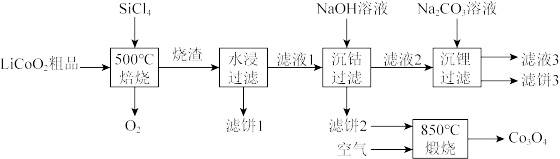
(1)Co位于元素周期表第
(2)烧渣是LiCl、
 和
和 的混合物,“500℃焙烧”后剩余的
的混合物,“500℃焙烧”后剩余的 应先除去,否则水浸时会产生大量烟雾,用化学方程式表示其原因
应先除去,否则水浸时会产生大量烟雾,用化学方程式表示其原因(3)鉴别洗净的“滤饼3”和固体
 常用方法的名称是
常用方法的名称是(4)已知
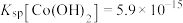 ,若“沉钴过滤”的pH控制为10.0,则溶液中
,若“沉钴过滤”的pH控制为10.0,则溶液中 浓度为
浓度为 。“850℃煅烧”时的化学方程式为
。“850℃煅烧”时的化学方程式为(5)导致
 比
比 易水解的因素有
易水解的因素有a.Si-Cl键极性更大 b.Si的原子半径更大
c.Si-Cl键键能更大 d.Si有更多的价层轨道
您最近一年使用:0次
2023-06-14更新
|
10505次组卷
|
13卷引用:2023年高考湖北卷化学真题
2023年高考湖北卷化学真题(已下线)专题18 工艺流程题(已下线)T16-工业流程题(已下线)专题18 工艺流程题(已下线)专题18 工艺流程题(已下线)第19练 化学工艺流程题 -2023年【暑假分层作业】高二化学(2024届一轮复习通用)(已下线)专题13 工艺流程综合题-2023年高考化学真题题源解密(新高考专用)(已下线)专题13 工艺流程综合题-2023年高考化学真题题源解密(全国通用)(已下线)考点47 无机工艺流程(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)第32讲难溶电解质的溶解平衡(已下线)题型06 化工微流程-2024年高考化学二轮热点题型归纳与变式演练(新高考通用)(已下线)专题06 沉淀溶解平衡-【寒假自学课】2024年高二化学寒假提升学与练(人教版2019)(已下线)题型四 无机化工流程题解题策略-备战2024年高考化学答题技巧与模板构建
9 . 下表标出的是元素周期表的一部分元素,回答下列问题:

(1)第三周期中原子半径最小的是___________ 。(用元素符号表示)
(2)表中用字母标出的15种元素中,化学性质最不活泼的是___________ (用元素符号表示),金属性最强的是___________ ,(用元素符号表示)非金属性最强的是___________ ,(用元素符号表示)属于过渡元素的是___________ (用字母表示)。
(3)d,e,f气态氢化物最稳定的为___________ , 最不稳定的为___________ 。(填化学式)
(4)钛被称为继铁、铝之后的第三金属,钛元素在元素周期表中的位置为___________ ,其价电子排布式为___________ 。
(5)请画出26号元素其价电子排布图:___________ 。
(6)d与a反应的产物的分子中心原子的杂化形式为___________ ,该分子是___________ (填“极性”或“非极性”)分子。
(7)写出铜元素在周期表中的位置___________ ,它位于___________ 区。并写出Cu+ 基态电子排布式___________ 。
(8)o、p两元素的部分电离能数据列于下表:
比较两元素的I2、I3可知,气态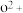 再失去一个电子比气态
再失去一个电子比气态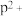 再失去一个电子难。对此,你的解释是
再失去一个电子难。对此,你的解释是___________
(9)元素X的某价态阴离子Xn-中所有电子正好充满K和L电子层,CnX的晶体结构如图所示。
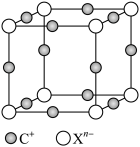
该晶体中阳离子和阴离子个数比为___________ ,晶体中每个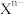 被
被___________ 个等距离的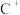 包围。
包围。

(1)第三周期中原子半径最小的是
(2)表中用字母标出的15种元素中,化学性质最不活泼的是
(3)d,e,f气态氢化物最稳定的为
(4)钛被称为继铁、铝之后的第三金属,钛元素在元素周期表中的位置为
(5)请画出26号元素其价电子排布图:
(6)d与a反应的产物的分子中心原子的杂化形式为
(7)写出铜元素在周期表中的位置
(8)o、p两元素的部分电离能数据列于下表:
| 元素 | o | p | |
| 电离能/kJ·mol-1 | I1 | 717 | 759 |
| I2 | 1 509 | 1 561 | |
| I3 | 3 248 | 2 957 |
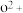 再失去一个电子比气态
再失去一个电子比气态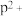 再失去一个电子难。对此,你的解释是
再失去一个电子难。对此,你的解释是(9)元素X的某价态阴离子Xn-中所有电子正好充满K和L电子层,CnX的晶体结构如图所示。

该晶体中阳离子和阴离子个数比为
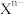 被
被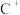 包围。
包围。
您最近一年使用:0次
10 . 据Nature Energy报道,最近科研人员研制出一种低浓度锂盐水系电解质溶液,充放电过程中锂离子具有较高的扩散速率,使得锂离子电池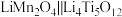 表现出优异的稳定性和放电容量。
表现出优异的稳定性和放电容量。
(1)对电极材料组成元素的分析。
①O原子核外电子有___________ 种运动状态。
②Mn元素位于元素周期表的___________ 区。
③基态Ti原子的核外电子排布式为___________ 。
(2)将 和
和 按
按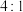 的物质的量比配料,经研磨后升温至600~750℃可制得电极材料
的物质的量比配料,经研磨后升温至600~750℃可制得电极材料 。
。
①该反应的化学方程式为___________ 。
② 中锰元素的平均价态为+3.5。不同温度下,合成的
中锰元素的平均价态为+3.5。不同温度下,合成的 中
中 、
、 和
和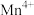 的含量与温度的关系见下表。
的含量与温度的关系见下表。
在上述温度范围内,锰元素平均价态的变化趋势为___________ 。
(3)以某种Ti的氧化物为原料,可制备正极材料尖晶石型钛酸锂(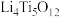 )。
)。
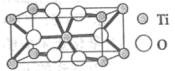
①Ti的氧化物晶胞结构如图所示,其化学式为___________ 。
②电池放电过程中,钛酸锂(难溶于水)由尖晶石型转变为岩盐型(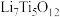 ),则正极的电极反应式为
),则正极的电极反应式为___________ 。
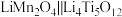 表现出优异的稳定性和放电容量。
表现出优异的稳定性和放电容量。(1)对电极材料组成元素的分析。
①O原子核外电子有
②Mn元素位于元素周期表的
③基态Ti原子的核外电子排布式为
(2)将
 和
和 按
按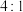 的物质的量比配料,经研磨后升温至600~750℃可制得电极材料
的物质的量比配料,经研磨后升温至600~750℃可制得电极材料 。
。①该反应的化学方程式为
②
 中锰元素的平均价态为+3.5。不同温度下,合成的
中锰元素的平均价态为+3.5。不同温度下,合成的 中
中 、
、 和
和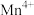 的含量与温度的关系见下表。
的含量与温度的关系见下表。| T/℃ | 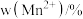 | 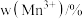 | 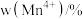 |
| 700 | 5.56 | 44.58 | 49.86 |
| 750 | 2.56 | 44.87 | 52.57 |
| 800 | 5.50 | 44.17 | 50.33 |
| 850 | 6.22 | 44.40 | 49.38 |
(3)以某种Ti的氧化物为原料,可制备正极材料尖晶石型钛酸锂(
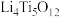 )。
)。①Ti的氧化物晶胞结构如图所示,其化学式为

②电池放电过程中,钛酸锂(难溶于水)由尖晶石型转变为岩盐型(
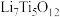 ),则正极的电极反应式为
),则正极的电极反应式为
您最近一年使用:0次
2022-06-29更新
|
228次组卷
|
2卷引用:江苏省常州市教育学会2021-2022学年高二下学期期末学业水平监测化学试题