1 . 废旧太阳能电池CIGS具有较高的回收利用价值,其主要组成为Culn0.5Ga0.5Se2。某探究小组回收处理流程如图:
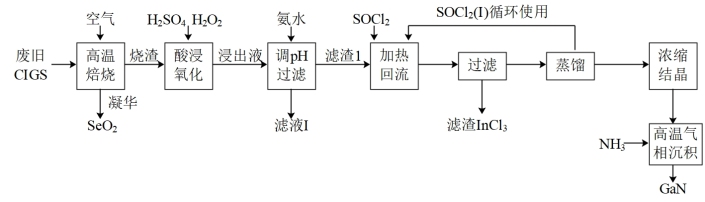
已知:①镓(Ga)和铟(In)位于元素周期表ⅢA族,镓与铝元素相邻。
②硒(Se)位于元素周期表ⅥA族。
回答下列问题:
(1)镓(Ga)原子结构示意图为____ 。
(2)“酸浸氧化”时发生的主要氧化还原反应的离子方程式为____ 。
(3)滤液Ⅰ中所含金属元素名称为_____ 。
(4)“滤渣Ⅰ”与SOCl2混合前需要洗涤、干燥,检验滤渣Ⅰ中SO 是否洗净的操作:
是否洗净的操作:____ ;SOCl2与一定量的水反应能产生两种气体,其中一种气体能使品红溶液褪色,写出SOCl2水解的化学方程式____ ;“加热回流”中SOCl2的作用:一种是将氢氧化物转化为氯化物,另一种是____ 。
(5)浓缩结晶后所得的GaCl3在“高温气相沉积”过程中发生的化学反应方程式为____ 。
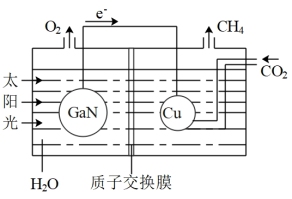
(6)如图表示氮化镓与铜组装成的人工光合系统的电池工作原理。电池工作时H+向_____ (填“左”或“右”)池移动;当电路中转移1.6mol电子时,电池中液体质量_____ (填“增重”还是“减轻”)_____ g。

已知:①镓(Ga)和铟(In)位于元素周期表ⅢA族,镓与铝元素相邻。
②硒(Se)位于元素周期表ⅥA族。
回答下列问题:
(1)镓(Ga)原子结构示意图为
(2)“酸浸氧化”时发生的主要氧化还原反应的离子方程式为
(3)滤液Ⅰ中所含金属元素名称为
(4)“滤渣Ⅰ”与SOCl2混合前需要洗涤、干燥,检验滤渣Ⅰ中SO
 是否洗净的操作:
是否洗净的操作:(5)浓缩结晶后所得的GaCl3在“高温气相沉积”过程中发生的化学反应方程式为
(6)如图表示氮化镓与铜组装成的人工光合系统的电池工作原理。电池工作时H+向

您最近一年使用:0次
2 . 废锂离子电池回收是对“城市矿产”的资源化利用,可促进新能源产业链闭环。废磷酸铁锂粉主要成分为LiFePO4,还含有的杂质为Al、Cu、Mg.回收LiCl的工艺流程如下:
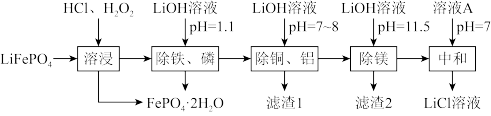
已知:①LiFePO4难溶于水;
②Ksp(FePO4)=1.0×10-22,Ksp(Li3PO4)=2.5×10-3,Ksp[Fe(OH)3]=4.0×10-38。
回答下列问题:
(1)LiFePO4中Fe的化合价为_______ ,Fe在周期表中的位置为_______ 。
(2)“溶浸”可得到含氯化锂的浸出液,材料中的铝、铜、镁等金属杂质也会溶入浸出液,生成CuCl2的离子反应方程式:_______ ;生成FePO4·2H2O的离子反应方程式:_______ 。
(3)该法实现了定向除杂,溶浸后不可直接将浸出液的pH调至11.5,其原因之一是:FePO4(s)+3Li+(aq)+3OH—(aq)=Fe(OH)3(s)+Li3PO4(s),该反应的平衡常数表达式为K=_______ ,若溶液中的c(Li+)=1mol/L,不考虑其他离子参与反应,为使Li+不转化为Li3PO4沉淀,则pH需小于_______ 。
(4)溶液A为_______ ,若最终获得LiCl溶液的体积为aL,其中Li+的密度为pg·L-1,废磷酸铁锂粉中Li元素的质量为mg,三次加入的LiOH溶液中溶质LiOH的总质量为m1g,其利用率为α,求废磷酸铁锂粉中Li元素的回收率x(Li)=_______ ×100%。(列出计算式即可,不用化简)

已知:①LiFePO4难溶于水;
②Ksp(FePO4)=1.0×10-22,Ksp(Li3PO4)=2.5×10-3,Ksp[Fe(OH)3]=4.0×10-38。
回答下列问题:
(1)LiFePO4中Fe的化合价为
(2)“溶浸”可得到含氯化锂的浸出液,材料中的铝、铜、镁等金属杂质也会溶入浸出液,生成CuCl2的离子反应方程式:
(3)该法实现了定向除杂,溶浸后不可直接将浸出液的pH调至11.5,其原因之一是:FePO4(s)+3Li+(aq)+3OH—(aq)=Fe(OH)3(s)+Li3PO4(s),该反应的平衡常数表达式为K=
(4)溶液A为
您最近一年使用:0次
解题方法
3 . 为纪念DmitriMendeleev(德米特里·门德列夫)发明的元素周期表诞生150周年。联合国大会宣布2019年是“国际化学元素周期表年”。以下是元素周期表的一部分,根据A~I在周期表中的位置,用元素符号或化学式回答下列问题:
(1)表中元素,化学性质最不活泼的是___________ 。
(2)最高价氧化物的水化物中酸性最强的是___________ 。
(3)元素B原子核外有___________ 种能量不同的电子,基态C原子最高能级电子云形状是___________ 。
(4)比较元素的金属性:B___________ C(填“>”或“<”),从原子结构的角度说明理由___________ 。
(5)A分别与E、G、H形成的化合物中,最稳定的是___________
(6)检验B元素的方法是___________ ,请用原子结构的知识解释产生此现象的原因:___________ 。
(7)元素B的单质在空气中点燃生成X,X中的化学键除离子键,还有___________ (填“极性”或“非极性”)共价键,若将其投入硫酸亚铁溶液中,预测主要的反应现象是___________ 。
族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 | |
| 1 | A | ||||||||
| 2 | D | E | G | ||||||
| 3 | B | C | J | H | I |
(2)最高价氧化物的水化物中酸性最强的是
(3)元素B原子核外有
(4)比较元素的金属性:B
(5)A分别与E、G、H形成的化合物中,最稳定的是
(6)检验B元素的方法是
(7)元素B的单质在空气中点燃生成X,X中的化学键除离子键,还有
您最近一年使用:0次
名校
解题方法
4 . 元素是构成我们生活的世界中一切物质的“原材料”。
Ⅰ、自18世纪以来,科学家们不断探索。从局部到系统,逐渐发现了元素之间的内在联系。下面列出了几位杰出科学家的研究工作。
上述科学家的研究按照时间先后排序合理的是__________ (填数字序号)。
Ⅱ、1869年,门捷列夫在前人研究的基础上制出了第一张元素周期表,如图所示。
(1)门捷列夫将已有元素按照相对原子质量排序,同一__________ (填“横行”或“纵列”)元素性质相似。结合表中信息,猜想第4列方框中“?=70”的问号表达的含义是__________ ,第5列方框中“Te=128?”的问号表达的含义是__________ 。
(2)20世纪初,门捷列夫周期表中为未知元素留下的空位逐渐被填满。而且,随着原子结构的逐渐揭秘,科学家们发现了元素性质不是随着相对原子质量而是随着原子序数(核电荷数)递增呈现周期性变化。其本质原因是__________ (填字母序号)。
A.随着核电荷数递增,原子核外电子排布呈现周期性变化
B.随着核电荷数递增,原子半径呈现周期性变化
C.随着核电荷数递增,元素最高正化合价呈现周期性变化
Ⅲ、X、Y、Z、W、R是现在元素周期表中的短周期元素,原子序数依次增大。X原子核外各层电子数之比为1:2,Y原子和Z原子的外电子数之和为20,W和R是同周期相邻元素,Y的氧化物和R的氧化物均能形成酸雨。
请回答下列问题:
(1)元素X的最高价氧化物的电子式为__________ ,元素Z的离子结构示意图为__________ 。
(2)单质铜和元素Y的最高价氧化物对应水化物的稀溶液发生反应的化学方程式为__________ 。
(3)元素W位于周期表的第__________ 族,其非金属性比元素R弱,用原子结构的知识解释原因____________________ 。
(4)R的一种氧化物能使品红溶液褪色,工业上用Y的气态氢化物的水溶液做其吸收剂,写出吸收剂与足量该氧化物反应的离子方程式____________________ 。
(5)Y和Z组成的化合物ZY,被大量用于制造电子元件。工业上用Z的氧化物、X单质和Y单质在高温下制备ZY,其中Z的氧化物和X单质的物质的量之比为1:3,则该反应的化学方程式为____________________ 。
Ⅰ、自18世纪以来,科学家们不断探索。从局部到系统,逐渐发现了元素之间的内在联系。下面列出了几位杰出科学家的研究工作。
| 序号 | ① | ② | ③ | ④ |
| 科学家 | 纽兰兹 | 道尔顿 | 德贝莱纳 | 尚古尔多 |
| 工作 | 发现“八音律”,指出从某一指定的元素起,第八个元素是第一个元素的某种重复 | 创立近代原子论,率先开始相对原子质量的测定工作 | 发现了5组性质相似的“三元素组”,中间元素的相对原子质量为前后两种元素相对原子质量的算术平均值 | 认为各元素组之间并非毫不相关,可以用相对原子质量把它们按从小到大的顺序串联 |
Ⅱ、1869年,门捷列夫在前人研究的基础上制出了第一张元素周期表,如图所示。
| Ni=Co=59 | |||||
| H=1 | Cu=63.4 | Ag=108 | Hg=200 | ||
| Be=9.4 | Mg=24 | Zn=65.2 | Cd=112 | ||
| B=11 | Al=27.4 | ?=68 | Ur=116 | Au=198? | |
| C=12 | Si=28 | ?=70 | Sn=118 | ||
| N=14 | P=31 | As=75 | Sb=122 | Bi=210? | |
| O=16 | S=32 | Se=79.4 | Te=128? | ||
| F=19 | Cl=35.5 | Br=80 | I=127 | ||
| Li=7 | Na=23 | K=39 | Rb=85.4 | Cs=133 | Tl=204 |
| Ca=40 | Pb=207 |
(2)20世纪初,门捷列夫周期表中为未知元素留下的空位逐渐被填满。而且,随着原子结构的逐渐揭秘,科学家们发现了元素性质不是随着相对原子质量而是随着原子序数(核电荷数)递增呈现周期性变化。其本质原因是
A.随着核电荷数递增,原子核外电子排布呈现周期性变化
B.随着核电荷数递增,原子半径呈现周期性变化
C.随着核电荷数递增,元素最高正化合价呈现周期性变化
Ⅲ、X、Y、Z、W、R是现在元素周期表中的短周期元素,原子序数依次增大。X原子核外各层电子数之比为1:2,Y原子和Z原子的外电子数之和为20,W和R是同周期相邻元素,Y的氧化物和R的氧化物均能形成酸雨。
请回答下列问题:
(1)元素X的最高价氧化物的电子式为
(2)单质铜和元素Y的最高价氧化物对应水化物的稀溶液发生反应的化学方程式为
(3)元素W位于周期表的第
(4)R的一种氧化物能使品红溶液褪色,工业上用Y的气态氢化物的水溶液做其吸收剂,写出吸收剂与足量该氧化物反应的离子方程式
(5)Y和Z组成的化合物ZY,被大量用于制造电子元件。工业上用Z的氧化物、X单质和Y单质在高温下制备ZY,其中Z的氧化物和X单质的物质的量之比为1:3,则该反应的化学方程式为
您最近一年使用:0次
名校
5 . 下表是元素周期表的一部分,回答下列有关问题:
(1)写出下列元素的元素符号:① ______ ,⑥______ ,⑦ _______ ,⑨______ 。
(2)画出下列微粒的结构示意图:④的原子:____________ ,⑧的离子:___________ 。
(3)表中的12种元素中,金属性最强的元素是________ ,非金属性最强的元素是_________ ,最不活泼的元素是_______ 。(均填元素符号)
(4)③④⑤⑦⑧五种元素中,离子半径最大的元素是______ (填元素符号)。元素③和⑦可以形成 _____________ (填“离子”或“共价”)化合物。
(5)表中某元素能形成两性氧化物,写出该氧化物溶于氢氧化钠溶液的离子方程式____________ 。
族 周期 | IA | IIA | IIA | IVA | VA | VIA | VIIA | 0 |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |
| 4 | ⑩ | ⑪ | ⑫ |
(2)画出下列微粒的结构示意图:④的原子:
(3)表中的12种元素中,金属性最强的元素是
(4)③④⑤⑦⑧五种元素中,离子半径最大的元素是
(5)表中某元素能形成两性氧化物,写出该氧化物溶于氢氧化钠溶液的离子方程式
您最近一年使用:0次
名校
6 . 下表中的实线表示元素周期表的部分边界,a-j分别表示周期表中对应位置的元素。回答下列问题:
(1)请在上表中用实线补全元素周期表边界_______ 。
(2)元素b在元素周期表中的位置是_______ ;元素a与d形成的4核18电子物质的分子式_______ 。
(3)元素e、g、h的简单离子半径由小到大的顺序为______ 。(用离子符号表示)
(4)元素e的气态氢化物比元素i的气态氢化物稳定性______ 。(填“强”或“弱”)。
(5)元素d与f形成的化合物中,原子个数1:1的化合物所含化学键类型为______ 。
(6)用电子式表示元素i、j形成化合物的过程______________________ 。
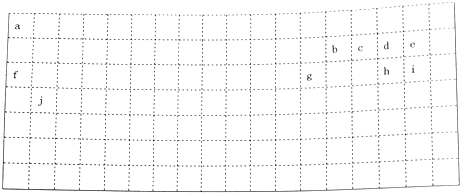
(1)请在上表中用实线补全元素周期表边界
(2)元素b在元素周期表中的位置是
(3)元素e、g、h的简单离子半径由小到大的顺序为
(4)元素e的气态氢化物比元素i的气态氢化物稳定性
(5)元素d与f形成的化合物中,原子个数1:1的化合物所含化学键类型为
(6)用电子式表示元素i、j形成化合物的过程
您最近一年使用:0次
解题方法
7 . 原子序数依次增大的四种元素A、B、C、D分别处于第一至第四周期。自然界存在多种A的化合物,B原子核外电子由6种不同的运动状态,B与C可形成正四面体形分子,D的M能层没有空轨道且只有2个未成对电子。请回答下列问题:
(1)A与B元素形成的B2A2种含有的σ键、π键数目之比为________ 。
(2)B元素的一种单质晶体结构如图1所示,理论上12g该晶体中有________ 个六元环;图2位在元素周期表中与B相邻的元素位置关系,B、G形成的晶胞结构如图3所示(其中“●”为B元素原子,“〇”为G元素原子),图中“●”点构成的堆积方式与图4中_____ (填序号)所表示的堆积方式相同;图3的结构中,设晶胞边长为a cm,B原子直径为bcm,G原子直径为c cm,则该晶胞的空间利用率为_______ (用含a、b、c的式子表示)。

(3)请说出E的氟化物(EF3)和F的氢化物(FH3)能发生反应的原因,并写出反应的化学方程式_____ (用化学式表示)。
(4)元素C的含氧酸中,酸性最强的是_________ (写化学式),该酸根离子的立体构型为________ 。
(5)基态D原子的核外电子排布式为[Ar]_______ ;D形成的配合物D(CO)n的中心原子价电子数与配体提供电子总数之和为18,则n=______ ;由D一铝合金为原料可制得一种历史悠久、应用广泛的催化剂,其催化的i实例为: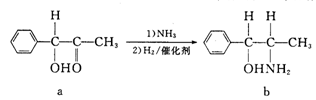 化合物b中进行sp3杂化的原子有
化合物b中进行sp3杂化的原子有__________ (填元素符号)。
(1)A与B元素形成的B2A2种含有的σ键、π键数目之比为
(2)B元素的一种单质晶体结构如图1所示,理论上12g该晶体中有

(3)请说出E的氟化物(EF3)和F的氢化物(FH3)能发生反应的原因,并写出反应的化学方程式
(4)元素C的含氧酸中,酸性最强的是
(5)基态D原子的核外电子排布式为[Ar]
 化合物b中进行sp3杂化的原子有
化合物b中进行sp3杂化的原子有
您最近一年使用:0次



