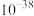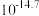解题方法
1 . 某工厂采用如下工艺处理镍钴矿硫酸浸取液(含 、
、 、
、 、
、 、
、 、
、 )实现镍、钴、镁元素的回收。
)实现镍、钴、镁元素的回收。 )的电离第一步完全,第二步微弱。
)的电离第一步完全,第二步微弱。
2.25℃时,相关物质的 如下:
如下:
回答下列问题:
(1)Ni属于元素周期表的________ 区。
(2)混合气在“氧化”中,产生 ,其中S的化合价为
,其中S的化合价为________ 。
(3)“滤渣”的成分之一是软锰矿的主要成分,由 氧化产生,该反应的离子方程式为
氧化产生,该反应的离子方程式为________ ;其可用于实验室制取氯气,该反应的离子方程式为________ 。
(4)若使 沉淀完全(浓度
沉淀完全(浓度 ),需调节pH不低于
),需调节pH不低于________ 。
(5)上述表格中a________ b(填“大于”、“小于”或“无法确定”)。
(6)“沉钴镍”后需将钴镍渣洗涤干净,实验室检验其是否洗净的方法是________ 。
(7)滤液2中含有的金属阳离子是________ 。
 、
、 、
、 、
、 、
、 、
、 )实现镍、钴、镁元素的回收。
)实现镍、钴、镁元素的回收。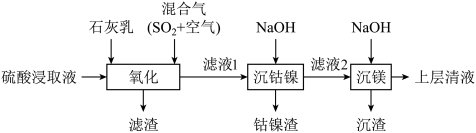
 )的电离第一步完全,第二步微弱。
)的电离第一步完全,第二步微弱。2.25℃时,相关物质的
 如下:
如下:物质 |
|
|
|
|
|
|
| a | b |
(1)Ni属于元素周期表的
(2)混合气在“氧化”中,产生
 ,其中S的化合价为
,其中S的化合价为(3)“滤渣”的成分之一是软锰矿的主要成分,由
 氧化产生,该反应的离子方程式为
氧化产生,该反应的离子方程式为(4)若使
 沉淀完全(浓度
沉淀完全(浓度 ),需调节pH不低于
),需调节pH不低于(5)上述表格中a
(6)“沉钴镍”后需将钴镍渣洗涤干净,实验室检验其是否洗净的方法是
(7)滤液2中含有的金属阳离子是
您最近一年使用:0次
解题方法
2 . 新型储氢合金材料的研究和开发将为氢气作为能源的实际应用起到重要的推动作用。两种常见储氢合金的晶胞结构如图所示。设阿伏加德罗常数为 ,下列说法正确的是
,下列说法正确的是
 ,下列说法正确的是
,下列说法正确的是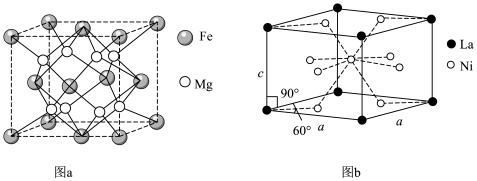
| A.图中涉及的四种元素均为d区元素 |
B.图b晶体的化学式为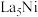 |
C.图a晶体晶胞边长为dpm,该合金的密度为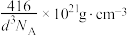 |
D.图a晶体储氢时,储存的氢相当于 分子在晶胞的体心和棱心位置,则含24g Mg的该储氢合金储存的 分子在晶胞的体心和棱心位置,则含24g Mg的该储氢合金储存的 在标准状况下的体积约为11.2L 在标准状况下的体积约为11.2L |
您最近一年使用:0次
2024-05-16更新
|
144次组卷
|
2卷引用:辽宁省凌源市2024届高三下学期第三次模拟考试化学试卷
名校
解题方法
3 . 实验室中可用 或
或 来检验
来检验 ,下列说法正确的是
,下列说法正确的是
 或
或 来检验
来检验 ,下列说法正确的是
,下列说法正确的是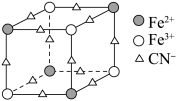
A.铁元素位于周期表第四周期第ⅧB族,属于 区 区 |
B. 与 与 溶液混合,得到的配合物 溶液混合,得到的配合物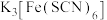 中,提供空轨道的是 中,提供空轨道的是 ,配位原子是 ,配位原子是 ,配位数是6 ,配位数是6 |
C. 中含有离子键、极性共价键和非极性共价键 中含有离子键、极性共价键和非极性共价键 |
D. 与 与 反应可得到一种蓝色沉淀,该沉淀物质晶胞的 反应可得到一种蓝色沉淀,该沉淀物质晶胞的 结构如图所示( 结构如图所示( 未画出),则一个晶胞中的 未画出),则一个晶胞中的 个数为4 个数为4 |
您最近一年使用:0次
名校
解题方法
4 . 反应 ,可用于去除氮氧化物。
,可用于去除氮氧化物。 催化该反应的过程如图所示。下列说法正确的是
催化该反应的过程如图所示。下列说法正确的是
 ,可用于去除氮氧化物。
,可用于去除氮氧化物。 催化该反应的过程如图所示。下列说法正确的是
催化该反应的过程如图所示。下列说法正确的是
A. 位于元素周期表 位于元素周期表 区 区 |
B.反应过程中, 参与反应,降低了反应的焓变 参与反应,降低了反应的焓变 |
C.该反应的平衡常数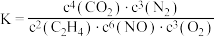 |
D.其他条件不变时,增大 , ,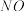 的平衡转化率下降 的平衡转化率下降 |
您最近一年使用:0次
名校
解题方法
5 . 近期科研人员研究发现,四苯基膦阳离子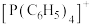 (结构如下)可与卤化镉(Cd)阴离子簇(卤素为Cl或Br)通过自组装形成多种杂化晶体材料,具有优异的发光特性。
(结构如下)可与卤化镉(Cd)阴离子簇(卤素为Cl或Br)通过自组装形成多种杂化晶体材料,具有优异的发光特性。_____ ,基态P原子电子占据的最高能级符号为_____ 。
(2)氯化四苯基膦可通过 和
和 反应得到。
反应得到。 是
是_____ (填“极性”或“非极性”)分子, 分子空间构型为
分子空间构型为_____ 。
(3)氯化四苯基膦( )在水中和有机溶剂中都有一定溶解性,其原因是
)在水中和有机溶剂中都有一定溶解性,其原因是_____ 。这一性质可使其用作不相溶的有机溶液和水溶液之间反应的催化剂。
(4)基态 原子的价电子排布式为
原子的价电子排布式为 ,
, 在元素周期表中的位置是
在元素周期表中的位置是_____ 。
(5)在上述晶体材料中,氯化镉阴离子以单体 或
或 形式存在,
形式存在,
_____ 。
(6)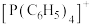 与
与 形成的杂化晶体材料中,存在的化学键有
形成的杂化晶体材料中,存在的化学键有_____ 。
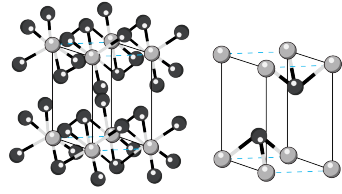
(7)碘化镉晶胞示意图如下图所示。碘原子和镉原子分层排布,“一层镉、一层碘、一层碘”地相间。_____ 。
②镉原子的配位数是_____ 。
③碘化镉晶体很容易解离成片状,原因是_____ 。
(8)氧化镉晶体如下所示。已知晶胞边长为anm,阿伏加德罗常数为 ,该晶体密度为
,该晶体密度为_____  。(列计算式表达)
。(列计算式表达)
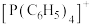 (结构如下)可与卤化镉(Cd)阴离子簇(卤素为Cl或Br)通过自组装形成多种杂化晶体材料,具有优异的发光特性。
(结构如下)可与卤化镉(Cd)阴离子簇(卤素为Cl或Br)通过自组装形成多种杂化晶体材料,具有优异的发光特性。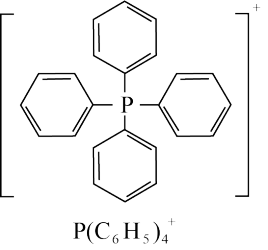
(2)氯化四苯基膦可通过
 和
和 反应得到。
反应得到。 是
是 分子空间构型为
分子空间构型为(3)氯化四苯基膦(
 )在水中和有机溶剂中都有一定溶解性,其原因是
)在水中和有机溶剂中都有一定溶解性,其原因是(4)基态
 原子的价电子排布式为
原子的价电子排布式为 ,
, 在元素周期表中的位置是
在元素周期表中的位置是(5)在上述晶体材料中,氯化镉阴离子以单体
 或
或 形式存在,
形式存在,
(6)
 与
与 形成的杂化晶体材料中,存在的化学键有
形成的杂化晶体材料中,存在的化学键有(7)碘化镉晶胞示意图如下图所示。碘原子和镉原子分层排布,“一层镉、一层碘、一层碘”地相间。
②镉原子的配位数是
③碘化镉晶体很容易解离成片状,原因是
(8)氧化镉晶体如下所示。已知晶胞边长为anm,阿伏加德罗常数为
 ,该晶体密度为
,该晶体密度为 。(列计算式表达)
。(列计算式表达)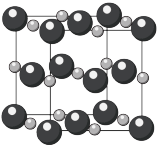
您最近一年使用:0次
解题方法
6 . 尿素还原法合成溴化锂,设备简单、产品质量好、无有毒气体排放、生产成本低。下图是制备无水溴化锂的工艺路线:
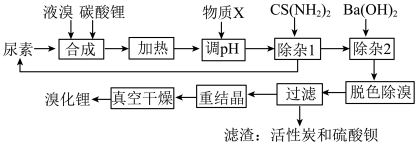
回答下列问题:
(1)Br位于周期表第________ 周期________ 族。
(2)常用焰色试验鉴别碳酸锂,火焰呈现________ 色。
(3)在溶解槽中,边搅拌边分次少量地将细粉末状的碳酸锂溶解于冷的溴水中至饱和为止,选用“冷”的溴水溶解碳酸锂的主要原因________ 。
(4)合成溴化锂的主要化学方程式________ 。
(5)合成时加入液溴会使pH降低,实际生产时需维持pH为4-5,为调节pH为4-5,从生产实际出发物质X最佳为________ 。
(6)加热体系的温度超过80℃会发生副反应:
3Br2+3H2O=5HBr+HBrO3
3HBrO=2HBr+HBrO3
Li2CO3+2HBrO3=2LiBrO3+H2O+CO2↑
还原溴酸锂需要选用硫脲,“除杂1”所发生的化学方程式是________ 。
(7)重结晶的操作为________ 。

温度(℃) | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 |
碳酸锂溶解度(g) | 1.51 | 1.43 | 1.33 | 1.26 | 1.17 | 1.08 | 1.01 | 0.85 | 0.72 |
(1)Br位于周期表第
(2)常用焰色试验鉴别碳酸锂,火焰呈现
(3)在溶解槽中,边搅拌边分次少量地将细粉末状的碳酸锂溶解于冷的溴水中至饱和为止,选用“冷”的溴水溶解碳酸锂的主要原因
(4)合成溴化锂的主要化学方程式
(5)合成时加入液溴会使pH降低,实际生产时需维持pH为4-5,为调节pH为4-5,从生产实际出发物质X最佳为
(6)加热体系的温度超过80℃会发生副反应:
3Br2+3H2O=5HBr+HBrO3
3HBrO=2HBr+HBrO3
Li2CO3+2HBrO3=2LiBrO3+H2O+CO2↑
还原溴酸锂需要选用硫脲,“除杂1”所发生的化学方程式是
(7)重结晶的操作为
您最近一年使用:0次
2024-04-02更新
|
330次组卷
|
2卷引用:2024届湖北省十一校高三下学期第二次联考化学试卷
7 . 固体化合物X由四种元素组成,某学习小组开展如下探究实验。下列说法错误的是
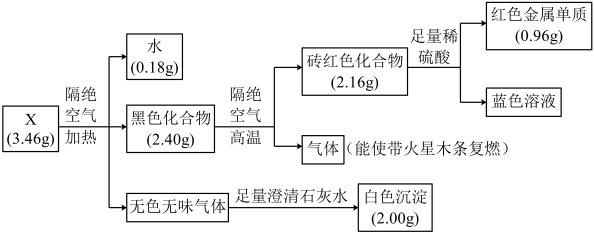
| A.固体化合物X中的金属元素位于周期表第四周期第ⅠB族 |
| B.固体化合物X为Cu2(OH)2CO3 |
| C.黑色化合物隔绝空气分解的过程中,生成1 mol砖红色化合物,转移2 mol电子 |
| D.蓝色溶液经蒸发浓缩、冷却结晶、过滤、洗涤、干燥,可制得胆矾晶体 |
您最近一年使用:0次
解题方法
8 . 如图为元素周期表的一部分,请参照元素①~⑧在表中的位置,回答下列问题:
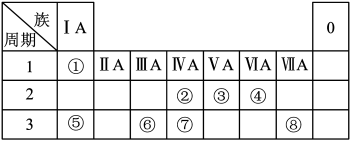
(1)地壳中含量居于第二位的元素在周期表中的位置是___________ 。
(2)②的最高价氧化物的分子式为___________ ;⑦的最高价氧化物对应水化物的分子式为___________ 。
(3)①、④、⑤中的某些元素可形成既含离子键又含共价键的离子化合物,写出两种化合物的电子式:___________ 、___________ 。
(4)W是第四周期与④同主族的元素。据此推测W不可能具有的性质是___________(填字母)。
(5)半径大小比较:③___________ ④;金属性强弱比较:⑤___________ ⑥(填“>”、“<”或“=”)。
(6)已知X为第IIA族元素(第一到第四周期),其原子序数为a,Y与X位于同一周期,且为第IIIA族元素,则Y的原子序数b与a所有可能的关系式为___________ 。

(1)地壳中含量居于第二位的元素在周期表中的位置是
(2)②的最高价氧化物的分子式为
(3)①、④、⑤中的某些元素可形成既含离子键又含共价键的离子化合物,写出两种化合物的电子式:
(4)W是第四周期与④同主族的元素。据此推测W不可能具有的性质是___________(填字母)。
| A.最高正化合价为+6 | B.气态氢化物比 稳定 稳定 |
| C.最高价氧化物对应水化物的酸性比硫酸弱 | D.单质在常温下可与氢气化合 |
(5)半径大小比较:③
(6)已知X为第IIA族元素(第一到第四周期),其原子序数为a,Y与X位于同一周期,且为第IIIA族元素,则Y的原子序数b与a所有可能的关系式为
您最近一年使用:0次
名校
解题方法
9 . 回答以下关于元素及其化合物的问题。
(1)Na原子核外有________ 种不同能量的电子,其离子最外层电子的轨道表示式________ 。
(2)相同压强下,部分元素氟化物的熔点见下表:
①试解释上表中氟化物熔点差异的原因:___________ 。
② 分子的空间构型为
分子的空间构型为___________ , 中Si—F键间的键角是
中Si—F键间的键角是___________ 。
(3)元素周期表有多种形式。下图分别是三种不同形式元素周期表的局部区域。

①图A中,数值越大,则该元素的___________ (填“金属性”或“非金属性”)越强。写出能说明O、F两元素该性质强弱的化学方程式___________ 。
②根据图B预测,整个周期表中位置最低的元素应位于___________ (放射性元素除外)。图B所示第二周期主族元素中,某元素该性质反常偏高,则该元素原子核外电子排布式为___________ 。
③图C表示的意义是___________ 。
(4)元素周期表中,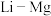 、
、 、
、 处于对角线关系,其单质与化合物的性质相似。下列说法正确的是___________(选填序号)。
处于对角线关系,其单质与化合物的性质相似。下列说法正确的是___________(选填序号)。
(1)Na原子核外有
(2)相同压强下,部分元素氟化物的熔点见下表:
| 氟化物 |  |  |  |
| 熔点/℃ | 1266 | 1534 | 183 |
②
 分子的空间构型为
分子的空间构型为 中Si—F键间的键角是
中Si—F键间的键角是(3)元素周期表有多种形式。下图分别是三种不同形式元素周期表的局部区域。

①图A中,数值越大,则该元素的
②根据图B预测,整个周期表中位置最低的元素应位于
③图C表示的意义是
(4)元素周期表中,
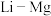 、
、 、
、 处于对角线关系,其单质与化合物的性质相似。下列说法正确的是___________(选填序号)。
处于对角线关系,其单质与化合物的性质相似。下列说法正确的是___________(选填序号)。A. 易溶于水 易溶于水 | B. |
C. 熔点高 熔点高 | D.晶体硼为分子晶体 |
您最近一年使用:0次
10 . Ⅰ.金属单质及其化合物的应用非常广泛。
(1)铁元素在元素周期表中位置为___________ 。
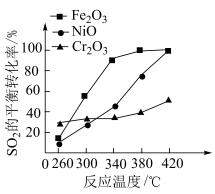
(2)反应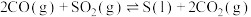
 ,其他条件相同,催化剂不同时,反应相同时间
,其他条件相同,催化剂不同时,反应相同时间 的转化率随反应温度的变化如图所示,260℃条件下选择
的转化率随反应温度的变化如图所示,260℃条件下选择___________ (填“ ”“
”“ ”或“
”或“ ”),作催化剂时反应速率最快。不考虑价格因素,与NiO相比,选择
”),作催化剂时反应速率最快。不考虑价格因素,与NiO相比,选择 作催化剂的优势是
作催化剂的优势是___________ 。
(3)上述反应的正反应速率方程为 ,逆反应速率方程为
,逆反应速率方程为 ,其中
,其中 、
、 分别为正、逆反应的速率常数,只受温度影响,
分别为正、逆反应的速率常数,只受温度影响,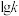 (速率常数的对数)与温度(T)的关系符合图中的两条线,其中表示
(速率常数的对数)与温度(T)的关系符合图中的两条线,其中表示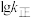 的是
的是___________ (填序号)。

(4)泡沫灭火器灭火时发生反应的离子方程式是___________ 。
(5)要使 溶液中
溶液中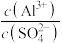 的比值增大,可加入的物质是___________。
的比值增大,可加入的物质是___________。
(1)铁元素在元素周期表中位置为
(2)反应
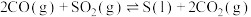
 ,其他条件相同,催化剂不同时,反应相同时间
,其他条件相同,催化剂不同时,反应相同时间 的转化率随反应温度的变化如图所示,260℃条件下选择
的转化率随反应温度的变化如图所示,260℃条件下选择 ”“
”“ ”或“
”或“ ”),作催化剂时反应速率最快。不考虑价格因素,与NiO相比,选择
”),作催化剂时反应速率最快。不考虑价格因素,与NiO相比,选择 作催化剂的优势是
作催化剂的优势是
(3)上述反应的正反应速率方程为
 ,逆反应速率方程为
,逆反应速率方程为 ,其中
,其中 、
、 分别为正、逆反应的速率常数,只受温度影响,
分别为正、逆反应的速率常数,只受温度影响,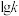 (速率常数的对数)与温度(T)的关系符合图中的两条线,其中表示
(速率常数的对数)与温度(T)的关系符合图中的两条线,其中表示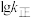 的是
的是
(4)泡沫灭火器灭火时发生反应的离子方程式是
(5)要使
 溶液中
溶液中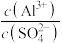 的比值增大,可加入的物质是___________。
的比值增大,可加入的物质是___________。| A.少量硫酸 | B.少量NaOH溶液 |
C.少量 固体 固体 | D.适量蒸馏水 |
您最近一年使用:0次