解题方法
1 . 锰(25Mn)及其化合物是目前前沿科学研究的热点。按要求回答下列问题。
(1)锰元素在元素周期表中的位置是___________ 。
(2)某晶体锰的面心立方晶胞如图所示。
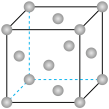
①该晶胞中含Mn原子的个数为___________ ;
②晶体锰中每个Mn原子距离最近的Mn原子数目为___________ 。
③设该晶胞参数棱长为 。则晶体锰的密度为
。则晶体锰的密度为___________  (列算式)
(列算式)
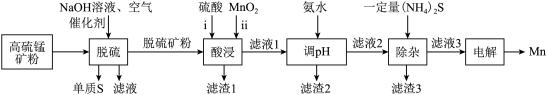
(3)锰的冶炼有多种方法,其中以某锰矿(主要成分为 ,主要杂质有
,主要杂质有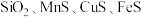 )为原料,设计如下流程可制得金属Mn。
)为原料,设计如下流程可制得金属Mn。
已知:金属硫化物的溶度积常数如下表。
①脱硫步骤:硫化物均转化为单质S,其反应中的氧化剂为___________ ; 能被部分反应而得到的产物为
能被部分反应而得到的产物为___________ 。
②酸浸步骤:ⅰ反应后的溶液中含 ,写出ⅱ反应的离子方程式:
,写出ⅱ反应的离子方程式:___________ ;滤渣1含有的物质有___________ 。若未经脱硫直接酸浸,不利的方面是___________ 。
③调 的目的为去除铁元素,则产生滤渣2的离子方程式:
的目的为去除铁元素,则产生滤渣2的离子方程式:___________ ;
④除杂步骤:滤渣3中主要有___________ 。
⑤电解步骤:惰性阳极产生 的反应式为
的反应式为___________ 。
(1)锰元素在元素周期表中的位置是
(2)某晶体锰的面心立方晶胞如图所示。

①该晶胞中含Mn原子的个数为
②晶体锰中每个Mn原子距离最近的Mn原子数目为
③设该晶胞参数棱长为
 。则晶体锰的密度为
。则晶体锰的密度为 (列算式)
(列算式)(3)锰的冶炼有多种方法,其中以某锰矿(主要成分为
 ,主要杂质有
,主要杂质有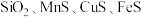 )为原料,设计如下流程可制得金属Mn。
)为原料,设计如下流程可制得金属Mn。
已知:金属硫化物的溶度积常数如下表。
| 物质 | CuS | MnS | FeS |
 |  | 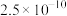 |  |
 能被部分反应而得到的产物为
能被部分反应而得到的产物为②酸浸步骤:ⅰ反应后的溶液中含
 ,写出ⅱ反应的离子方程式:
,写出ⅱ反应的离子方程式:③调
 的目的为去除铁元素,则产生滤渣2的离子方程式:
的目的为去除铁元素,则产生滤渣2的离子方程式:④除杂步骤:滤渣3中主要有
⑤电解步骤:惰性阳极产生
 的反应式为
的反应式为
您最近一年使用:0次
名校
2 . 如表是元素周期表的一部分,表中所列的字母分别代表一种化学元素。
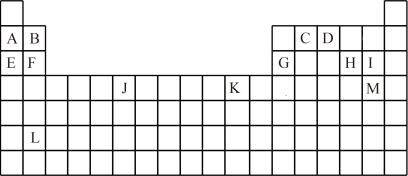
试回答下列问题:
(1)写出基态J原子的电子排布式:______ ,L的原子序数:_____ ,M的简化电子排布式:______ 。
(2)下列关于元素在元素周期表中的位置的叙述正确的是______ (填选项字母)。
(3)下列有关说法正确的是______ (填选项字母)。
(4)如图是部分元素原子的第一电离能I1随原子序数变化的曲线图。
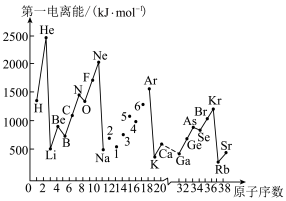
①认真分析图中同周期元素第一电离能的变化规律,将Na~Ar之间的元素用短线连接起来,构成完整的图像______ 。
②从图像分析可知,同一主族元素原子的第一电离能I1变化规律是______ 。Zn的第一电离能大于Ga的原因是______ 。

试回答下列问题:
(1)写出基态J原子的电子排布式:
(2)下列关于元素在元素周期表中的位置的叙述正确的是
| A.K位于元素周期表中第四周期第IIB族,属于ds区元素 |
| B.J位于元素周期表中第四周期第IVB族,属于d区元素 |
| C.F位于元素周期表中第三周期第IIA族,属于s区元素 |
| D.I位于元素周期表中第三周期第VIIA族,属于ds区元素 |
| A.第一电离能:G>F>E | B.电负性:D>C |
| C.原子半径:E>B | D.最高价含氧酸的酸性:I>H |

①认真分析图中同周期元素第一电离能的变化规律,将Na~Ar之间的元素用短线连接起来,构成完整的图像
②从图像分析可知,同一主族元素原子的第一电离能I1变化规律是
您最近一年使用:0次
22-23高一下·浙江·期中
3 . 2015年4月,于敏获颁“影响世界华人终身成就奖”。钚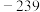 是“于敏型”氢弹的重要原料。下列说法正确的是
是“于敏型”氢弹的重要原料。下列说法正确的是
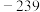 是“于敏型”氢弹的重要原料。下列说法正确的是
是“于敏型”氢弹的重要原料。下列说法正确的是A.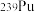 原子的原子核中含有239个质子 原子的原子核中含有239个质子 | B.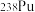 、 、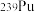 和 和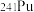 属于不同的核素 属于不同的核素 |
C.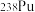 与 与 在元素周期表中的位置相同 在元素周期表中的位置相同 | D.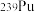 衰变成 衰变成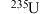 属于化学变化 属于化学变化 |
您最近一年使用:0次
名校
解题方法
4 . (I)俄美科学家联合小组宣布合成出114号元素(Fl)的一种同位素,该原子的质量数是289,试回答下列问题:
(1)该元素在周期表中的位置为:_______ ,属于_______ 元素(填“金属”或“非金属”)。
(II)下表为元素周期表的部分,列出了10种元素在元素周期表中的位置,试回答下列问题:
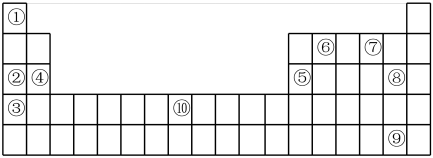
(2)②③④三种元素最高价氧化物的水化物碱性由强到弱的顺序是_______ (填化学式)。
(3)元素⑦的简单氢化物与③的单质反应的离子方程式为_______ ;
(4)元素②和⑤的最高价氧化物的水化物反应的离子方程式为_______ ;
(5)元素⑩的名称为_______ ,其单质与⑧的单质反应的化学方程式为_______ ;
(6)部分短周期元素的原子半径及主要化合价如下表,判断以下叙述不正确的是_______
A.L2+、R2-的核外电子数相等
B.单质与稀盐酸反应的速率L<Q
C.M与T形成的化合物具有两性
D.简单氢化物的沸点为HnT>HnR
E.T与R可形成的化合物TR2、TR3
F.Q与M的单质均能与盐酸、NaOH溶液反应放出氢气
(1)该元素在周期表中的位置为:
(II)下表为元素周期表的部分,列出了10种元素在元素周期表中的位置,试回答下列问题:

(2)②③④三种元素最高价氧化物的水化物碱性由强到弱的顺序是
(3)元素⑦的简单氢化物与③的单质反应的离子方程式为
(4)元素②和⑤的最高价氧化物的水化物反应的离子方程式为
(5)元素⑩的名称为
(6)部分短周期元素的原子半径及主要化合价如下表,判断以下叙述不正确的是
| 元素代号 | L | M | Q | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.112 | 0.104 | 0.066 |
| 主要化合价 | +2 | +3 | +2 | +6、-2 | -2 |
B.单质与稀盐酸反应的速率L<Q
C.M与T形成的化合物具有两性
D.简单氢化物的沸点为HnT>HnR
E.T与R可形成的化合物TR2、TR3
F.Q与M的单质均能与盐酸、NaOH溶液反应放出氢气
您最近一年使用:0次
5 . 按照要求回答下列问题。
(1)有下列物质: 、
、 、
、 、
、 、
、 、
、 、
、 。
。
①上述物质中既含共价键又含离子键的__________ ;属于共价化合物的是__________ ;
② 溶于水时破坏
溶于水时破坏__________ (填“共价键”或“离子键”,下同), 熔化时破坏
熔化时破坏__________ 。
(2)砷在元素周期表中的位置__________ 。原子序数为115的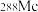 中子数为
中子数为__________ 。
(3)向 溶液中通入氯气出现黄色浑浊,反应的离子方程式为
溶液中通入氯气出现黄色浑浊,反应的离子方程式为__________ 。可证明非金属性:
__________ S(填“>”或“<”)。
(4)短周期元素Y的一种含氧酸化学式为 ,其结构式可表示为
,其结构式可表示为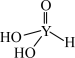 。该酸为
。该酸为__________ 元酸。写出该酸与过量 溶液反应的化学方程式:
溶液反应的化学方程式:__________ 。(用对应元素符号作答。已知信息:氢氧原子结合成的一种原子团“ ”叫羟基,含氧酸中只有羟基氢才可电离出
”叫羟基,含氧酸中只有羟基氢才可电离出 )
)
(1)有下列物质:
 、
、 、
、 、
、 、
、 、
、 、
、 。
。①上述物质中既含共价键又含离子键的
②
 溶于水时破坏
溶于水时破坏 熔化时破坏
熔化时破坏(2)砷在元素周期表中的位置
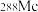 中子数为
中子数为(3)向
 溶液中通入氯气出现黄色浑浊,反应的离子方程式为
溶液中通入氯气出现黄色浑浊,反应的离子方程式为
(4)短周期元素Y的一种含氧酸化学式为
 ,其结构式可表示为
,其结构式可表示为 。该酸为
。该酸为 溶液反应的化学方程式:
溶液反应的化学方程式: ”叫羟基,含氧酸中只有羟基氢才可电离出
”叫羟基,含氧酸中只有羟基氢才可电离出 )
)
您最近一年使用:0次
2023-03-24更新
|
696次组卷
|
3卷引用:河南省南阳市六校2022-2023学年高一下学期第一次联考化学试题
名校
解题方法
6 . 下列关于元素周期表及周期律的叙述,其中错误的是
①一般在过渡元素中寻找一些化学反应新型催化剂
②硒化氢(H2Se)是无色,有毒,比H2S稳定的气体
③研制农药通常考虑含有元素周期表右上角元素(氟、氯、硫、磷等)的有机物
④按F2→I2的顺序单质氧化性逐渐减弱,故前面的卤素单质可将后面的卤素从它们的盐溶液里置换出来
⑤元素周期表中位于金属和非金属分界线附近的元素属于过渡元素
⑥砹(At)为ⅦA元素,推测单质砹为有色固体,HAt不稳定,AgAt不溶于水也不溶于稀硝酸
⑦ⅠA族元素全部是金属元素,第ⅢA族位于元素周期表第3纵列
①一般在过渡元素中寻找一些化学反应新型催化剂
②硒化氢(H2Se)是无色,有毒,比H2S稳定的气体
③研制农药通常考虑含有元素周期表右上角元素(氟、氯、硫、磷等)的有机物
④按F2→I2的顺序单质氧化性逐渐减弱,故前面的卤素单质可将后面的卤素从它们的盐溶液里置换出来
⑤元素周期表中位于金属和非金属分界线附近的元素属于过渡元素
⑥砹(At)为ⅦA元素,推测单质砹为有色固体,HAt不稳定,AgAt不溶于水也不溶于稀硝酸
⑦ⅠA族元素全部是金属元素,第ⅢA族位于元素周期表第3纵列
| A.3个 | B.4个 | C.5个 | D.6个 |
您最近一年使用:0次
2023-03-17更新
|
999次组卷
|
6卷引用:山东省德州市第一中学2022-2023学年高一3月月考化学试题
山东省德州市第一中学2022-2023学年高一3月月考化学试题山东省德州市2022-2023学年高一下学期3月月考化学试题湖北省沙市中学2022-2023学年高一下学期4月期中考试化学试题(已下线)第17讲 元素周期律-【暑假自学课】2023年新高一化学暑假精品课(人教版2019必修第一册)(已下线)衔接点21 元素周期表和元素周期律-2024年初升高化学无忧衔接(通用版)4.2.2 元素周期表和元素周期律的应用(提高)
名校
解题方法
7 . 硼氢化钠(NaBH4)具有很强的还原性,被称为“万能还原剂”,NaBH4在催化剂钌(44Ru)表面与水反应的历程如图所示:
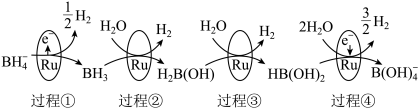
| A.元素钌(44Ru)位于d区 |
| B.BH3分子的空间结构和VSEPR模型不同 |
| C.过程④中产生1molH2,转移电子物质的量为2mol |
| D.硼氢化钠中硼元素的化合价为+3价,反应过程中硼元素的化合价始终保持不变 |
您最近一年使用:0次
2023-03-16更新
|
353次组卷
|
3卷引用:山东省德州市第一中学2022-2023学年高二下学期3月月考化学试题
名校
8 . 几种主族元素在周期表中的位置如下:
根据上表回答下列问题:
(1)画出⑩的原子结构示意图:_______ 。
(2)④和⑨两种元素形成的化合物的电子式是_______ 。
(3)②、⑦、⑧三种元素离子半径由大到小的顺序是_______ (用离子符号表示)。
(4)由⑥、⑨组成的化合物分子中,⑥、⑨原子的最外层均达到8电子稳定结构,该化合物遇水可生成一种具有漂白性的化合物和一种碱性气体,试写出该反应的化学方程式:_______ 。
(5)对于元素②与④,能说明②的金属性比④强的是_______(填标号)。
(6)由①、③、⑦组成的化合物中含有的化学键有_______ 。
(7)在含有①、④、⑤简单阳离子的 溶液中,逐滴滴加
溶液中,逐滴滴加 的
的 溶液到过量,生成沉淀的质量与加入的
溶液到过量,生成沉淀的质量与加入的 溶液的体积关系如图所示。由图中数据分析计算:
溶液的体积关系如图所示。由图中数据分析计算:
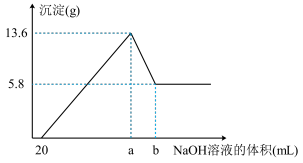
i.沉淀减少时发生的离子方程式:_______ 。
ii.a点的数值为_______  。
。
| 族 周期 | IA | 0 | ||||||
| 1 | ① | IIA | IIIA | IVA | VA | VIA | VIIA | |
| 2 | ⑥ | ⑦ | ||||||
| 3 | ② | ④ | ⑤ | ⑧ | ⑨ | |||
| 4 | ③ | ⑩ | ||||||
(1)画出⑩的原子结构示意图:
(2)④和⑨两种元素形成的化合物的电子式是
(3)②、⑦、⑧三种元素离子半径由大到小的顺序是
(4)由⑥、⑨组成的化合物分子中,⑥、⑨原子的最外层均达到8电子稳定结构,该化合物遇水可生成一种具有漂白性的化合物和一种碱性气体,试写出该反应的化学方程式:
(5)对于元素②与④,能说明②的金属性比④强的是_______(填标号)。
A.②与 反应比④与 反应比④与 反应剧烈 反应剧烈 |
| B.②单质的熔、沸点比④的低 |
| C.②的最高价氧化物对应的水化物的碱性比④的最高价氧化物对应的水化物的碱性强 |
| D.与非金属单质反应时,②原子失电子数目比④原子失电子数目少 |
(7)在含有①、④、⑤简单阳离子的
 溶液中,逐滴滴加
溶液中,逐滴滴加 的
的 溶液到过量,生成沉淀的质量与加入的
溶液到过量,生成沉淀的质量与加入的 溶液的体积关系如图所示。由图中数据分析计算:
溶液的体积关系如图所示。由图中数据分析计算:
i.沉淀减少时发生的离子方程式:
ii.a点的数值为
 。
。
您最近一年使用:0次
名校
9 . 某物质结构如图所示,其中X、Y、Z、M、W均为短周期主族元素,且原子序数依次增大。下列说法正确的是
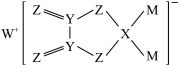
A.原子半径: | B.第一电离能: |
C.X和Y原子均为 杂化 杂化 | D.该物质中除W外均是p区元素 |
您最近一年使用:0次
2023-01-10更新
|
708次组卷
|
3卷引用:湖北省部分市州2022-2023学年高三元月联合调研考试化学试题
10 . 下表标出的是元素周期表的一部分元素,回答下列问题:

(1)第三周期中原子半径最小的是___________ 。(用元素符号表示)
(2)表中用字母标出的15种元素中,化学性质最不活泼的是___________ (用元素符号表示),金属性最强的是___________ ,(用元素符号表示)非金属性最强的是___________ ,(用元素符号表示)属于过渡元素的是___________ (用字母表示)。
(3)d,e,f气态氢化物最稳定的为___________ , 最不稳定的为___________ 。(填化学式)
(4)钛被称为继铁、铝之后的第三金属,钛元素在元素周期表中的位置为___________ ,其价电子排布式为___________ 。
(5)请画出26号元素其价电子排布图:___________ 。
(6)d与a反应的产物的分子中心原子的杂化形式为___________ ,该分子是___________ (填“极性”或“非极性”)分子。
(7)写出铜元素在周期表中的位置___________ ,它位于___________ 区。并写出Cu+ 基态电子排布式___________ 。
(8)o、p两元素的部分电离能数据列于下表:
比较两元素的I2、I3可知,气态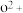 再失去一个电子比气态
再失去一个电子比气态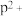 再失去一个电子难。对此,你的解释是
再失去一个电子难。对此,你的解释是___________
(9)元素X的某价态阴离子Xn-中所有电子正好充满K和L电子层,CnX的晶体结构如图所示。
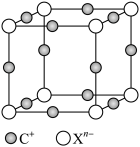
该晶体中阳离子和阴离子个数比为___________ ,晶体中每个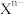 被
被___________ 个等距离的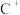 包围。
包围。

(1)第三周期中原子半径最小的是
(2)表中用字母标出的15种元素中,化学性质最不活泼的是
(3)d,e,f气态氢化物最稳定的为
(4)钛被称为继铁、铝之后的第三金属,钛元素在元素周期表中的位置为
(5)请画出26号元素其价电子排布图:
(6)d与a反应的产物的分子中心原子的杂化形式为
(7)写出铜元素在周期表中的位置
(8)o、p两元素的部分电离能数据列于下表:
| 元素 | o | p | |
| 电离能/kJ·mol-1 | I1 | 717 | 759 |
| I2 | 1 509 | 1 561 | |
| I3 | 3 248 | 2 957 |
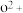 再失去一个电子比气态
再失去一个电子比气态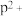 再失去一个电子难。对此,你的解释是
再失去一个电子难。对此,你的解释是(9)元素X的某价态阴离子Xn-中所有电子正好充满K和L电子层,CnX的晶体结构如图所示。

该晶体中阳离子和阴离子个数比为
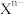 被
被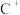 包围。
包围。
您最近一年使用:0次



