名校
1 . 部分短周期元素的性质或原子结构如下表所示。
下列叙述不正确的是
| 元素代号 | 元素的性质或原子结构 |
| W | M层上的电子数为4 |
| X | 常温下,其单质为双原子分子,其氢化物的水溶液显碱性 |
| Y | L层电子数为次外层电子数的3倍 |
| Z | 元素最高正价是+ 7价 |
| A.原子半径:W>X>Y |
| B.化合物WY2不溶于水 |
| C.由X、Y和氢三种元素形成的所有化合物中只含共价键 |
| D.最高价氧化物对应水化物的酸性:W<Z |
您最近一年使用:0次
2017-04-20更新
|
798次组卷
|
7卷引用:2017届湖南省郴州市高三第四次质量检测理科综合化学试卷
2 . 下表是元素周期表的一部分,列出11种元素在周期表中的位置,填写下列空白。
(1)第三周期元素中,原子半径最大的元素是(稀有气体除外)______ ,离子半径最小的是____ (写元素符号)。
(2)J的简单离子的结构示意图__________ 。
(3)D、E、F、K四元素的最高价氧化物对应水化物,按碱性依次减弱顺序排列为(写化学式)____ 。
(4)比较G、H两元素的最高价氧化物对应水化物的酸性______ (写化学式,下同)。比较C、G两元素的气态氢化物稳定性_________ 。
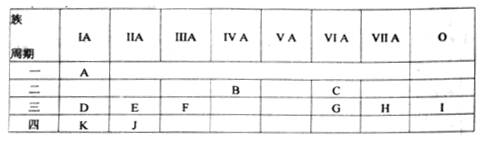
(1)第三周期元素中,原子半径最大的元素是(稀有气体除外)
(2)J的简单离子的结构示意图
(3)D、E、F、K四元素的最高价氧化物对应水化物,按碱性依次减弱顺序排列为(写化学式)
(4)比较G、H两元素的最高价氧化物对应水化物的酸性
您最近一年使用:0次
名校
解题方法
3 . (1)写出下列具有10个电子的粒子的化学式:原子的原子结构示意图_____________ ,由2个原子组成的分子是_____________ 、阴离子是_____________ 。
(2)X、Y、Z、W为短周期的四种元素,其最高正价依次为+1、+4、+5、+7,核电荷数按照Y、Z、X、W的顺序增大。已知Y与Z的原子次外层的电子数均为2,W、X的原子次外层的电子数均为8。
①写出Y元素的名称_____________________ 。
②写出W元素在周期表中的位置__________________ 。
③写出X的最高价氧化物与Z的最高价氧化物对应水化物反应的化学方程式________________________ 。
④按碱性减弱、酸性增强的顺序写出各元素最高价氧化物对应水化物的分子式:_____________ ,_____________ ,_____________ ,_____________ 。
(2)X、Y、Z、W为短周期的四种元素,其最高正价依次为+1、+4、+5、+7,核电荷数按照Y、Z、X、W的顺序增大。已知Y与Z的原子次外层的电子数均为2,W、X的原子次外层的电子数均为8。
①写出Y元素的名称
②写出W元素在周期表中的位置
③写出X的最高价氧化物与Z的最高价氧化物对应水化物反应的化学方程式
④按碱性减弱、酸性增强的顺序写出各元素最高价氧化物对应水化物的分子式:
您最近一年使用:0次
9-10高一下·北京朝阳·期末
解题方法
4 . 下图是元素周期表的一部分,针对表中的①—⑧八种元素,用元素符号或化学式回答相关问题:
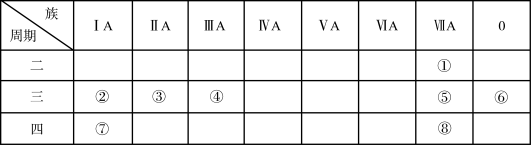
(1)在这些元素中,化学性质最不活泼的原子的原子结构示意图为___________ 。
(2)地壳中含量最多的金属元素是___________ 。
(3)用电子式表示①与③形成化合物的过程:__________________ 。
(4)这些元素的氧化物对应的水化物中,酸性最强的是________ ,碱性最强的是__________ ,显两性的是___________ ,该两性物质与②的最高价氧化物对应水化物的溶液反应的离子方程式为: _______________________ 。
(5)①②③④四种元素的简单离子核外电子排布相同,都有__________ 个电子,它们的离子半径由大到小的顺序是__________________ (用“>”表示)。
(6)①⑤⑧三种元素的单质沸点由高到低的顺序是_________________ (用“>”表示)。

(1)在这些元素中,化学性质最不活泼的原子的原子结构示意图为
(2)地壳中含量最多的金属元素是
(3)用电子式表示①与③形成化合物的过程:
(4)这些元素的氧化物对应的水化物中,酸性最强的是
(5)①②③④四种元素的简单离子核外电子排布相同,都有
(6)①⑤⑧三种元素的单质沸点由高到低的顺序是
您最近一年使用:0次
解题方法
5 . 如表所示为元素周期表的一部分,参照元素①~⑨在表中的位置,请回答下列问题:
(1)周期表中元素最高正价与最低价代数和为零的是______________ 族(用族序号表示)。
(2)⑥和⑦的最高价含氧酸的酸性强弱为_______________ (用酸的化学式表示)。
(3)①、②两种元素按原子个数之比为1:1组成的常见液态化合物,在酸性溶液中能将Fe2+氧化,写出该反应的离子方程式______________________ ;
(4)已知周期表中存在对角相似规则,如铍(Be)与铝化学性质相似,⑧的氧化物、氢氧化物也有两性,写出⑧的氢氧化物与④的最高价氧化物的水化物反应的化学方程式__________________ 。
(5)已知W+X=Y+Z(反应需要加热,),W、X、Y、Z分别是由①②⑨三种元素形成的四种十电子粒子(W、X为离子,Y、Z为分子),写出该化学方程式_______________________ 。
(6)由表中元素形成的物质可发生如图中的反应,其中B、C、G是单质,B为黄绿色气体,D溶液显碱性。
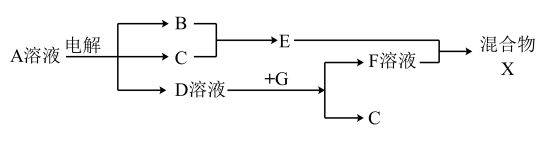
①写出D溶液与G反应的化学方程式_______________________ 。
②写出检验A溶液中溶质的阴离子的方法___________________________ 。
(1)周期表中元素最高正价与最低价代数和为零的是
(2)⑥和⑦的最高价含氧酸的酸性强弱为
(3)①、②两种元素按原子个数之比为1:1组成的常见液态化合物,在酸性溶液中能将Fe2+氧化,写出该反应的离子方程式
| 族 周期 | IA | 0 | ||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ⑧ | ⑨ | ② | ③ | ||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ||||
(5)已知W+X=Y+Z(反应需要加热,),W、X、Y、Z分别是由①②⑨三种元素形成的四种十电子粒子(W、X为离子,Y、Z为分子),写出该化学方程式
(6)由表中元素形成的物质可发生如图中的反应,其中B、C、G是单质,B为黄绿色气体,D溶液显碱性。

①写出D溶液与G反应的化学方程式
②写出检验A溶液中溶质的阴离子的方法
您最近一年使用:0次
名校
解题方法
6 . 元素周期表与元素周期律在学习、研究和生产实践中有很重要的作用。下表列出了①~⑨九种元素在周期表中的位置。请用相关的化学术语回答下列问题:
(1) 在这些元素中,最不活泼的是 ,非金属性最强的是___________,金属性最强的是___________;(填元素符号或化学式,下同。)
(2) 这些元素形成的最高价氧化物对应的水化物中碱性最强的 ,酸性最强的__________;
(3) ①、②、③、④、⑤这五种元素的原子半径由大到小的顺序为 ;
(4) ⑥的氢化物的电子式为 ,① 在空气中燃烧后生成产物的电子式 。
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA[ | 0 |
| 2 | ⑤ | ⑥ | ⑦ | |||||
| 3 | ① | ③ | ④ | ⑧ | ⑨ | |||
| 4 | ② |
(2) 这些元素形成的最高价氧化物对应的水化物中碱性最强的 ,酸性最强的__________;
(3) ①、②、③、④、⑤这五种元素的原子半径由大到小的顺序为 ;
(4) ⑥的氢化物的电子式为 ,① 在空气中燃烧后生成产物的电子式 。
您最近一年使用:0次
解题方法
7 . 饮用水中含有砷会导致砷中毒,金属冶炼过程产生的含砷有毒废弃物需处理与检测。冶炼废水中砷元素主要以亚砷酸(H3AsO3)形式存在,可用化学沉降法处理酸性高浓度含砷废水,其工艺流程如下:
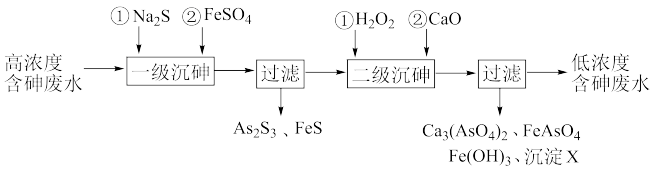
已知:①As2S3与过量的S2-存在以下反应:As2S3(s)+3S2-(aq) 2
2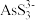 (aq);
(aq);
②亚砷酸盐的溶解性大于相应砷酸盐。
(1)砷是第四周期VA族元素,则砷的原子序数为________ ;AsH3的电子式为____________ ;
(2)根据元素周期律,下列说法正确的是_________ 。
a.酸性: H2SO4>H3PO4>H3AsO4 b.原子半径:S>P>As c.非金属性:S>P>As
(3)砷酸的第一步电离方程式为________________ 。
(4)沉淀X为_________________ (填化学式)。
(5)“一级沉砷”中FeSO4的作用是____________________________________________ ;“二级沉砷”中H2O2与含砷物质反应的化学方程式为_____________________________ 。
(6)关于地下水中砷的来源有多种假设,其中一种认为是富含砷的黄铁矿(FeS2)被氧化为Fe(OH)3,同时生成 ,导致砷脱离矿体进入地下水。FeS2被O2氧化的离子方程式为
,导致砷脱离矿体进入地下水。FeS2被O2氧化的离子方程式为______________________

已知:①As2S3与过量的S2-存在以下反应:As2S3(s)+3S2-(aq)
 2
2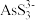 (aq);
(aq);②亚砷酸盐的溶解性大于相应砷酸盐。
(1)砷是第四周期VA族元素,则砷的原子序数为
(2)根据元素周期律,下列说法正确的是
a.酸性: H2SO4>H3PO4>H3AsO4 b.原子半径:S>P>As c.非金属性:S>P>As
(3)砷酸的第一步电离方程式为
(4)沉淀X为
(5)“一级沉砷”中FeSO4的作用是
(6)关于地下水中砷的来源有多种假设,其中一种认为是富含砷的黄铁矿(FeS2)被氧化为Fe(OH)3,同时生成
 ,导致砷脱离矿体进入地下水。FeS2被O2氧化的离子方程式为
,导致砷脱离矿体进入地下水。FeS2被O2氧化的离子方程式为
您最近一年使用:0次



