名校
1 . 短周期元素 a~g 在表中的位置如右表,请回答下列问题:
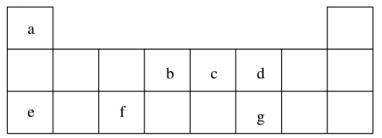
(1)d、e元素常见离子的半径由大到小的顺序为(用化学式表示)__________ ;b、c两元素非金属性较强的是(写元素符号)_________ ,写出能证明这一结论的一个化学方程式_____________ 。
(2)下列有关说法正确的是( )
A.e在 d2 中燃烧,生成e2d
B.加热熔化eda时不可用Al2O3坩埚,可用瓷坩埚
C.将 gd2 通入溴水中,溴水褪色,体现了gd2 的漂白性
D.将打磨过的 f 置于酒精灯上点燃,观察到f 熔化但未见液滴滴落
(3)上述元素可组成盐 R:ca4f(gd4)2和盐S:ca4agd4。
①相同条件下,0.1 mol·L-1盐R中 c(ca4+)_______ (填“=”、 “>”或“<”)0.1 mol·L-1盐S中c(ca4+)。
②R常用作净水剂,其原理为(用离子方程式表示)______________ 。
③向盛有 10 mL 1 mol·L-1盐S溶液的烧杯中滴加1 mol·L-1 NaOH溶液至中性,则反应后各离子浓度由大到小的排列顺序是_____________ 。
④向盛有 10 mL 1 mol·L-1盐R溶液的烧杯中滴加 1 mol·L-1NaOH溶液 32 mL后,继续滴加至35 mL,写出此时段(32 mL~35 mL)间发生的离子方程式:_____________ 。

(1)d、e元素常见离子的半径由大到小的顺序为(用化学式表示)
(2)下列有关说法正确的是
A.e在 d2 中燃烧,生成e2d
B.加热熔化eda时不可用Al2O3坩埚,可用瓷坩埚
C.将 gd2 通入溴水中,溴水褪色,体现了gd2 的漂白性
D.将打磨过的 f 置于酒精灯上点燃,观察到f 熔化但未见液滴滴落
(3)上述元素可组成盐 R:ca4f(gd4)2和盐S:ca4agd4。
①相同条件下,0.1 mol·L-1盐R中 c(ca4+)
②R常用作净水剂,其原理为(用离子方程式表示)
③向盛有 10 mL 1 mol·L-1盐S溶液的烧杯中滴加1 mol·L-1 NaOH溶液至中性,则反应后各离子浓度由大到小的排列顺序是
④向盛有 10 mL 1 mol·L-1盐R溶液的烧杯中滴加 1 mol·L-1NaOH溶液 32 mL后,继续滴加至35 mL,写出此时段(32 mL~35 mL)间发生的离子方程式:
您最近一年使用:0次
2017-10-21更新
|
707次组卷
|
3卷引用:四川省成都市第七中学2017-2018学年高二上学期第一次月考化学试题
2 . 按照要求回答下列问题。
(1)有下列物质: 、
、 、
、 、
、 、
、 、
、 、
、 。
。
①上述物质中既含共价键又含离子键的__________ ;属于共价化合物的是__________ ;
② 溶于水时破坏
溶于水时破坏__________ (填“共价键”或“离子键”,下同), 熔化时破坏
熔化时破坏__________ 。
(2)砷在元素周期表中的位置__________ 。原子序数为115的 中子数为
中子数为__________ 。
(3)向 溶液中通入氯气出现黄色浑浊,反应的离子方程式为
溶液中通入氯气出现黄色浑浊,反应的离子方程式为__________ 。可证明非金属性:
__________ S(填“>”或“<”)。
(4)短周期元素Y的一种含氧酸化学式为 ,其结构式可表示为
,其结构式可表示为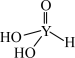 。该酸为
。该酸为__________ 元酸。写出该酸与过量 溶液反应的化学方程式:
溶液反应的化学方程式:__________ 。(用对应元素符号作答。已知信息:氢氧原子结合成的一种原子团“ ”叫羟基,含氧酸中只有羟基氢才可电离出
”叫羟基,含氧酸中只有羟基氢才可电离出 )
)
(1)有下列物质:
 、
、 、
、 、
、 、
、 、
、 、
、 。
。①上述物质中既含共价键又含离子键的
②
 溶于水时破坏
溶于水时破坏 熔化时破坏
熔化时破坏(2)砷在元素周期表中的位置
 中子数为
中子数为(3)向
 溶液中通入氯气出现黄色浑浊,反应的离子方程式为
溶液中通入氯气出现黄色浑浊,反应的离子方程式为
(4)短周期元素Y的一种含氧酸化学式为
 ,其结构式可表示为
,其结构式可表示为 。该酸为
。该酸为 溶液反应的化学方程式:
溶液反应的化学方程式: ”叫羟基,含氧酸中只有羟基氢才可电离出
”叫羟基,含氧酸中只有羟基氢才可电离出 )
)
您最近一年使用:0次
2023-03-24更新
|
649次组卷
|
3卷引用:河南省南阳市六校2022-2023学年高一下学期第一次联考化学试题
名校
解题方法
3 . 有A、B、C、D、E五种短周期元素,已知相邻的A、B、C、D四种元素原子核外共有56个电子,在周期表中的位置如图所示。E的单质可与酸反应, 1mol E单质与足量酸作用,在标准状况下能产生33.6LH2;E的阳离子与A的阴离子核外电子层结构完全相同,回答下列问题:
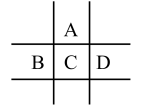
(1)A元素的名称为____________ ,D离子的结构示意图为_____________ 。
(2)C在周期表中的位置为______________________ 。
(3)元素C与元素D相比,非金属性较强的是__________ (用元素符号表示),下列表述中能证明这一事实的是________ 。(填字母序号)
a.常温下C的单质和D的单质状态不同
b.D的气态氢化物比C的气态氢化物稳定
c.一定条件下C和D的单质都能与氢氧化钠溶液反应
d.D的最高价氧化物的水化物的酸性比C的最高价氧化物的水化物的酸性强
e.D的单质能和C的钠盐溶液反应生成C的单质
(4)元素A的一种氢化物含有非极性键,A的这种氢化物的电子式是____________ 。
(5)A、C、D、E元素形成的简单离子半径的大小顺序是________ 。(用离子符号表示)
(6)E的最高价氧化物对应的水化物跟氢氧化钠溶液反应的化学方程式是________________ 。

(1)A元素的名称为
(2)C在周期表中的位置为
(3)元素C与元素D相比,非金属性较强的是
a.常温下C的单质和D的单质状态不同
b.D的气态氢化物比C的气态氢化物稳定
c.一定条件下C和D的单质都能与氢氧化钠溶液反应
d.D的最高价氧化物的水化物的酸性比C的最高价氧化物的水化物的酸性强
e.D的单质能和C的钠盐溶液反应生成C的单质
(4)元素A的一种氢化物含有非极性键,A的这种氢化物的电子式是
(5)A、C、D、E元素形成的简单离子半径的大小顺序是
(6)E的最高价氧化物对应的水化物跟氢氧化钠溶液反应的化学方程式是
您最近一年使用:0次
解题方法
4 . 在元素周期表中,非金属元素集中于右上角的位置,它们虽然种类少,但其用途却不容小觑。
(1)元素周期表的非金属元素中,属于主族元素的共有________ 种。
(2)红磷是巨型共价分子、无定型结构。能证明红磷是非晶体的最可靠方法是________ 。
A.质谱 B.原子发射光谱 C.核磁共振谱 D.X 射线衍射
(3)成语“信口雕黄”中的雌黄分子式为As2S3,分子结构如右图。
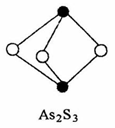
其分子中S原子的杂化方式为________ 。雌黄和SnCl2在盐酸中反应转化为雄黄(As4S4)和SnCl4并放出H2S气体,写出该反应的化学方程式______ 。
(4)已知pKa=-lgKa。
①有机酸的酸性强弱受邻近碳上取代原子的影响,如酸性: BrCH2COOH >CH3COOH。据此推测,pKa:ClCH2COOH______ FCH2COOH(填“>”、“<”、“=”)。
②硼酸(H3BO3)是一元酸,它在水中表现出来的弱酸性,并不是自身电离出H+所致,而是H3BO3与水电离出的OH-结合生成一个酸根离子,请写出该酸根离子的结构简式:________ (若存在配位键,请用箭头标出)。
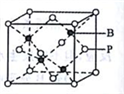
(5)磷化硼的晶胞模型如右图所示,晶胞参数为a pm,已知B、P的原子半径分别表示为rBpm、rP pm。该晶胞中磷原子的配位数为________ ,晶体中原子的空间利用率为______ 。
(1)元素周期表的非金属元素中,属于主族元素的共有
(2)红磷是巨型共价分子、无定型结构。能证明红磷是非晶体的最可靠方法是
A.质谱 B.原子发射光谱 C.核磁共振谱 D.X 射线衍射
(3)成语“信口雕黄”中的雌黄分子式为As2S3,分子结构如右图。

其分子中S原子的杂化方式为
(4)已知pKa=-lgKa。
①有机酸的酸性强弱受邻近碳上取代原子的影响,如酸性: BrCH2COOH >CH3COOH。据此推测,pKa:ClCH2COOH
②硼酸(H3BO3)是一元酸,它在水中表现出来的弱酸性,并不是自身电离出H+所致,而是H3BO3与水电离出的OH-结合生成一个酸根离子,请写出该酸根离子的结构简式:
(5)磷化硼的晶胞模型如右图所示,晶胞参数为a pm,已知B、P的原子半径分别表示为rBpm、rP pm。该晶胞中磷原子的配位数为

您最近一年使用:0次
名校
5 . 某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验。
I.(1)将钠、钾、镁、铝各1mol分别投入到足量的同浓度的盐酸中,试预测实验结果:
_________ 与盐酸反应最剧烈;________ 与盐酸反应的速度最慢;_________ 与盐酸反应产生的气体最多。
(2)将NaOH溶液与NH4Cl溶液混合生成NH3·H2O,从而验证NaOH碱性强于NH3·H2O,继而可以验证Na的金属性强于氮,你认为此设计是否合理?并说明理由___________ 。
II. 利用如图装置可验证同主族元素非金属性的变化规律。
(3)仪器B的名称为________ ,干燥管D的作用为_______ 。
(4)若要证明非金属性Cl>I,则A中加浓盐酸,B中加KMnO4(KMnO4与浓盐酸常温下反应生成氯气),C中加淀粉碘化钾混合溶液,观察到C中溶液________ (填现象),即可证明。从环境保护的观点考虑,此装置缺少尾气处理装置,可用_______ 溶液吸收尾气。
(5)若要证明非金属性C>Si,则在A中加盐酸、B中加CaCO3、C中加Na2SiO3溶液,观察到C中溶液_____ (填现象),即可证明。但有的同学认为盐酸具有挥发性,可进入C中干扰实验,应在两装置间添加装有________ 溶液的洗气瓶除去。
I.(1)将钠、钾、镁、铝各1mol分别投入到足量的同浓度的盐酸中,试预测实验结果:
(2)将NaOH溶液与NH4Cl溶液混合生成NH3·H2O,从而验证NaOH碱性强于NH3·H2O,继而可以验证Na的金属性强于氮,你认为此设计是否合理?并说明理由
II. 利用如图装置可验证同主族元素非金属性的变化规律。
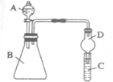
(3)仪器B的名称为
(4)若要证明非金属性Cl>I,则A中加浓盐酸,B中加KMnO4(KMnO4与浓盐酸常温下反应生成氯气),C中加淀粉碘化钾混合溶液,观察到C中溶液
(5)若要证明非金属性C>Si,则在A中加盐酸、B中加CaCO3、C中加Na2SiO3溶液,观察到C中溶液
您最近一年使用:0次
2017-04-01更新
|
586次组卷
|
2卷引用:2016-2017学年山东省枣庄市第八中学北校区高一下学期第一次月考化学试卷
6 . 短周期主族元素 A、B、C、D、E、F 的原子序数依次增大,A 原子核外最外 层电子数是其电子层数的 2 倍,A、B 的核电荷数之比为 3:4。C 与 D 均为金属元素,5.8 g D 的氢氧化物恰好能与 100 mL 2 mol·L-1 盐酸完全反应,D 原子核中质子数和中子数相等。E 与F 相邻,F-的最外层为 8 电子结构。根据上述条件,用化.学.用.语.回答:
(1)D 在周期表中的位置____ ;
(2)B、C 易形成淡黄色化合物,其电子式为____ ,该物质含有的化学键 类型为_____ ;
(3)用电子式表示 DF2 的形成过程____ ;
(4)元素 E、F 中非金属性较强的是____ ,请用一个置换反应证明____ (写化学反应方程式);
(5)原子半径:C____ E;熔点:DB____ CF(填“>”“<”或“=”);
(6)A、B、E 可形成一个三原子分子,且每个原子均达到 8 电子稳定结构,则该分子的 结构式为____ ;含 A元素的化合物在是自然界种类最多的原因是____ 。
(1)D 在周期表中的位置
(2)B、C 易形成淡黄色化合物,其电子式为
(3)用电子式表示 DF2 的形成过程
(4)元素 E、F 中非金属性较强的是
(5)原子半径:C
(6)A、B、E 可形成一个三原子分子,且每个原子均达到 8 电子稳定结构,则该分子的 结构式为
您最近一年使用:0次
7 . 固体化合物X由四种元素组成,某学习小组开展如下探究实验。下列说法错误的是
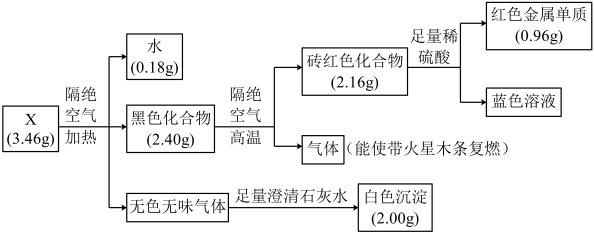
| A.固体化合物X中的金属元素位于周期表第四周期第ⅠB族 |
| B.固体化合物X为Cu2(OH)2CO3 |
| C.黑色化合物隔绝空气分解的过程中,生成1 mol砖红色化合物,转移2 mol电子 |
| D.蓝色溶液经蒸发浓缩、冷却结晶、过滤、洗涤、干燥,可制得胆矾晶体 |
您最近一年使用:0次
名校
解题方法
8 . 甲~戊均为短周期元素,在元素周期表中的相对位置如图所示。戊的最高价氧化物对应的水化物为强酸。下列说法不正确 的是
| 甲 | 乙 | |
| 丙 | 丁 | 戊 |
| A.原子半径:丁>戊>乙 |
| B.乙的简单氢化物的沸点一定高于戊的简单氢化物的沸点 |
| C.甲的简单氢化物遇氯化氢一定有白烟产生 |
| D.丙的最高价氧化物对应的水化物一定能与强碱反应 |
您最近一年使用:0次
解题方法
9 . 一种超导材料(仅由 、
、 、F三种元素组成)的长方体晶胞结构如图所示(已知
、F三种元素组成)的长方体晶胞结构如图所示(已知 ),下列说法错误的是
),下列说法错误的是
 、
、 、F三种元素组成)的长方体晶胞结构如图所示(已知
、F三种元素组成)的长方体晶胞结构如图所示(已知 ),下列说法错误的是
),下列说法错误的是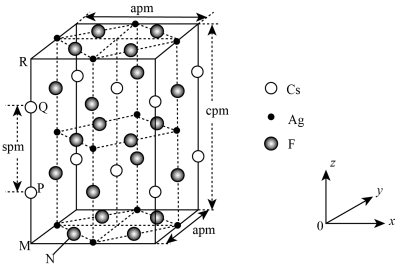
A.基态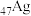 位于元素周期表的 位于元素周期表的 区 区 |
B.若N点原子分数坐标为 ,则P点原子分数坐标为 ,则P点原子分数坐标为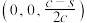 |
C.M、N之间的距离为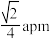 |
D.该晶体最简化学式为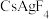 |
您最近一年使用:0次
2024-04-01更新
|
378次组卷
|
4卷引用:2024届湖南省岳阳市高三下学期第二次教学质量监测(二模)化学试题
2024届湖南省岳阳市高三下学期第二次教学质量监测(二模)化学试题广西钦州市第四中学2023-2024学年高二下学期3月考试化学试卷(已下线)提升练01 晶体结构及相关计算-【查漏补缺】2024年高考化学复习冲刺过关(新高考专用)(已下线)压轴题10?晶体结构及相关计算(5大题型+方法总结+压轴题速练)-2024年高考化学压轴题专项训练(新高考通用)
名校
解题方法
10 . 硅在自然界大部分以二氧化硅及硅酸盐的形式存在,它们的基本结构单位是硅氧四面体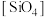 (图1)。石英晶体中的硅氧四面体相连构成螺旋链(图2)。天然硅酸盐组成复杂,硅、氧原子通过共用氧原子形成各种不同的硅酸根阴离子,一种硅酸根阴离子结构(图3)。下列说法不正确的是
(图1)。石英晶体中的硅氧四面体相连构成螺旋链(图2)。天然硅酸盐组成复杂,硅、氧原子通过共用氧原子形成各种不同的硅酸根阴离子,一种硅酸根阴离子结构(图3)。下列说法不正确的是
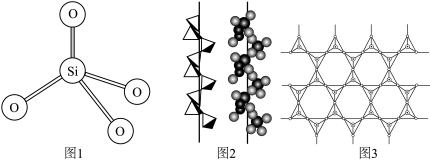
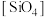 (图1)。石英晶体中的硅氧四面体相连构成螺旋链(图2)。天然硅酸盐组成复杂,硅、氧原子通过共用氧原子形成各种不同的硅酸根阴离子,一种硅酸根阴离子结构(图3)。下列说法不正确的是
(图1)。石英晶体中的硅氧四面体相连构成螺旋链(图2)。天然硅酸盐组成复杂,硅、氧原子通过共用氧原子形成各种不同的硅酸根阴离子,一种硅酸根阴离子结构(图3)。下列说法不正确的是
A.基态 原子的原子核外的电子有8种空间运动状态 原子的原子核外的电子有8种空间运动状态 |
| B.二氧化硅中硅原子的配位数是4 |
C.图2中Si原子的杂化轨道类型是 |
D.图3硅酸根阴离子结构中硅和氧的原子个数比为 |
您最近一年使用:0次
2023-12-01更新
|
324次组卷
|
3卷引用:安徽省江淮十校2024届高三上学期第二次联考化学试题



